概要
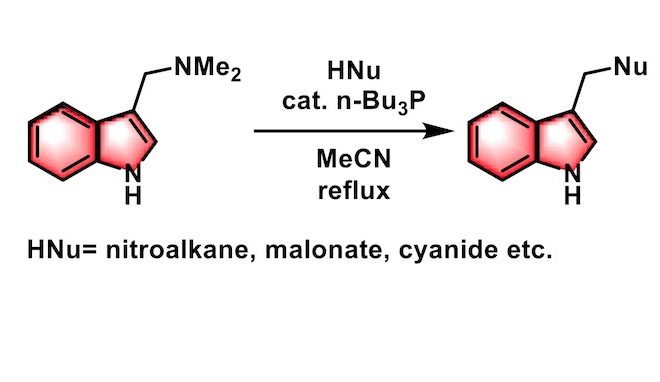
Somei-Kametani 反应(Somei-Kametani reaction)又称为Somei-Kametani偶联(Somei-Kametani coupling),是在三正丁基膦催化下,碳亲核试剂(尤其硝基烷烃)与芦竹碱(gramine又称为禾草碱)及其衍生物之间的选择性单烷基化过程。该反应由日本神奈川县立大学(Kanazawa University) 的染井正德(Somei Masanori)与龟谷哲治(Kametani Tetsuji)1981年首次报道。该反应现已广泛应用于各类天然产物的全合成。
基本文献
- [1] M. Somei, Y. Karasawa, C. Kaneko, Heterocycles, 1981, 16, 941. doi: 10.3987/R-1981-06-0941.
- [2] T. Kametani, N. Kanaya, M. Ihara, J. Chem. Soc., Perkin Trans. 1, 1981, 959. doi: 10.1039/P19810000959.
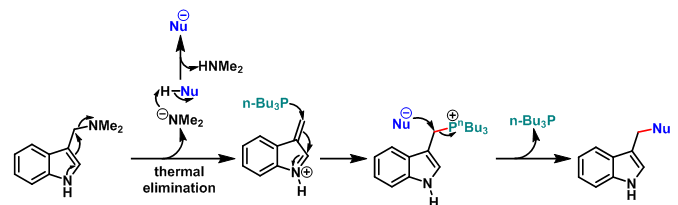
反应机理
反应实例
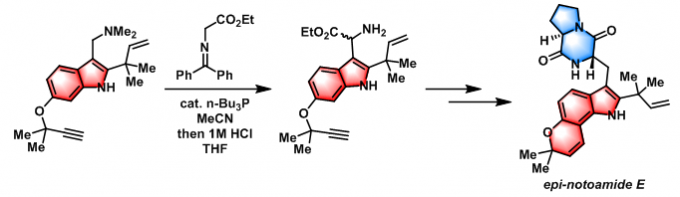
epi-notoamide E 的全合成[1]
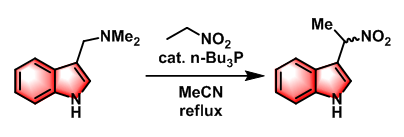
硝基烷烃参与的单烷基化[2]
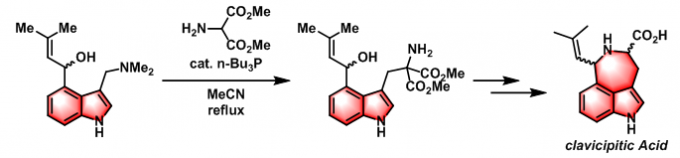
clavicipitic Acid的形式全合成[3]
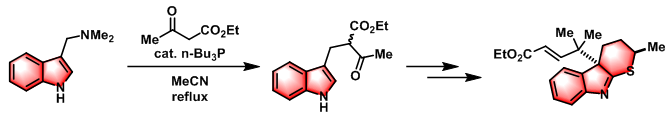
具有季碳中心的thioindoline的非对映选择性合成[4]
实验步骤
向三口烧瓶中加入芦竹碱(1 eq.)与硝基烷烃(3.5 eq.)的乙腈溶液(0.3 M),开启搅拌。随后,再向上述反应混合物中加入n-Bu3P (0.3eq.)及适量乙腈溶剂。在氩气气氛下,将上述反应液回流4 h。减压除去溶剂后,将上述反应液用0.5M HC1酸化,并用DCM-MeOH (19:1 v/v)萃取,将合并的有机相依次用饱和食盐水洗涤及无水Na2SO4干燥,减压除去溶剂后,将所得油状物通过PTLC分离纯化,获得最终目标产物。
实验技巧
参考文献
- [1] T. J. McAfoos, S. Li, S. Tsukamoto, D. H. Sherman, R. M. Williams, Heterocycles. 2010, 82, 461. doi: 10.3987/COM-10-S(E)19.
- [2] M. Somei, Y. Karasawa, C. Kaneko, Heterocycles, 1981, 16, 941. doi: 10.3987/R-1981-06-0941.
- [3] D. A. Boyles, D. E.Nichols, J. Org. Chem. 1988, 53, 5128. doi: 10.1021/jo00256a039.
- [4] A. V. Novikov, A. Sabahi, A. M. Nyong, J. D. Rainier, Tetrahedron: Asymmetry 2003, 14, 911. doi: 10.1016/S0957-4166(03)00077-6.
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!





















No comments yet.