作者:易洪舟
导读:
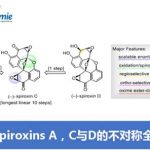
近日,江西师范大学国家单糖化学合成工程技术研究中心孙建松研究员团队利用Hauser-Kraus环化和俞氏糖苷化,研究了Chartreusin型多环芳基聚酮糖苷的化学合成,成功建立了化学结构复杂且具有良好生物活性的Chartreusin衍生物的化学合成方法。在此基础上,首次完成了Chartreusin、D329C、Elsamicin A和B的化学合成。该策略的特点是利用两条互补的途径来获得此类衍生物合成的关键中间体——Chartarin C10-O单糖糖苷以及实现此类极具挑战性糖苷键的高效构建。此外,在所建立的化学合成策略的帮助下,对Chartreusin衍生物针对人肿瘤细胞的毒性进行了测试,结果表明Chartreusin、Elsamicins A和B均具有极佳的抗肿瘤细胞活性。同时基于RNA序列分析,研究了它们对卵巢癌细胞ES-2的潜在作用机制,揭示了其糖链依赖的作用机制。该成果于近期发表在Chem. Sci.上。
Collective total synthesis of chartreusin derivatives and bioactivity investigations.
Hong-Zhou Yi‡, Shu-Min Liang‡, Jing-Jing Li*, Hui Liu, Jin-Xi Liao*, De-Yong Liu, Qing-Ju Zhang, Ming-Zhong Cai* and Jian-Song Sun*.
Chem. Sci., 2025, 16, 1241-1249. DOI: 10.1039/D4SC05629A
正文:
多环芳基聚酮糖苷(APP)是一大类天然产物。该类糖苷以阿霉素(doxorubicin)和蓝道霉素(landomycins)为代表,以其优异的生物活性和复杂的化学骨架而备受药理学家和化学家们的关注。Chartreusin是从土壤来源的教酒链霉菌的发酵液中分离得到的一种多环芳基聚酮糖苷,以其为首,形成了一个包含5个家族成员的多环芳基聚酮糖苷家族。该类糖苷的特点是甙元部分为独特的平面萘并吡喃酮结构且包含两个内酯,这与其他类似物是不同的。 
图1 Chartreusin型APP糖苷的化学结构
Chartreusin型APP糖苷具有良好的抗肿瘤活性:Chartreusin可显著抑制多种肿瘤细胞系的增殖,包括小鼠的P388、L1210白血病和B16黑色素瘤细胞;而由放线菌产生的Elsamicin A(Elsamitrucin)和Chartreusin的前药IST-622已进入肿瘤治疗的II期临床试验。然而,因为分离提取或生物合成所得到该类糖苷有限,并且无法进行结构修饰改造,所以无法满足药物开发研究。因此,需要建立高效的化学合成方法来满足该类分子的大量获取。
Chartreusin及其类似物的化学合成到目前为止尚未实现,原因主要有如下几个方面,1)甙元chartarin的合成缺少高效灵活的合成策略;2)作为糖苷化受体的Chartarin,由于平面五环萘并吡喃酮结构,在糖苷化的常用溶剂中溶解度极差,且其C10-OH为活性较普通醇羟基更低的萘酚羟基,受双内酯结构吸电子作用和C10-OH参与分子内氢键的形成的共同影响,该羟基进行糖苷化的难度极大。此外,分子内的稀有糖,特别是Elsamicin A和B中的C3具有甲基分支的岩藻糖,可能会进一步加剧C10酚糖苷键形成的困难;3)Chartreusin衍生物中所有糖链内的糖苷键都是1,2-顺式糖苷键,其立体选择性高效构建一直以来是糖化学合成中的重要挑战;4)糖链中包含多个稀有单糖,其制备路线繁琐,增加了Chartreusin衍生物化学合成的复杂性。
作者认为化学合成策略的成功开发将高度依赖于Chartarin C10-O单糖糖苷的高效合成。因此,通过逆合成分析,Chartreusin(1)、D329C(2)、Elsamicin A(3)和B(4)可以追溯到单糖糖苷A(图2),而单糖糖苷A可以通过两种不同的途径进行合成。途径a涉及糖苷化的氰基苯酞B与香豆素C之间的Hauser-Kraus环化反应,其特点是在完整的甙元Chartarin核心骨架制备之前完成具有挑战性的酚类糖苷键的构建,从而避免直接构建困难的Chartarin C10-O糖苷键,并且也提高了合成方法的灵活性;同时,为了增强合成方法的高效性(途径b),作者将Chartarin受体E与单糖俞氏给体D直接进行糖苷化。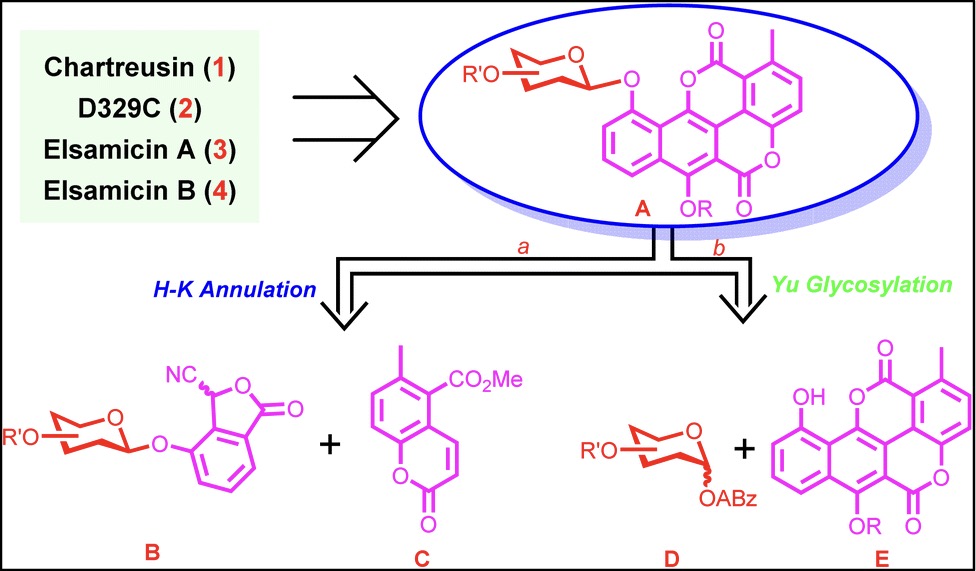
图2 逆合成分析
在构建完整的糖苷骨架之前,作者首先利用路径a,进行糖苷化的氰基苯酞中间体的合成。合成开始于全乙酰化的β-D半乳糖苷5与2-甲基-3-甲氧基羰基苯酚6进行糖苷化生成苯酚糖苷7(95%,单一β选择性)(图3A),随后依次对糖基部分和苷元部分进行调整得到岩藻糖糖苷化修饰的氰基苯酞11。C3-具甲基分支的岩藻糖糖苷化修饰的氰基苯酞的合成以丙酮叉保护的岩藻糖酚苷12为起始原料(图3B),通过多步基团调整,分别在C2和C4羟基上安装TBS和Pico基团得到俞氏给体20,以期通过空间位阻(来自TBS基团)和HAD策略(来自Pico基团)来诱导随后的糖苷化获得β-立体选择性。将20与6在PPh3AuNTf2作用下进行糖苷化生成苯酚糖苷21(76%,单一β选择性),然后对糖基部分和苷元部分进行调整得到C3具甲基分支岩藻糖糖苷化修饰的氰基苯酞24。在得到两个苯酞中间体后,作者使用氰基苯酞11和24与香豆素C进行关键的Hauser-Kraus环化反应(图3C)。经过大量的条件优化,作者发现选择t-BuOLi(1.1 eq)为碱效果最佳,11和24与C的环化分别能以63%和55%的收率完成。随后分别对11和24的C6-OH进行选择性TBDPS保护,成功合成了Chartreusin衍生物化学合成的关键中间体——Chartarin 10-O单糖糖苷26和28。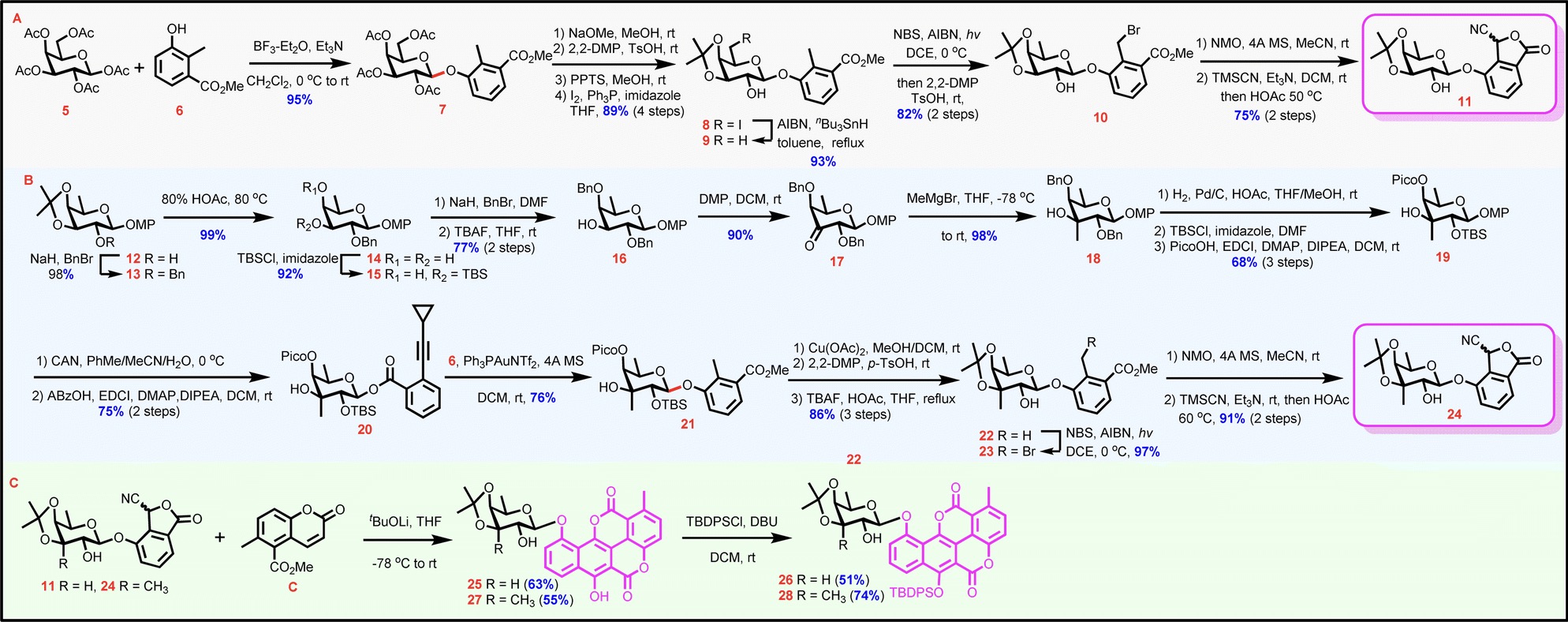
图3 经路径a合成Chartarin 10-O单糖糖苷26和28
随后作者尝试通过路径b合成关键的Chartarin 10-O单糖糖苷中间体,该路径将Chartarin衍生物受体直接糖苷化。作者使用TBDPS保护C6-OH,大大提升了分子的溶解性,合成出Chartarin受体31(图4A)。通过筛选一系列具有不同保护模式的俞氏单糖给体发现C3具有甲基分支岩藻糖邻-环丙基乙炔基苯甲酸酯34和40是受体31的可行给体(图4B)。由于Pico基团的存在,在Ph3PAuOTf的催化下,根据HAD策略,31与34和40的糖苷化顺利进行,分别以52%和66%的收率得到41和42,并具有中等至良好的β-立体选择性(41:α/β = 1:2.8 . 42:α/β = 1:6.7,图4C)。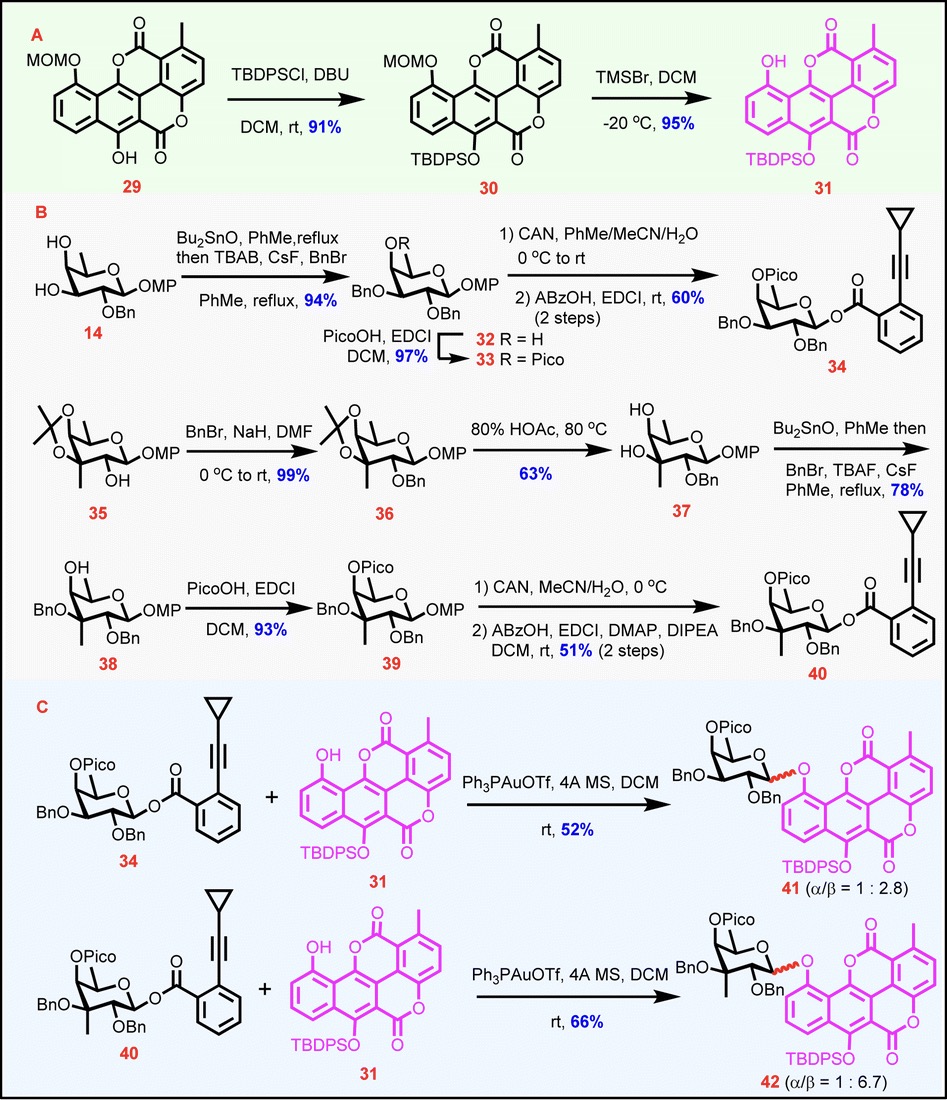
图4 经路径b合成Chartarin 10-O单糖糖苷41和42
单糖糖苷26,28,41,42的成功获得为首次实现Chartreusin衍生物的全合成奠定了坚实的基础。随后,作者设计了具有远程参与效应的C4-OLev给体来完成1,2-顺式糖苷键的构建(图5)。从14出发,分别合成两个岩藻糖给体45a和45b;而C2-脱氧-2-叠氮给体45c的合成则是从12出发,经C2-OH翻转、Tf活化和TMSN3取代实现叠氮的安装,再进行部分保护基团的调整获得。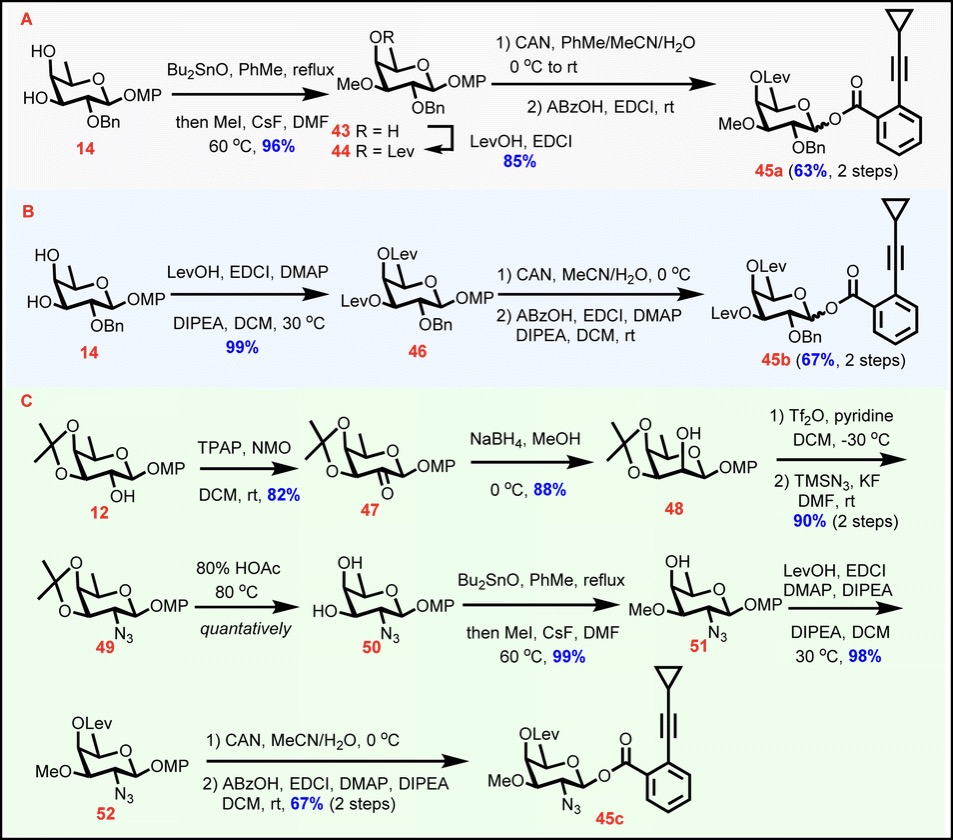
图5 制备天然Chartreusin衍生物所需的单糖给体45a–c
获得Chartarin 10-O单糖糖苷和45a-c后,作者着手进行四个目标分子的合成(图6)。在Ph3PAuOTf的催化下,给体45a与受体26的糖苷化反应顺利进行,得到了立体选择性二糖糖苷53(88%)。接着脱除保护得到Chartreusin(1)(图6A)。作者发现酚羟基未保护的Chartarin单糖糖苷25也可以作为可行的受体与给体45b进行糖苷化,立体选择性的生成55a(89%)。再进行酚羟基保护与Bn脱除得到二糖受体57,与45a进行糖苷化以α-立体选择性地得到了完全保护的D329C 58(92%)。最后脱除全部保护完成了D329C(2)的合成(图6B)。对于Elsamicin A的合成,由于C3具甲基分支岩藻糖的C2-OH具有严重的位阻,即使在优化条件后使用DMF作为添加剂,在PhCF3中50 ℃进行糖苷化,其立体选择性仍然不佳,并且收率也受到损失,还伴随着部分TBDPS的脱落。因此,在不分离糖基化产物中间体的情况下,连续进行糖苷化和随后的脱除TBDPS,以52%的收率得到二糖苷59(α/β = 4:1)。然后进行保护基的脱除以及N3还原得到Elsamicin A(3)(图6C)。最后用27脱除丙酮叉完成Elsamicin B(4)的合成(图6D)。所有合成的化合物1–4的NMR光谱与文献报道的一致(对于Elsamicin A(3),使用其衍生物61的数据与文献的数据比较),证实了新化学合成策略得到的1–4的化学结构的正确性。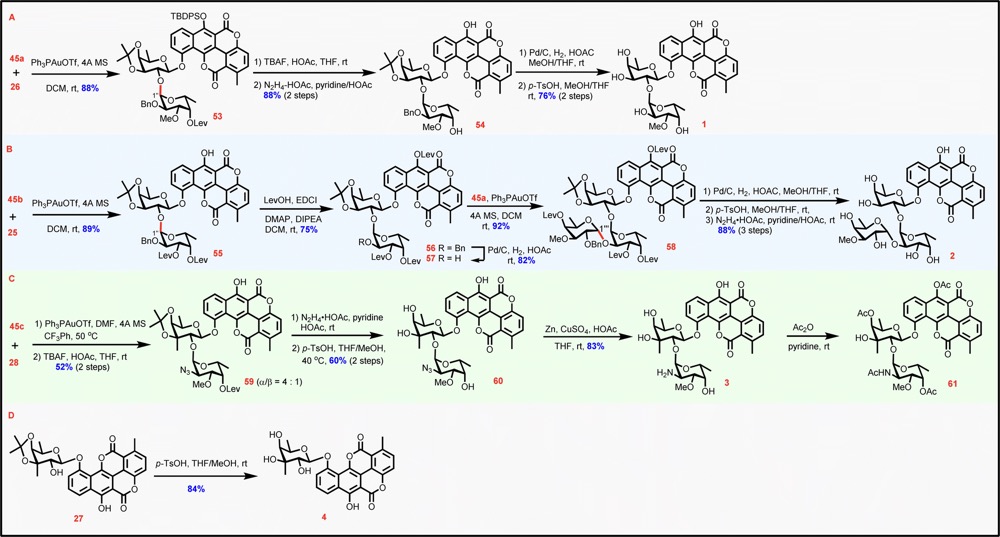
图6 完成目标分子1–4的合成
得到目标产物1–4后,作者测试了它们对人肿瘤细胞HCT116,BxPC3,T47D以及ES-2的细胞毒性(表1)。结果表明Elsamincin A(3)及B(4)对这四种肿瘤细胞均展示出了优异的活性,其IC50值均低于31.0 μM。Chartreusin (1) 对细胞系HCT116, BxPC3 和ES-2 同样展示出了很高的活性(IC50低于13 μM),而其对 T47D 的活性则较弱。具有更为复杂糖链结构的D329C(2)却出乎意料地未表现出明显的细胞活性。
表1 1–4对人肿瘤细胞的细胞毒活性a
| Tumor cellsb | IC50[μM] | |||
| 1 | 2 | 3 | 4 | |
| HCT116 | 12.93 | —c | 6.99 | 6.55 |
| BxPC3 | 3.35 | 751.32 | 4.04 | 4.28 |
| T47D | 911.20 | —c | 4.72 | 15.05 |
| ES-2 | 5.70 | —c | 1.00 | 30.99 |
a采用CCK-8法测定IC50值。bHCT116 =人结肠癌细胞系,BxPC3 =人胰腺癌细胞系,T47D =人面包癌细胞系,ES-2 =人卵巢癌细胞系。c未检测到细胞毒活性。
多环芳基聚酮糖苷作为二期临床失败药物,其主要原因在于其胆道排泄速度过快,胃肠道吸收过慢,从而影响了其药代动力学,阻碍了其在临床上的进一步应用。然后目前随着临床医学的发展,给药形式也发生了多种改变。例如针对卵巢癌,就开发了其热灌注疗法。而这一治疗手段的改变,可能会扩展芳基聚酮类糖苷在临床上的应用。为此作者对其作用机制进行了进一步的研究,为后续其在临床应用上的开发奠定基础。作者采用了RNA测序分析,以全面揭示其转录谱的变化,并据此推断出潜在的功能机制(图6)。热图显示,芳基聚酮糖苷衍生物1、3和4显著改变了ES-2的全局转录谱,其中化合物1的差异表达基因(DEGs)为380,化合物3和4分别为1186和1867(图6A)。受这些结果的鼓舞,通过Kyto基因和基因组百科(KEGG)分析,对其中最重要的途径进行了富集,以阐明其潜在的功能机制(图6B、C和D)。对于Chartreusin(1),下调的氧化磷酸化(OXPHOS)途径得到了富集,这对于某些类型的癌细胞的存活是必不可少的。而对于Elsamicin A(3),尽管其与Chartreusin(1)的差异仅在于末端糖残基,但其细胞毒性作用主要归因于运动蛋白、生长激素合成/分泌/作用以及同源重组通路,而Hippo信号通路富集使得Elsamicin B(4)对ES-2细胞发挥抑制作用。运动蛋白和生长激素水平的降低将不可避免地导致肿瘤细胞增殖的减慢,而同源重组的减少将导致DNA损伤,包括双链断裂(DSBs)和链间交联(ICLs),所有这些都与获得的细胞毒性结果一致。此外,Hippo信号通路也已被证明对癌症的生长和生长起着重要作用。化合物1、3和4在各类富集通路上的差异如此之大,表明苷元上所连接的糖链起着至关重要的作用。此外,针对芳基聚酮糖苷类化合物糖链依赖的工作机制的发现,也为后续能够开发新的克服潜在耐药性的Chartreusin类糖苷类抗肿瘤药物提供了希望。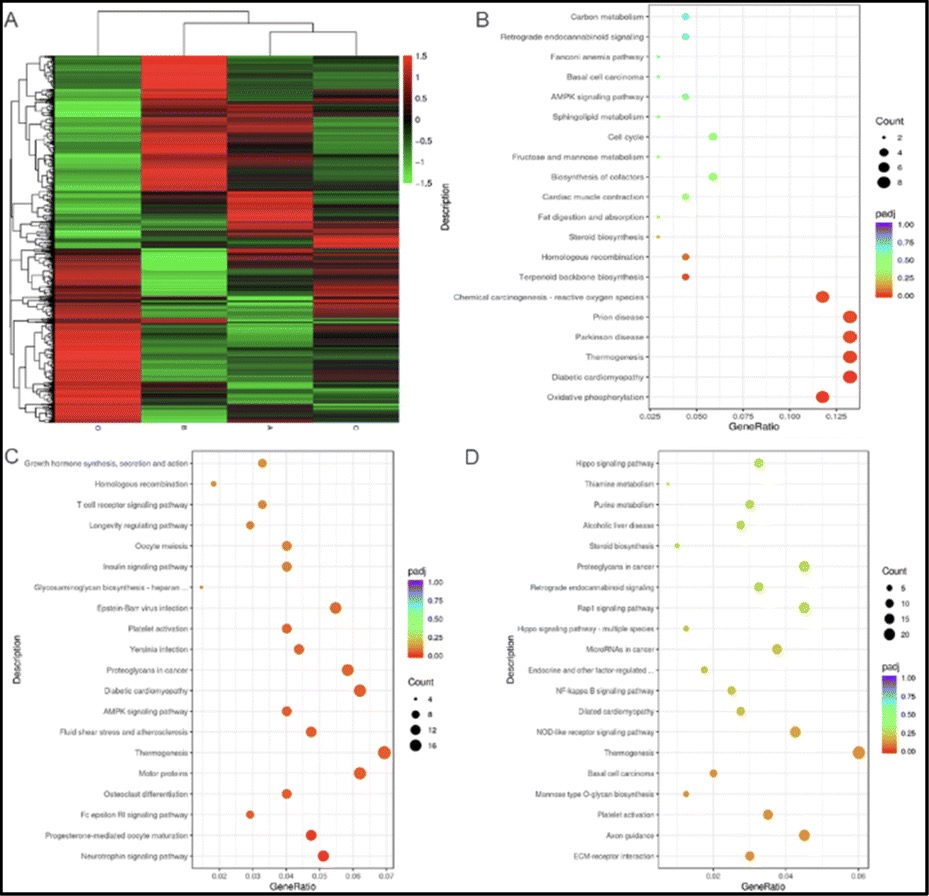
图7 RNA测序分析。(A)差异表达基因热图:红色,表达上调;绿色,表达下调;(B)1 (5.70 μM)处理后下调基因KEGG富集分析;(C)3(1.00 μM)处理后下调基因KEGG富集分析;(D)4(30.99 μM)处理后下调基因的KEGG富集分析
总结:
综上所述,本文建立了一种高效的化学制备Chartreusin型APP糖苷的策略,首次成功合成了Chartreusin、D329C、Elsamicin A和B,并评价了它们对人肿瘤细胞HCT116、BxPC3、T47D和ES-2的细胞毒作用,其中Elsamicin A和B显示出了优越的生物活性。同时基于RNA-测序分析,研究了Chartreusin、Elsamicin A和B对ES-2细胞的作用机制,揭示了其糖链依赖的作用机制。
江西师范大学博士研究生易洪舟为论文第一作者,梁淑敏硕士为共同第一作者,孙建松研究员、蔡明中教授、廖进喜副研究员和山东第二医科大学李晶晶副教授为通讯作者,该研究得到了国家自然科学基金(22177042,82104289,22377038)、北京市自然科学基金(L212015)的支持。
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载.
关注Chem-Station抖音号:79473891841






















No comments yet.