本文作者:杉杉
导读
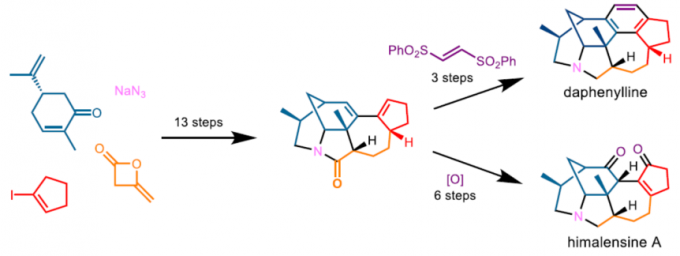
近日,中科院广州生物医药与健康研究院邱发洋课题组在Angew. Chem. Int. Ed.上发表论文,报道了一种可快速构建虎皮楠生物碱(Daphniphyllum alkaloids)核心骨架的有效策略,可分别通过16步和19步完成(-)-daphenylline和(-)-himalensine A的全合成。
A General Strategy for the Construction of Calyciphylline A type Alkaloids: Divergent Total Syntheses of (-)-Daphenylline and (-)-Himalensine A
FayangQiu, Bingyang Wang, Bo Xu, Wen Xun, YimingGuo, and Jing Zhang
Angew. Chem. Int. Ed. ASAP DOI:10.1002/anie.202016212
正文
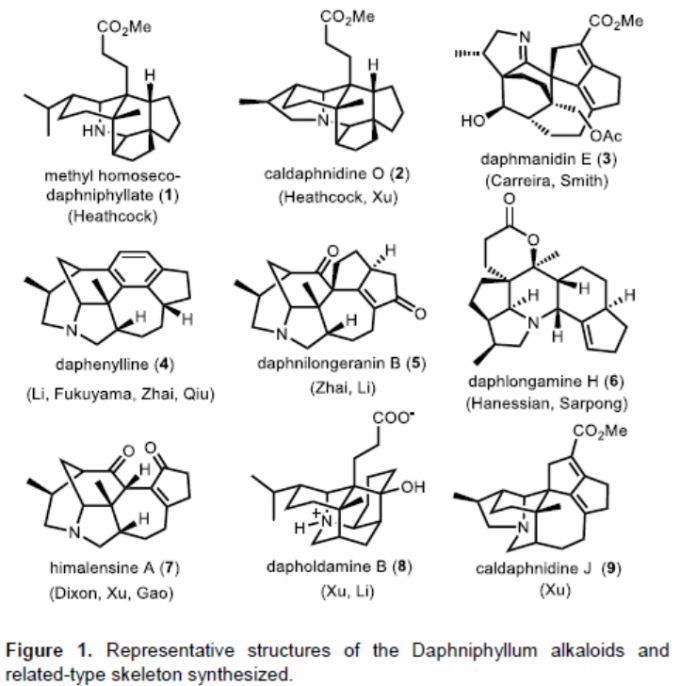
早在110年前,研究者就已对植物中的虎皮楠生物碱进行了相关的研究,其中Yagi等首次从D. macropodum中分离出一种C30型虎皮楠生物碱daphnimacrine,但直到1966年Hirata等通过X-射线晶体学才确定此结构。此后,已从虎皮楠生物碱属中分离出320多种生物碱。基于骨架的多样性,虎皮楠生物碱可分为20多种类型。同时,此类生物碱具有复杂的氮杂多环碳骨架(Figure 1)。此外,虎皮楠生物碱具有广泛的生物学活性,如抗癌、抗HIV、抗氧化和血管舒张活性。在1986年至1995年期间,Heathcock等[1]完成了几项非常出色的全合成。随后,也有近二十个课题组也报道相关研究工作。尽管已取得一定地进展,但仍需开发一种更为高效且通用的合成虎皮楠生物碱的策略。
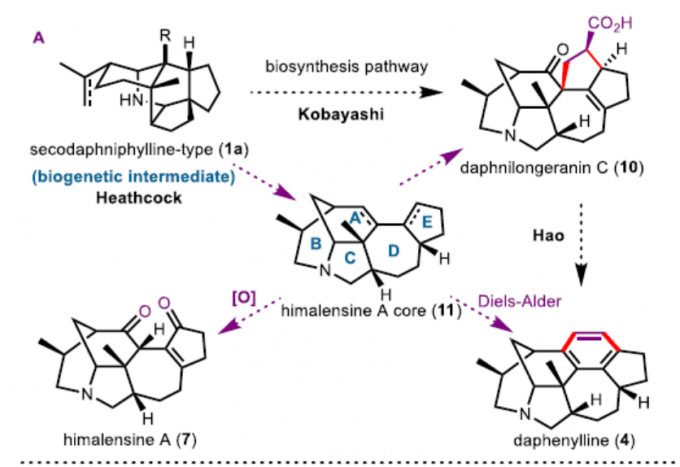
2003年,Kobayashi等[2]报道了calyciphylline A型骨架可能源于yuzurimine A型生物碱。2009年,Hao等[3]报道了一种涉及生物法的daphenylline合成途径。而daphenylline(4)通过calyciphylline A型生物碱Wagner-Meerwein环扩张获得。受此启发,Li[4]和Zhai[5] 等分别报道了daphenylline的全合成。尽管重排作为实现daphenylline全合成(4)的有效策略,但作者认为,可通过分离出的himalensine A(7)骨架[6]作为合成calyciphylline A型生物碱(包括daphenylline)通用中间体,从而大大简化全合成路径(Figure 2A)。在此,作者报道了以[3,3]-Cope重排为特征进行himalensineA骨架的全合成,从而实现了(-)-daphenylline和(-)-himalensine A的全合成。
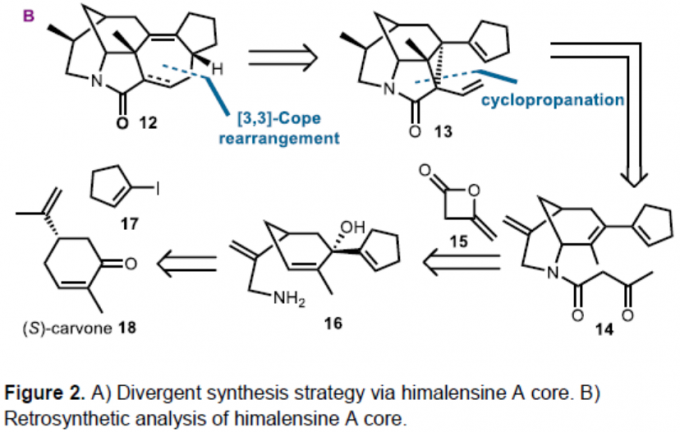
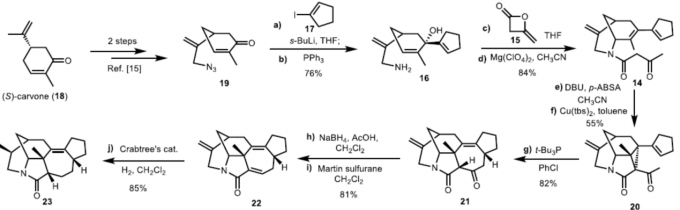
受Rh催化[4+3]环加成反应的启发,作者设想通过环丙烷化/ Cope重排以合成healensine A骨架(11)。因此,作者进行了逆合成分析(Figure 2B)。首先,通过中间体13的[3,3]-Cope重排从而合成中间体12,而中间体13可通过中间体14的环丙烷化获得。对于中间体14的合成,根据前期合成的氮杂桥环骨架[7],以(S)-香芹酮18和环戊烯基碘化物17为初始底物进而合成。
首先,作者以(S)-香芹酮18为初始底物,基于前期两步实验[7]合成烯丙基叠氮化物19。叠氮化物19与环戊烯基锂经1,2-加成,然后用PPh3还原叠氮基,可得到伯胺16,收率为76%。伯胺16中的氨基可与双烯酮15进行酰化和环化,可生成酰胺阻转异构体14,收率为84%。化合物14 在经p-ABSA和DBU条件下进行Regitz重氮转移和Cu(tbs)2催化的环丙烷化反应,获得环丙基内酯20。
随后,作者对关键的himalensine A骨架进行了合成,涉及[3,3]-σ重排。受Xu课题组相关文献的启发[8],作者通过对反应条件的进一步优化后发现,当环丙基内酯20在三叔丁基膦的氯苯中进行Cope重排时,可获得82%收率的环庚烯酮21。环庚烯酮21使用NaBH4还原和Martin硫烷脱水,可成α, β-不饱和酰胺22,收率为81%。之后,可用Crabtree催化剂进行区域和非对映选择性氢化反应,获得单一非对映异构体的化合物23,收率为85%。
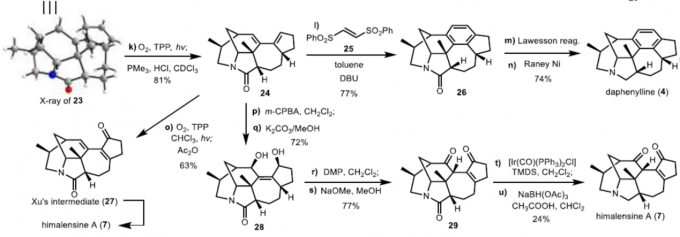
在获得关键的himalensine A骨架23之后,剩下的主要挑战则为后期的氧化。通过多次尝试后发现,使用四苯基卟啉(TPP)作为光敏剂,通过Schenck-ene反应[9],可实现23烯丙基转位氧化反应顺利进行,从而获得81%收率的二烯24。
接下来,以二烯24为通用的骨架,分别进行了(-)-daphenylline和(-)-himalensine A的全合成。通过大量的筛选以及受文献的启发[10],二烯24和反式1,2-双(苯磺酰基)乙烯25可在不锈钢高压釜的甲苯溶剂中150℃下加热,然后使用DBU一锅消除苯磺酰基,从而获得77%收率的[4+2]环加成产物26。最后,通过还原反应即可获得74%收率的(-)-daphenylline 4。
此外,通过用m-CPBA进行区域选择性环氧化、SN2’开环和除去苯甲酰基的过程,从而制得二醇28,收率72%。再经DMP氧化后,使用NaOMe异构化碳-碳双键,得到29,收率77%。最后,通过Ir催化化学选择性还原以24%的收率提供了(-)-himalensine A。
总结
中科院广州生物医药与健康研究院邱发洋课题组报道了一种可快速构建虎皮楠生物碱(Daphniphyllum alkaloids)核心骨架的有效且通用策略,以(S)-香芹酮18为初始底物,分别通过16步和19步完成了(-)-daphenylline和(-)-himalensine A的全合成。同时,通过Cu催化分子内环丙烷化和随后膦催化Cope重排,以合成healensine A骨架,通过Diels-Alder/芳香化以合成(-)-daphenylline芳香骨架。






















No comments yet.