本文作者:杉杉
导读
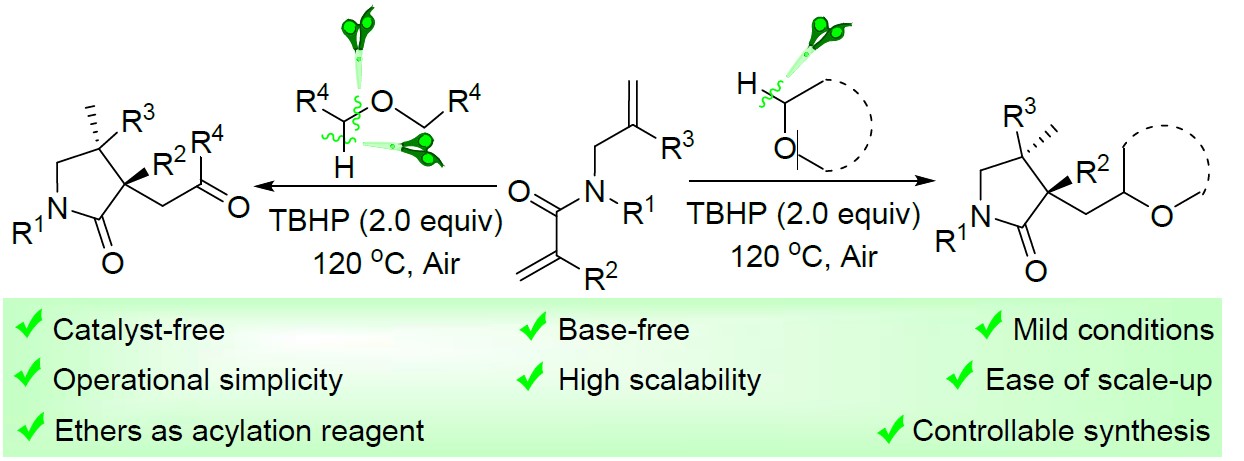
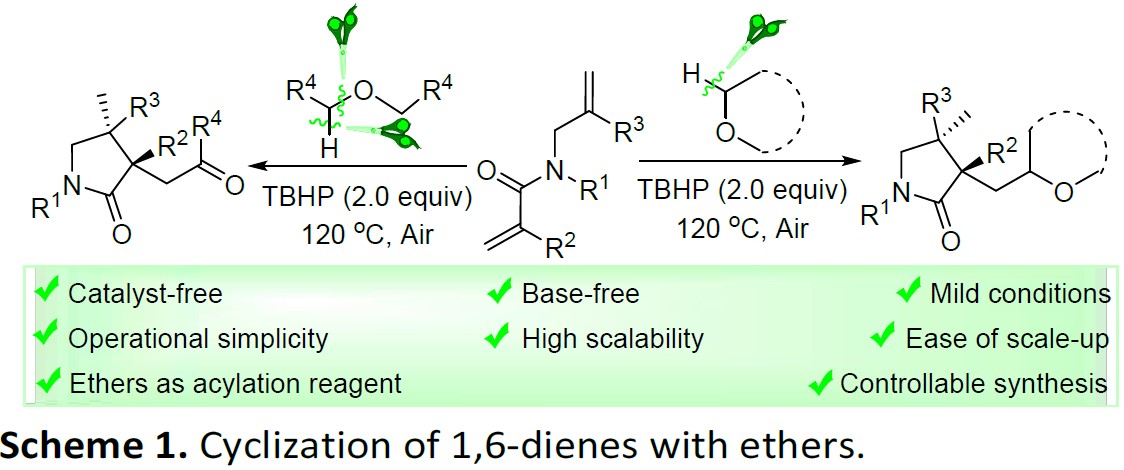
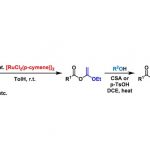
近日,宁波大学魏文廷课题组在绿色化学(Green Chemistry)发表论文,在无催化剂和无碱的条件下,实现醚与1,6-二烯的酰化/环化反应。该反应的关键之处在于,叔丁基过氧化氢(TBHP)可促进醚C(sp3)-H和C(sp3)-O键串联断裂。同时,也为实现酰化反应提供了一种直接有效的方法。该反应无需使用催化剂和碱,具有反应条件温和、扩展性高、操作简便、易于放大等特点。
Acylation/Cyclization of 1,6-Dienes with Ethers under Catalyst- and Base-Free Conditions
Xun-Jie Huang, Fu-Hua Qin, Yi Liu, Shi-Ping Wu, Qiang Li, and Wen-Ting Wei
Green Chem. ASAP DOI: 10.1039/D0GC00865F
正文
醚类化合物是一种广泛使用的有机溶剂,同时在化学上也是一种多功能的试剂,可通过C-H、C-C或C-O键的断裂来构建C-X(X=C、O、S、N等)键,从而获得具有价值的药理活性分子和天然产物。然而,醚的大多数研究都集中在O–α-C(sp3)-H键的直接官能化上。近来,已经报道了几种新颖的方法,在催化剂、碱或强氧化剂的存在下,使用醚作为碳源,从而构建新型化合物。据文献查阅,尽管醚的串联C(sp3)-H和C(sp3)-O键断裂已被大量报道,但其作为酰化试剂用于杂环的构建尚未研究,特别是在无催化剂和无碱的体系。
自由基介导的氢原子转移已被认为是化学转化中最可靠、最方便的过程之一。尽管在该领域已取得了重大进展,但在温和的反应条件下,寻找有效的绿色试剂来产生或终止自由基仍然是一个挑战。此外,1,n-二烯环化反应已成为合成化学中有效的工具,因为它们可以具有出色的选择性、官能团耐受性和高原子经济性等特点。然而,迄今为止,由醚的O-α-C(sp3)-H自由基官能化引发的1,n-二烯环化(尤其用作酰化试剂)尚未研究。在此,宁波大学魏文廷课题组报道了在无催化剂和无碱的条件,实现1,6-二烯与醚可的酰化/环化反应,涉及醚的连续C(sp3)-H键断裂、分子间加成、分子内环化、1,5-氢转移、单电子氧化和水解的过程(Scheme 1)。
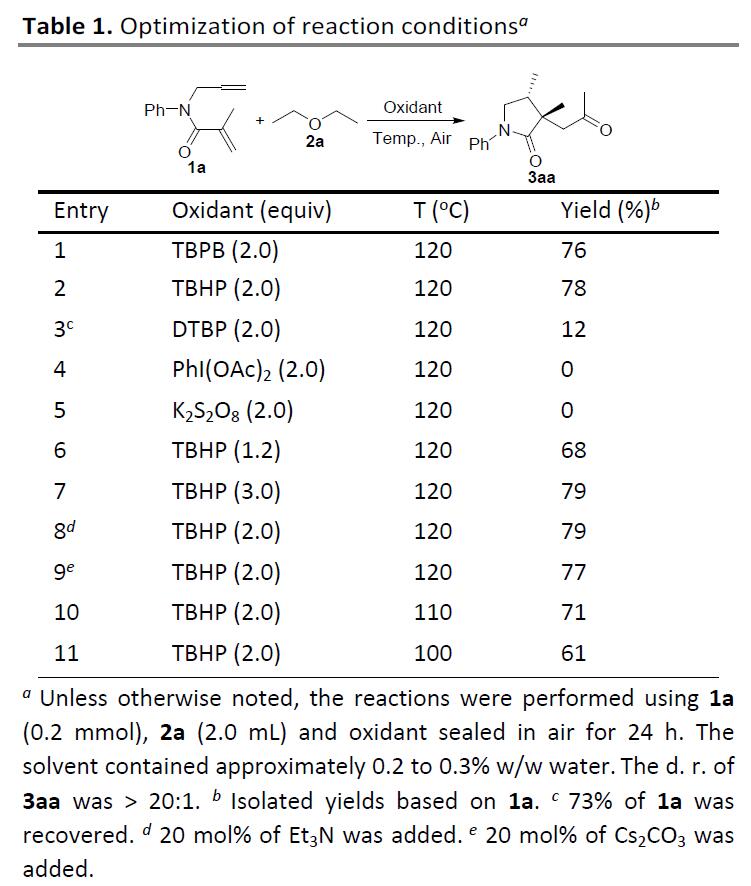
首先,作者以N-烯丙基-N-苯基甲基丙烯酰胺1a和乙醚2a作为模型底物,进行了相关环化反应条件的筛选(Table 1)。当使用过氧苯甲酸叔丁酯(TBPB,2.0当量)作为氧化剂时,在密封下120℃反应,获得目标产物3aa,收率为76%(entry 1)。随后,作者对其它氧化剂进行了筛选(如TBHP、DTBP、PhI(OAc)2和K2S2O8),反应结果表明,当使用TBHP时可将收率提高至78%,而无机氧化剂由于难以产生α-氧代自由基,导致未反应(entries 2-5)。同时,若将TBHP的量减少到1.2当量收率有所降低,而将TBHP的增加到3.0当量并不能进一步提高收率(entries 6-7)。此外,添加碱(Et3N或Cs2CO3)不会显着影响反应(条entries 8-9)。而将反应分别置于110℃和100℃下时,仅获得71%和61%收率的3aa(entries 10-11)。因此,使用2当量TBHP在120℃条件下作为最佳反应的条件。
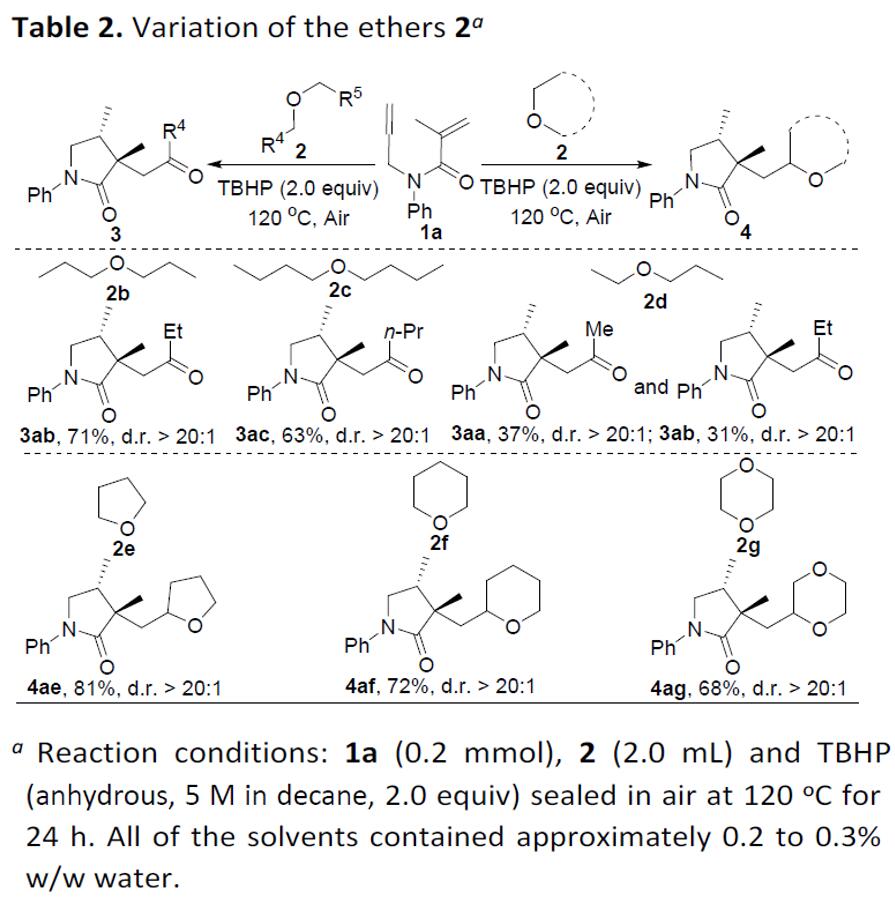
在获得上述最佳反应条件后,作者首先对醚的底物2进行了扩展(Table 2)。反应结果表明,常见对称性的线性醚(如二乙醚2a、二丙醚2b和二丁醚2c)均可与1a平稳反应,获得相应的产物3aa–3ac(63-78%)。而使用不对称线性乙基丙基醚2d进行反应时,获得C(sp3)-O键裂解的混合物3aa和3ab。但是,当使用环醚四氢呋喃(2e),四氢-2H-吡喃(2f)和1,4-二恶烷(2g)时,均未获得目标产物,仅获得中等收率的醚化/环化产物4ae–4ag。
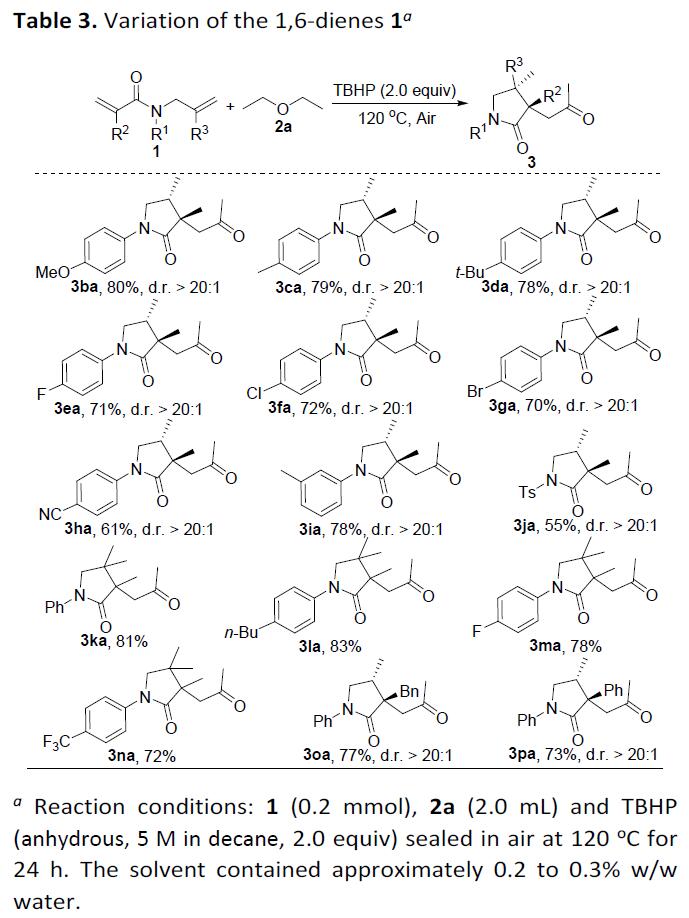
随后,作者对1,6-二烯底物(1)范围进行了相关的扩展(Table 3)。反应结果表明,在N-芳族环的对位上带有供电子基团(OMe,Me和t-Bu)或吸电子基团(F,Cl,Br和CN)的1,6-二烯均可与2a反应,获得中等至良好收率的产物3ba–3ha。同时,N-芳族环上取代基的电子效应影响反应收率,给电子基团的反应性高于缺电子基团。当N-芳环的间位上含有甲基时,可获得78%的收率的产物3ia。当使用N-Ts取代的1,6-二烯时,也获得55%收率的产物3ja。此外,在烯基(R3)的α位具有甲基取代基的1,6-二烯,如1k、1l、1m、1n,均可以良好的收率获得所需产物3ka–3na。值得注意的是,在苄基或苯基取代烯基(R2)α位上的甲基,也与体系兼容,从而获得相应的产物3oa和3pa。
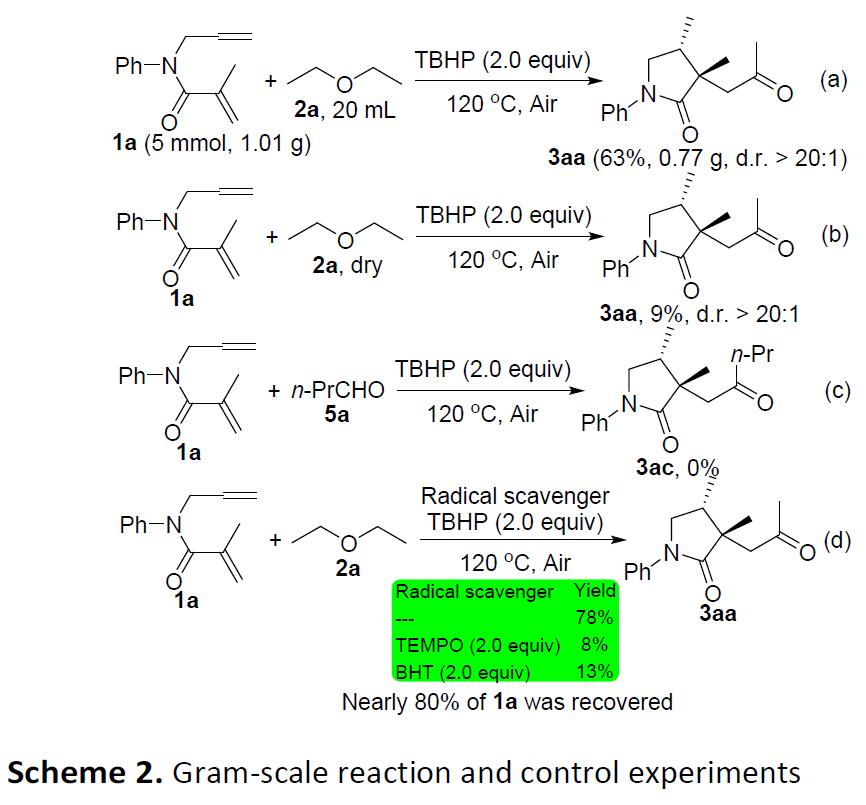
为了进一步证明该反应的实用性,作者进行了克级实验,当使用1a(5 mmol,1.01g)和2a(20 mL)在最佳条件下反应时,获得63%收率的产物3aa(Scheme 2a)。随后,为了进一步了解反应的机理,作者进行了相关的对照实验。首先,使用干燥的乙醚时,仅获得9%收率的3aa(Scheme 2b),表明H2O对于该转化是必不可少的。然而,将n-PrCHO 5a代替2c加入最佳反应条件时,未检测到所需的产物3ac,表明醛5a不是反应的中间体(Scheme 2c)。此外,使用2,2,6,6-四甲基哌啶-1-氧基(TEMPO)或2,6-二叔丁基-4-甲基苯酚(BHT)作为自由基捕获剂时,分别获得8%和13%收率的产物3aa,表明反应可能涉及一个自由基的过程(Scheme 2d)。
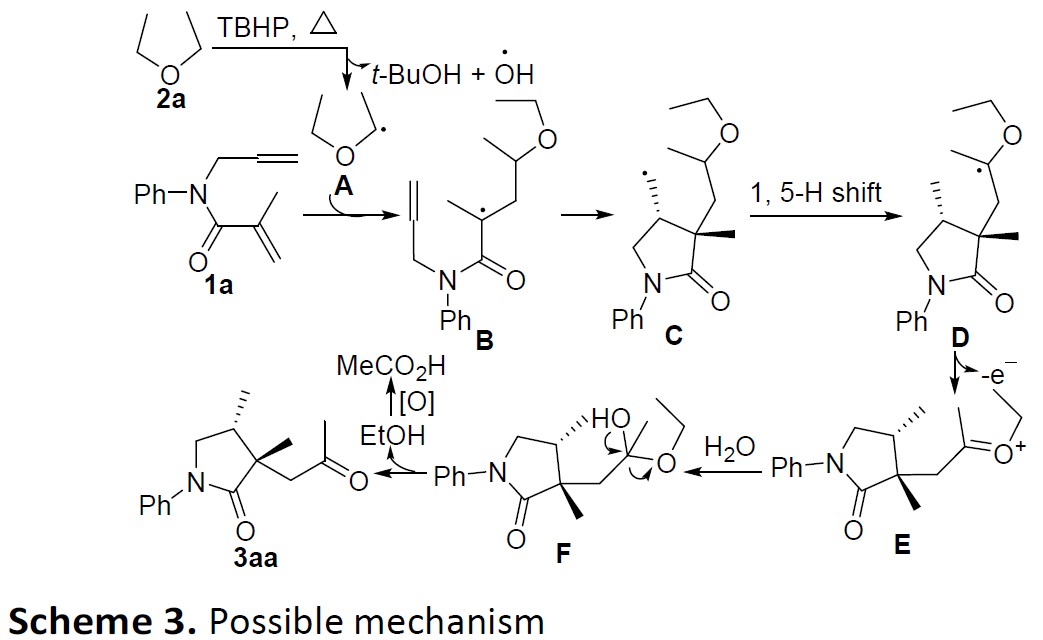
根据上述的实验和相关文献的查阅,作者提出了一种可能的反应机理(Scheme 3)。在TBHP加热条件下,2a经抽氢后获得α-氧代自由基A。紧接着,经分子间加成/分子内环化/1,5-氢转移,从而获得烷基自由基D。随后,D通过单电子氧化将其氧化为氧阳离子,经水解生成中间体F。最后,中间体F平稳地分解为产物3aa和EtOH。值得注意的是,当在最佳条件下使用环醚时,由于空间因子接近氧鎓阳离子,因此中间体E很难水解。
总结
宁波大学魏文廷课题组报道了,在无催化剂和无碱的条件下,实现醚与1,6-二烯的酰化/环化反应,涉及醚的连续C(sp3)-H键断裂、分子间加成、分子内环化、1,5-氢转移、单电子氧化、水解等过程。同时,该反应具有底物范围广泛、操作简便、易于放大、反应条件温和等特点。
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!




















No comments yet.