作者:苏打水
导读:
近日,湖南师范大学杨荣华教授、熊二虎教授团队在Angew. Chem. Int. Ed.中发表论文,报道一种简单无需改变序列的通用性核酸检测手段,通过将光响应基团连接到crRNA的2’-羟基(2’-OH)上以调控crRNA引导的Cas酶活性,并将其应用于核酸检测。
Universal crRNA Acylation Strategy for Robust Photo-Initiated One-Pot CRISPR-Cas12a Nucleic Acid Diagnostics.
Liu, P.; Lin, Y.; Zhuo, X.; Zeng, J.; Chen, B.; Zou, Z.; Liu, G.; Xiong, E.; Yang, R. Angew. Chem. Int. Ed. 2024, e202401486. doi: 10.1002/anie.202401486
正文:
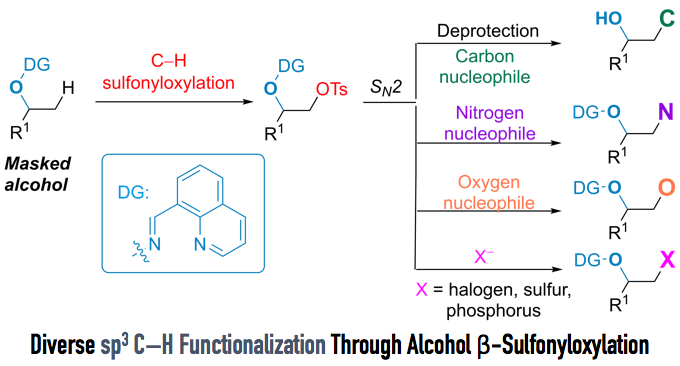
光激活的CRISPR-Cas系统能够更好地从空间和时间维度上调控crRNA引导的Cas酶活性,现有体系中,光响应基团的修饰位置和数量往往受制于靶标核酸序列,即当更换靶标核酸时,需要对整个光控体系进行重新设计和优化,通用性比较差,限制了光激活CRISPR-Cas系统的应用。因此作者旨在发明一种简单无需改变序列的通用性核酸检测手段1。2’-羟基(2’ -OH)是RNA核糖中的一个特征性官能团,与序列无关,最近的研究表明,使用酰基咪唑试剂可以通过2’-OH基酰化(“隐形”)破坏RNA的结构和功能,并在外部添加化学试剂时通过去除酰化加合物(“解隐形”)有效地恢复RNA的结构和功能2,3。crRNA的功能可以通过在2’-OH基团上附着光响应基团暂时封存,随后通过特定波长的光照射恢复。作者从该点切入,研究酰化策略,开发了多功能光启动一步式CRISPR核酸检测方法。

首先,作者合成了光笼剂,用于修饰crRNA链的2’-OH基团,通过聚丙烯酰胺凝胶电泳(PAGE)验证了crRNA的笼化以及光诱导脱笼过程,而后又使用365 nm紫外灯照射完全隐藏的crRNA,充分证实了光响应基团的引入都能有效抑制crRNA的功能,并在短时间的紫外光照射下快速恢复CRISPR-Cas12a的活性(Figure 1)。

接着,作者就crRNA的笼化和光诱导脱笼对CRISPR-Cas12a系统的影响进行了探究。crRNA的显著酰化和有效的光诱导去酰化使控制CRISPRCas12a系统的活性成为可能。Cas12a属于DNase酶,在识别目标后,Cas12a可以诱导目标双链或单链DNA (dsDNA或ssDNA)的位点特异性顺切,Figure 2a显示crRNA隐形时抑制了CRISPR-Cas12a系统的活性,而光诱导的crRNA解锁恢复了CRISPR-Cas12a系统的活性的原理图。为了初步评估隐藏的crRNA是否可以抑制Cas12a的顺式和反式切割活性,作者进行了PAGE和荧光动力学分析。Figure 2b观察到随着酰化时间的增加,Cas12a与被遮蔽crRNA偶联的裂解产物逐渐减少,表明酰化诱导的顺切抑制作用。Figure 2c表明crRNA的酰化对 CRISPR-Cas12a系统的反式切割活性也有显著的抑制作用。接下来评估了Cas12a与被遮蔽的crRNA的偶联是否会在光照下显示出恢复的活性,如图Figure 2d,e所示,随着光照射时间的延长,反式裂解活性逐渐恢复,且仅需60 s光照射足以恢复CRISPR-Cas12a的活性。为了阐明光诱导恢复CRISPR-Cas12a活性的普适应,分别对另外7个具有不同间隔区域的原始crRNA进行一步酰化反应,观察到类似的对CRISPR-Cas12a活性的抑制和恢复作用(Figure 2 f-h)。
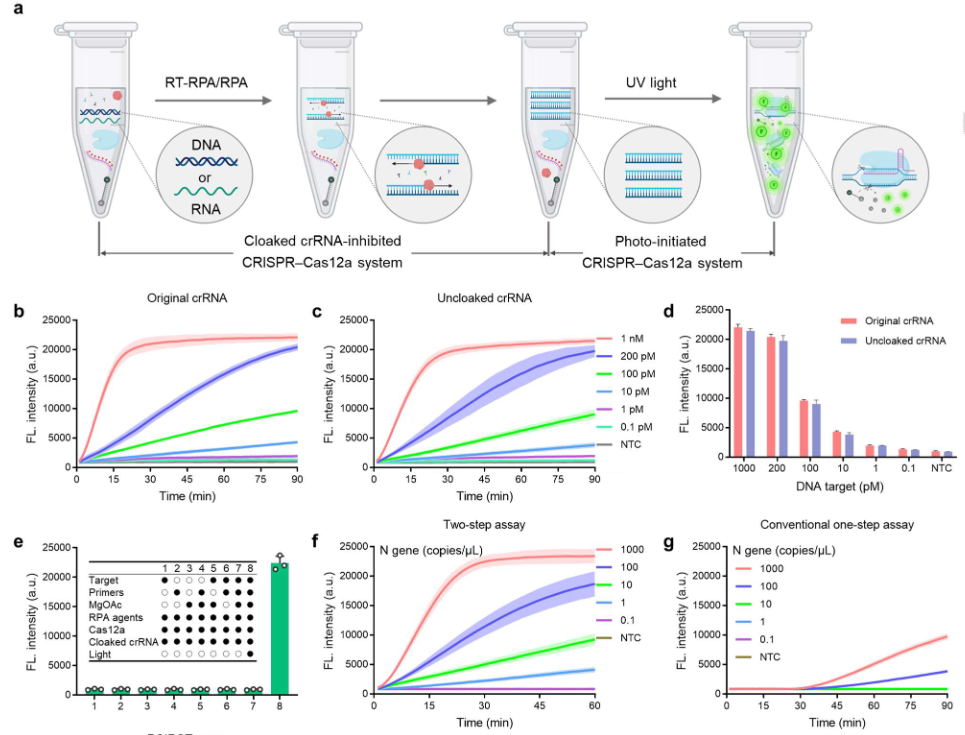
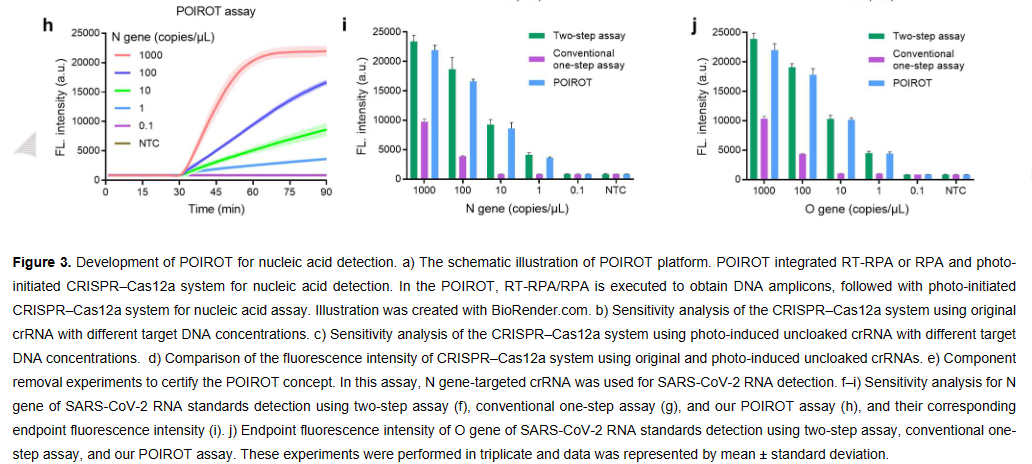
在研究了酰基化策略在控制CRISPR- cas12a活性方面的有效性之后,接下来作者建立了光启动的单管CRISPR测试方法(Robust One-pot Testing, POIROT) ,研究其核酸检测性能(Figure 3a)。使用等温核酸扩增技术(recombinase polymerase amplification , RPA)生成扩增物,用于后续的CRISPR反应。从Figure 3b-d中观察到对原始和光诱导的未隐藏crRNA的合成靶DNA的检测性能相似。Figure 3e的成分去除实验证明即使添加了所需的所有成分,在没有紫外线的情况下也不会产生荧光信号。然而,光照射后可以产生相当大的荧光信号。进一步地,结合逆转录- RPA (RTRPA)反应构建检测 (SARS-CoV-2) RNA标准的POIROT。分别利用原始crRNA(两步法和常规一步法)和隐藏crRNA (POIROT)检测SARS-CoV-2核衣壳蛋白基因(N基因),探讨了两步法、常规一步法和POIROT检测性能的差异。如Figure 3f-j所示,POIROT具有与两步法相当的优异分析能力,检测限为1 copy/μL,比传统的一步法检测法高近两个数量级。
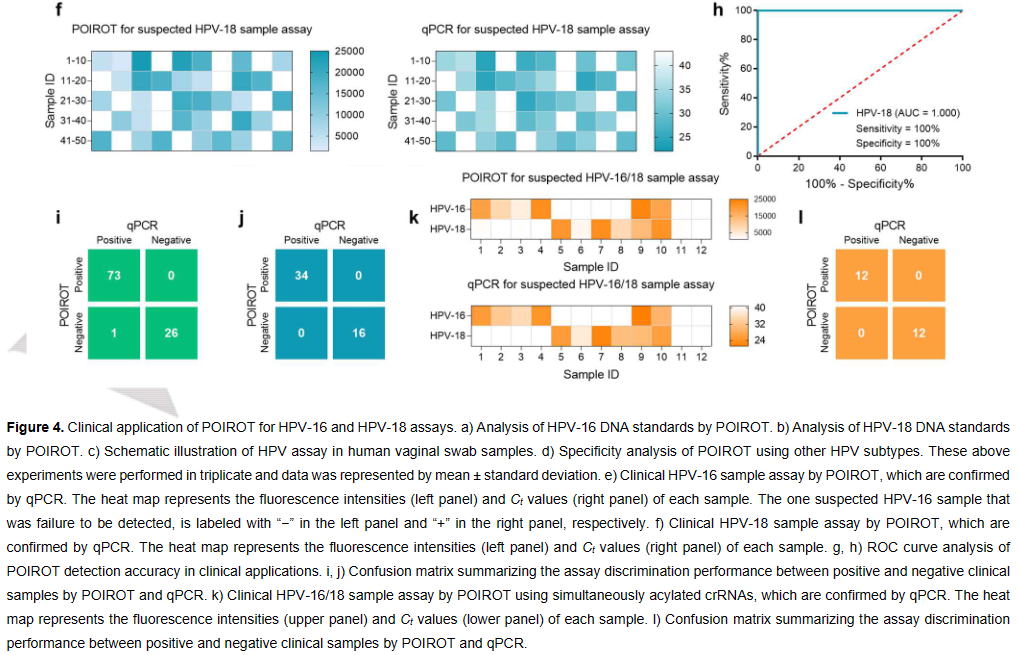
在实现了强大的单管SARS-CoV-2 RNA检测后,作者评估了人乳头瘤病毒(HPV) DNA检测的平台。通过检测和比较其他HPV亚型(如HPV-33、HPV-39、HPV-51、HPV-52、HPV-56、HPV-58、HPV-66和HPV-68)来探讨POIROT的特异性,只有HPV-16和HPV-18在其对应的crRNA存在的情况下能诱导出明显的荧光信号,而其他HPV亚型不能产生增加的荧光信号,表明POIROT具有良好的分析特异性(Figure 4)。随后通过对150例人乳头瘤病毒(HPV)临床样本进行测试,POIROT的测试结果展现出与金标准qPCR方法相当的灵敏度和特异性,表明该方法在临床诊断方面具有很好的应用前景(Figure 4)。
总结:
湖南师范大学杨荣华教授和熊二虎教授团队开发了一种通用的光控CRISPR技术,采用crRNA酰化策略实现了对Cas 12a的活性控制,从而实现了单管核酸分析,该方法为基于可控CRISPR的基因组编辑、疾病治疗和细胞成像方面的应用提供了新思路。
参考文献:
- [1] Y. Li, Y. Wu, R. Xu, J. Guo, F. Quan, Y. Zhang, D. Huang, Y. Pei, H. Gao, W. Liu, J. Liu, Z. Zhang, R. Deng, J. Shi, K. Zhang, Nat. Commun. 2023, 14, 7722.doi: 10.1038/s41467-023-43552-0
- [2] O. O. Abudayyeh, J. S. Gootenberg, S. Konermann, J. Joung, I. M. Slaymaker, D. B. Cox, S. Shmakov, K. S. Makarova, E. Semenova, L. Minakhin, K. Severinov, A. Regev, E. S. Lander, E. V. Koonin, F. Zhang, Science 2016, 353, aaf5573. doi: 10.1126/science.aaf5573.
- [3] H. Lei, T. Zeng, X. Ye, R. Fan, W. Xiong, T. Tian, X. Zhou, Adv. Sci. 2023,10, 2206433. Doi: 10.1002/advs.202206433
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载.





















No comments yet.