本文作者:杉杉
导读
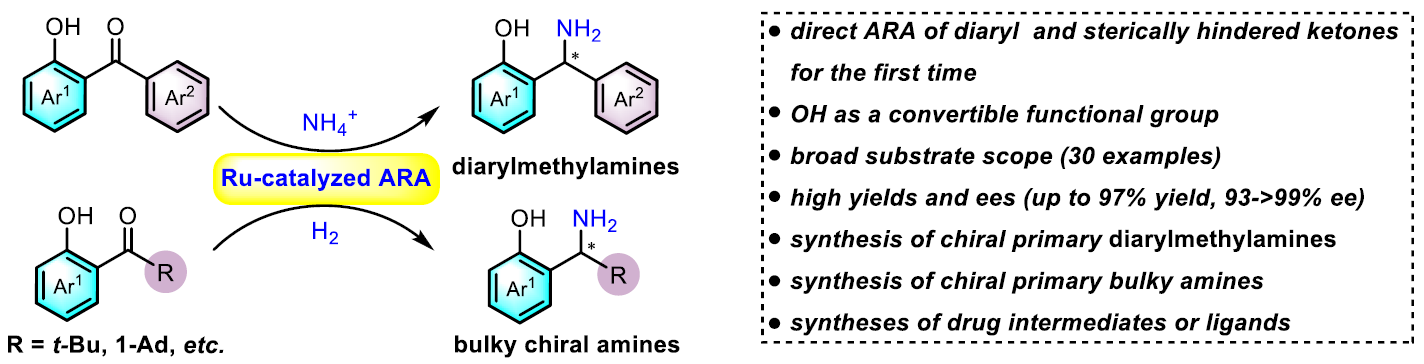
近日,南方科技大学张绪穆和殷勤教授团队在Angew. Chem. Int. Ed.发表论文,首次报道在钌催化邻羟基取代的二芳基酮和大位阻酮与铵盐之间直接不对称还原胺化反应,合成多种具有价值的手性伯二芳基甲胺和大位阻的苄胺衍生物(产率高达97%,ee高达93-99%)。此外,通过对产物后期转化,可获得一些更具价值的活性化合物或手性配体。文章链接DOI:10.1002/anie.201915459
正文
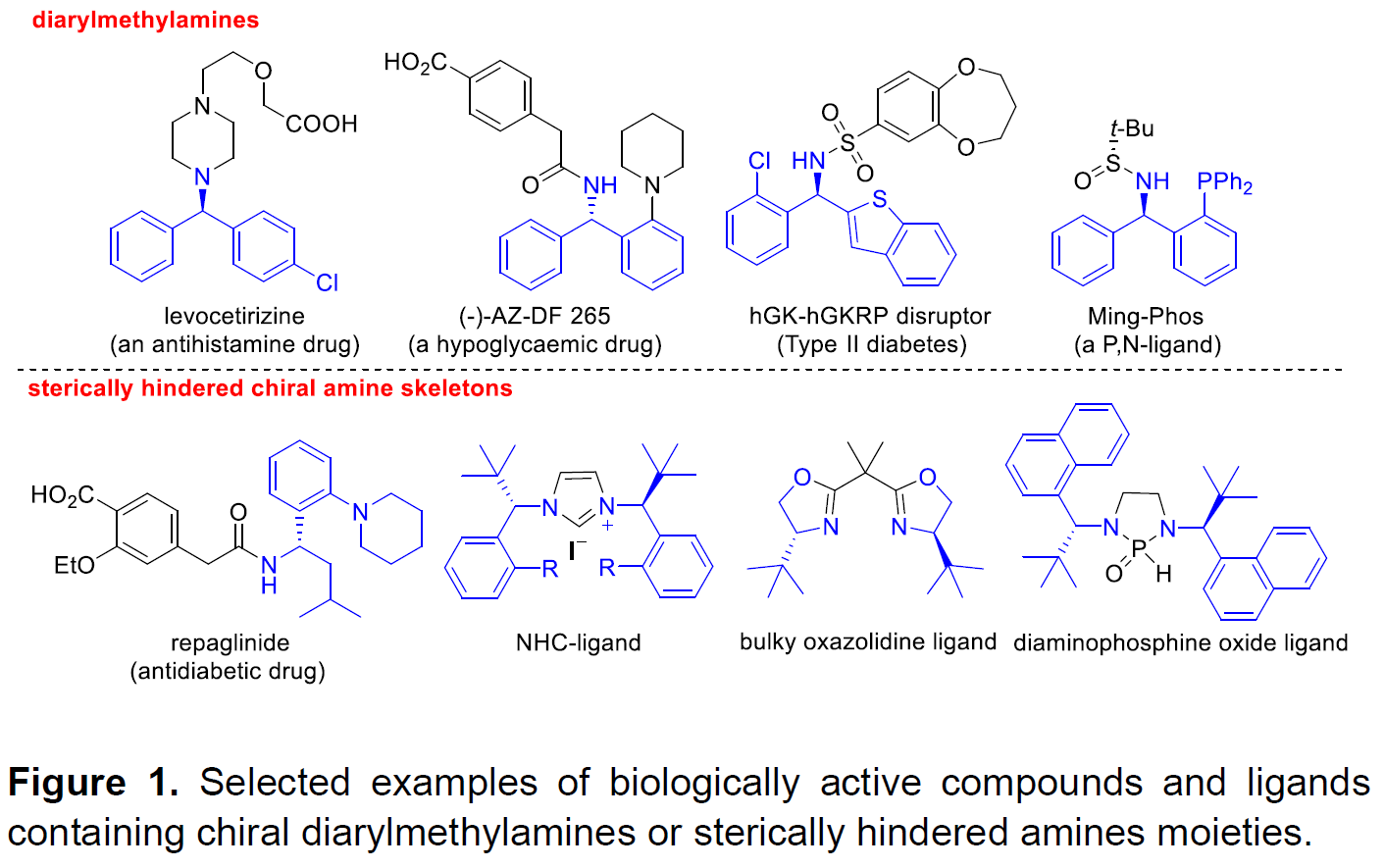
手性二芳基甲胺和大位阻胺在天然产物,药物和许多活性生物分子的合成中具有十分重要的应用。此外将其作为手性砌块用于配体和催化剂的设计也受到了合成化学家们的青睐(Figure 1)。因此,高效高对映选择性的合成这两类手性胺已引起了越来越多的关注,但仍然具有很大的挑战。
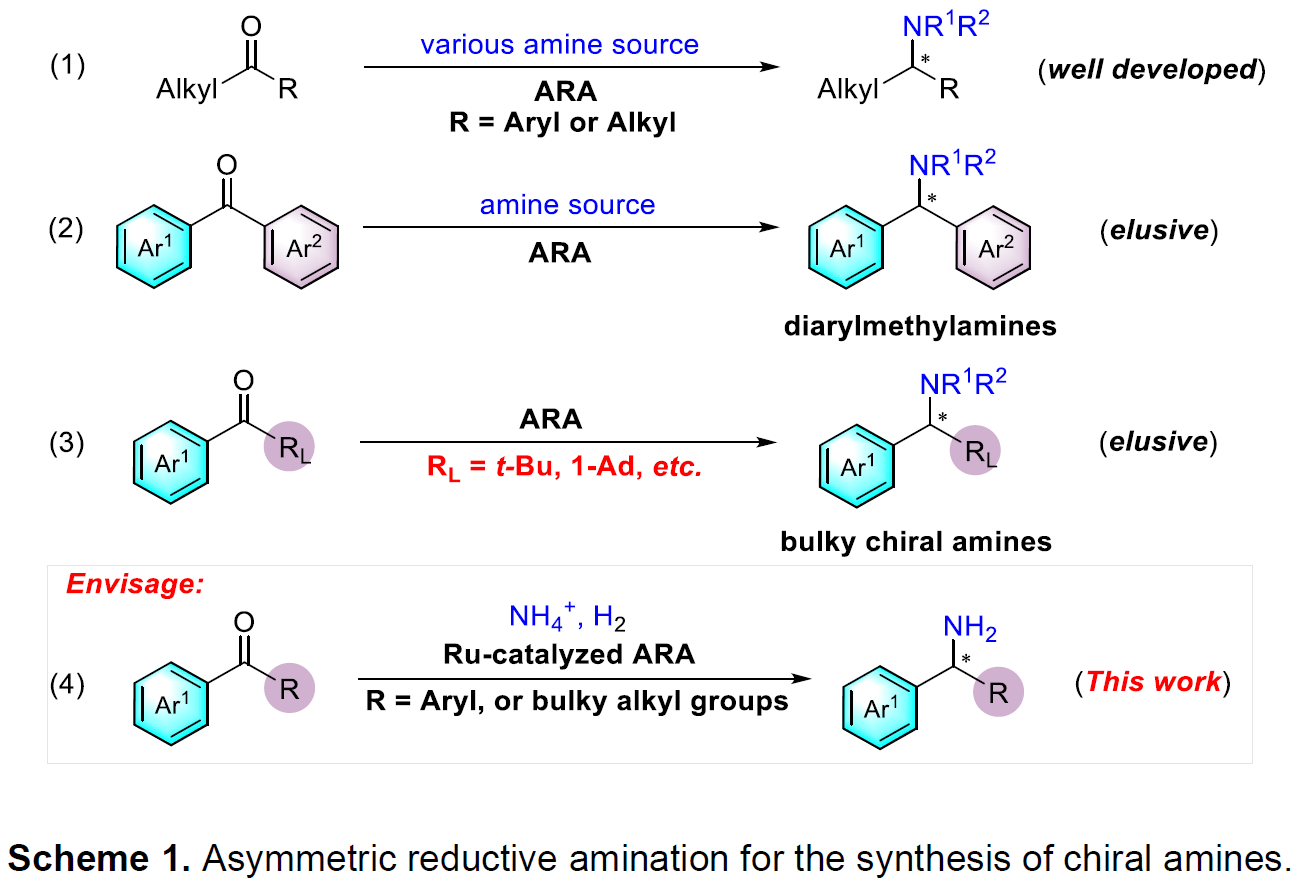
目前已报道的合成方法主要有外消旋体的拆分,芳基金属或芳基硼试剂对亚胺的不对称加成以及为数不多的几例亚胺的不对称还原。然而拆分往往效率低下,后两种方法一般需要预先制备不太稳定的亚胺中间体,原子及步骤经济性欠佳。相比之下,对广泛存在的酮进行不对称还原胺化(ARA)无疑是合成手性胺最直接、最高效的方法之一。虽然过渡金属催化酮(羰基上至少含有一个相对较小的烷基取代基)的ARA已被大量研究(Scheme 1,eq 1),二芳基酮或大位阻酮直接的ARA反应却没有报道(Scheme 1,eq 2-3)。其挑战主要在于:(1)由于空间位阻和亲电性的减弱导致亚胺中间体较难形成;(2)生成的亚胺中间体E/Z构型异构体的相互转化导致对映选择性难以调控;(3)在手性控制时区分两个空间相似的芳基或大位阻基团存在一定的挑战;(4)过渡金属氢物种与酮底物的不兼容以及胺化产物对金属催化剂毒化抑制作用。
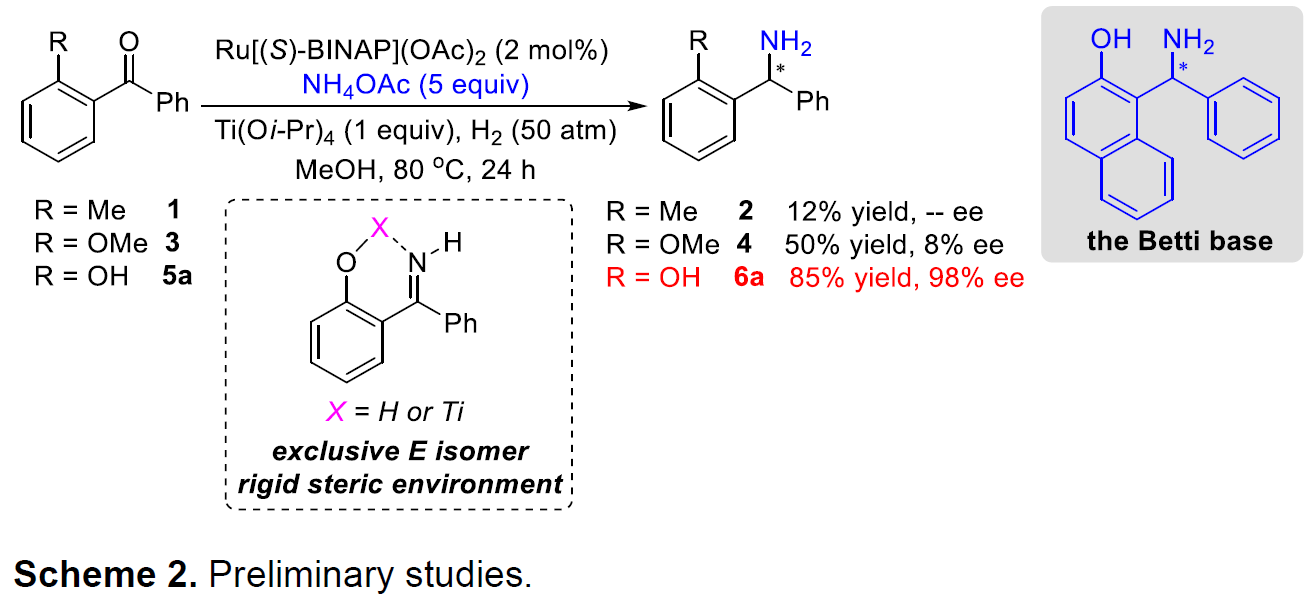
起初,作者使用邻甲基取代的二苯甲酮1作为底物,同时加入一当量的Ti(Oi-Pr)4,在先前的条件下反应,但反应缓慢,仅获得少量的所需产物2,同时大量底物未参与反应。而使用富电子的酮底物3时,尽管获得外消旋的产物4,但收率中等。作者设想,通过引入了邻羟基基团,不仅可以活化羰基来加速亚胺的形成,而且可以通过分子内的氢键来稳定亚胺中间体,同时,生成亚胺中间体将以分子内氢键或路易斯酸配位方式使亚胺以E异构体形式存在,从而有利于获得高对映体纯度的手性胺产品(Scheme 2)。令作者高兴的是,使用邻羟基取代的底物5a时,反应可以平稳进行,并以85%的收率和98%的ee获得手性伯胺产物6a。
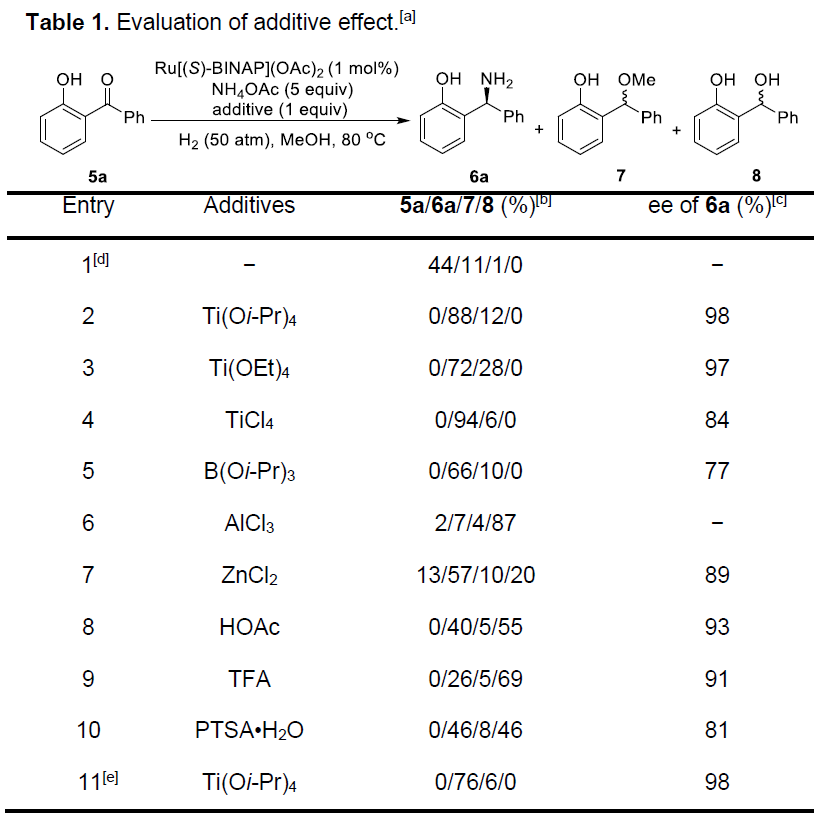
作者以5a作为模型底物,首先对酸添加剂进行了相关的筛选(Table 1)。当无Ti(Oi-Pr)4时,仅可获得少量的目标产物6a(约一半未转化的底物5a,微量醚化副产物7)(entry 1),从而说明Ti(Oi-Pr)4在该还原反应中起着重要作用。而对其它钛路易斯酸的筛选表明,Ti(Oi-Pr)4获得最好的结果(entries 2-4)。同时,作者还测试了一些路易斯酸或布朗特酸,但在大多数情况下,酮还原产物8作为主要产物(entries 5-10)。此外,将Ti(Oi-Pr)4的量降低时,产物6a的收率明显降低(entry 11)。
紧接着,作者对手性二膦配体也进行了相关的筛选(Table 2)。反映结果表明,所有测试的轴向手性配体(BINAP、SegPhos和BIPHEP),均获得较好的对映选择性以及收率(entries 1-5)。通过相关的比较后,作者最终选择SegPhos作为最佳配体。而对其它金属配体筛选中,均未获得目标产物(entries 6-8)。
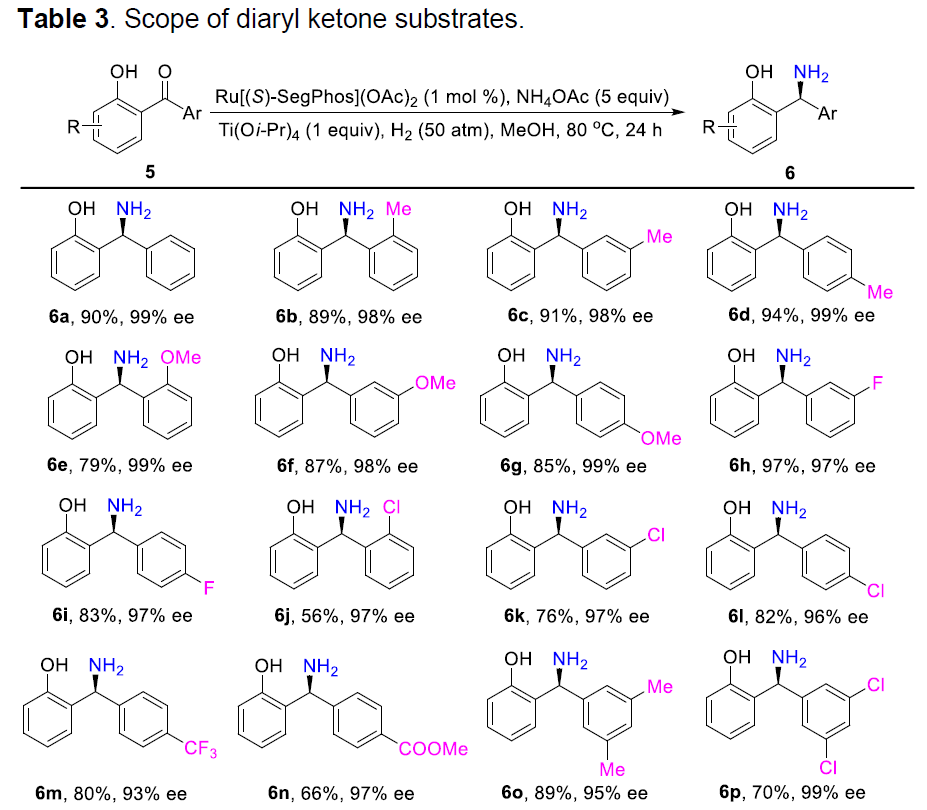
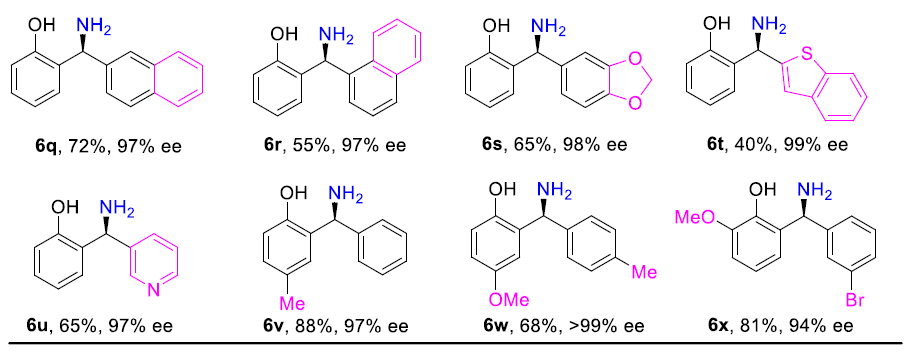
在获得上述最佳反应条件后,作者开始对二芳基酮底物5进行了扩展(Table 3)。反应结果表明,芳基取代不受供电子基团(Me、MeO等)和吸电子基团(F、Cl、Br、CF3等)的影响,均可获得较高的对映选择性(93-99%ee)以及收率(55-97%)的目标产物(6b–6s,6v–6x)。值得注意的是,该反应具有出色的不对称控制,可区分两个均含有邻位取代基的芳基,分别获得相应的产物(6b,6e,6j)。此外,杂芳基底物(5t–5u)也与体系兼容,分别获得产物6t(产率40%,99%ee)和6u(产率65%,97%ee)。
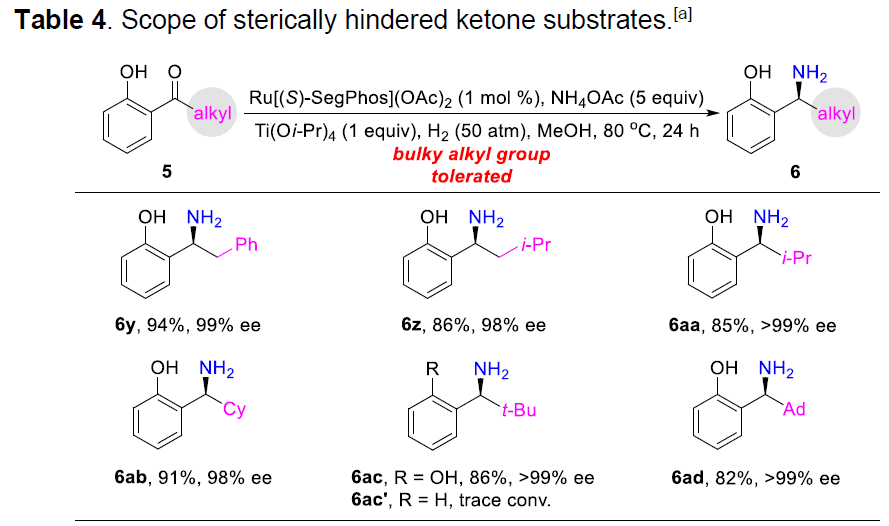
随后,作者进一步将底物扩展到具有大位阻的单芳基酮底物5(Table 4)。反应结果表明,含有苄基(5y)、2-异丁基(5z)、异丙基(5aa)、环己基(5ab)、叔丁基(5ac)甚至金刚烷基(5ad)的底物,均可获得相应的氨基苄基酚产物(收率82-94%,98-99%ee)。同时,作者发现,当使用缺少羟基的底物5ac’时,未发现产物的生成,进一步说明了邻羟基基团对于反应的重要性。
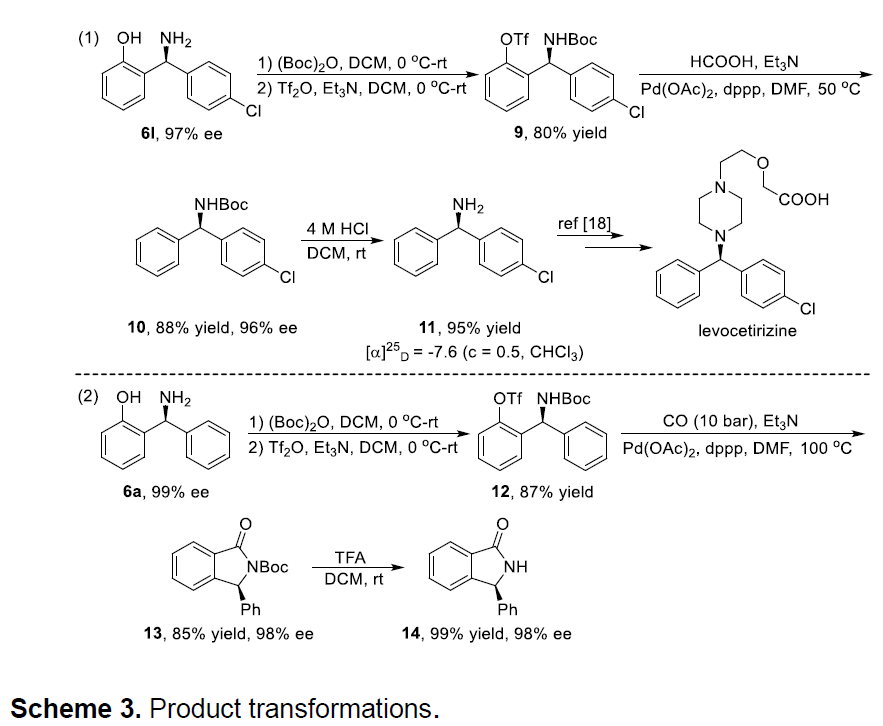
此外,作者也对产物进行了相关的修饰,从而进一步证明了该反应的实用性(Scheme 3)。如可以通过下述方法很容易将产物中的羟基去除,同时脱羟基的产物11作为合成左西替利嗪(抗过敏药)的关键手性中间体。此外,NH异吲哚啉酮14作为多种生物活性分子和天然生物碱中的结构单元,也可通过上述的合成的产物6a经羰基化、分子内酰胺化、N-Boc脱保护反应获得。
同时,作者也将获得的产物应用手性配体的合成(Scheme 4)。作者以5ac作为底物,进行了克级反应,以70%收率得到手性胺化合物6ac,其ee值大于99%。紧接着,6ac与丙二酰亚胺二乙酯二盐酸盐缩合后,以高对映选择性获得手性苯并二恶嗪产物15,作为一种新型配体骨架。
总结
南方科技大学张绪穆和殷勤教授团队首次报道了钌催化下,铵盐作为胺源,邻羟基取代的二芳基和大位阻酮的直接不对称胺化还原反应,高效高对映选择性地合成了多种具有价值的手性伯二芳基甲胺和大位阻的苄胺衍生物(产率高达97%,ee高达93-99%)。此外,克级实验、手性药物左西替利嗪中间体、异吲哚啉酮化合物以及新型苯并恶嗪配体的合成,进一步证明了该方法的实用性。
这一成果已于近期发表在Angew. Chem. Int. Ed. (DOI:10.1002/anie.201915459)。文章第一作者是南方科技大学和澳门大学联合培养博士研究生胡乐安,第一通讯单位为南方科技大学格拉布斯研究院和化学系,通讯作者为殷勤研究副教授。该工作得到了国家自然科学基金和深圳市科创委的资助。
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!



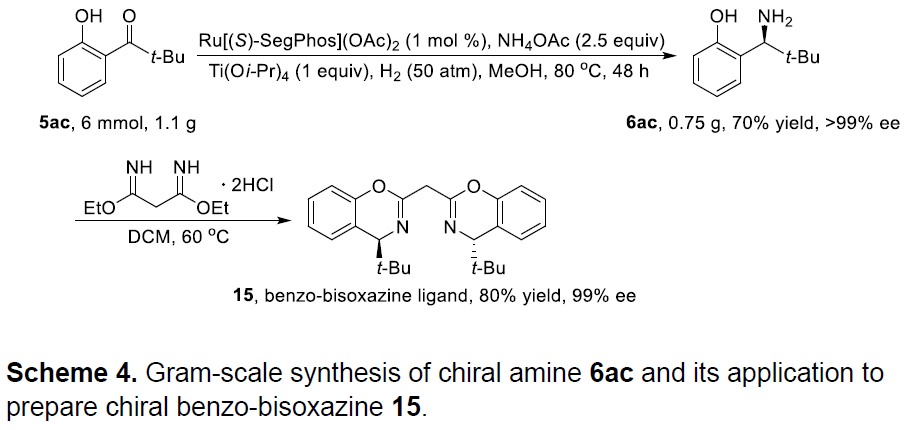



















No comments yet.