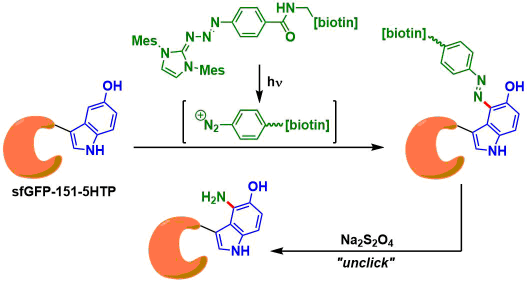
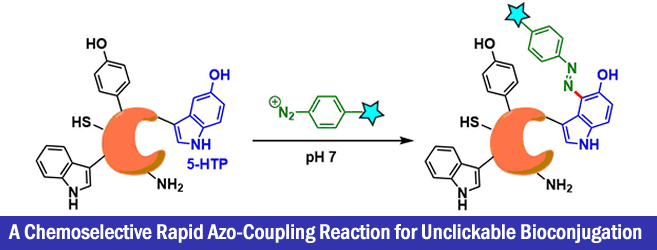
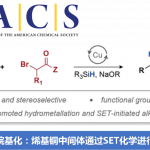
2017年、波士顿学院的Abhishek Chatterjee等人、利用5-羟色氨酸(5-HTP)和芳香族重氮化合物的高反应性与化学选择性,成功应用在蛋白质修饰上。由于形成的偶氮(N = N)键可以用连二亚硫酸钠裂解脱保护,所以也可以根据需要进行再修饰。
“A Chemoselective rapid Azo-Coupling Reaction (CARCR) for Unclickable Bioconjugation”
Addy, P. S.; Erickson, S. B.; Italia, J. S.; Chatterjee, A.* J. Am. Chem. Soc.2017, 139, 11670-11673. DOI: 10.1021/jacs.7b05125
课题设定
以络氨酸为靶标,用芳香族重氮离子修饰蛋白质的方法,其中一个代表实例由Francis等人报道[1]。但是络氨酸残基在蛋白质表面上露出的数量也有限,选择性的反应说实话比较困难。另外重氮试剂没有吸电子(硝基)的取代基的话,反应性很差,因此就反应试剂的限制来说也是一个问题。
技术手法的关键点
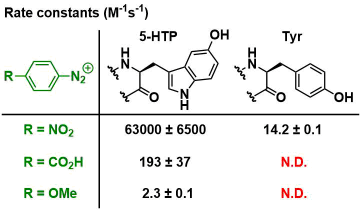
通过使具有更富电子侧链的5-羟基色氨酸(5-HTP)作为反应目标氨基酸、在更温和的条件下实现了蛋白质的修饰。5-HTP是作为5-羟色胺和褪黑素的原料的氨基酸,侧链比酪氨酸富含电子,与重氮化试剂的反应性也高。例如,与4-硝基苯重氮反应的反应速率是酪氨酸的4500倍。
而对络氨酸几乎无反应性的,更温和的试剂4-羧基苯基重氮盐和4-甲氧基苯基重氮盐来说,与5-HTP可以进行选择性的反应。
主张的有效性验证
①在生物条件下交叉反应性的检验
4-羧基苯基重氮化试剂完全不与酪氨酸和其他天然氨基酸残基如组氨酸,色氨酸,赖氨酸反应。
②对蛋白质的应用
作者最近、通过改变大肠杆菌的tryptophanyl-tRNA synthetase/tRNA对、成功建立了可以在真核细胞内高效引入5-HTP的体系[2]。通过使用该体系,合成了supefolder GFP的5-HTP导入体、继而尝试修饰反应发现,与5-HTP未导入的Native体比较的话、只有5-HTP导入体发生了反应,得到了修饰体。
③用荧光重氮化合物进行修饰
利用该反应,使用xia’tu含有荧光部分的重氮盐试剂作为反应试剂,对蛋白质进行修饰得到荧光标记的蛋白。
④抗体的修饰
对于抗赫赛汀抗体Fab断片中导入5-HTP的抗体片段,反应能很好的进行。通过LC-MS分析发现修饰后的分子量增加,另外通过SDS-PAGE验证了修饰后的蛋白质具有荧光性,并且通过抗原HER2过表达细胞作用,细胞仍然发光表明该修饰没有对抗体功能造成损伤。
⑤还原脱修饰
生成物中的偶氮结构可以被Na2S2O4还原、切断(unclick)后变成胺基。该断裂机理通过小分子模型的LC-MS解析、和使用光驱动生物素化试剂进行蛋白质修饰[3]→我们用蛋白质印迹法(streptavidin-HRP探针)跟踪和检查unclick的状态得到验证。然而,反应后的4-氨基-5-HTP抗氧化性弱,不能通过MS分析进行追踪。
需要注意的几点
- 反应非常快。对于4-硝基型试剂,反应在约1至2分钟内完成,对于4-羧基试剂在约20分钟内完成。
- 5-HTP是本身是存在于体内的氨基酸,具有稳定和便宜的优点。 而且,由于它与传统方法具有正交性,所以可以应用于多种类型的修饰。
接下来需要读的关联论文有?
- 本反应+click反应等为了引入多种类型的修饰,有必要瞄准另外的天然氨基酸残基或引入另一种非天然氨基酸。对于动物细胞上的应用有一定的技术壁垒,但是作者等人最近在这方面也得到了一定的进展[4]。
- 另外作者还撰写了关于在动物细胞中引入非天然氨基酸的综述[5]。像抗体那么大的分子通过大肠杆菌来合成非常困难,所以考虑应用于ADC等方面或许会是一个非常重要的技术。
参考文献
- Hooker, J. M.; Kovacs, E. W.; Francis, M. B. J. Am. Chem. Soc. 2004, 126, 3718. DOI: 10.1021/ja031790q
- Italia, J. S.; Addy, P. S.; Wrobel, C. J.; Crawford, L. A.; Lajoie, M. J.; Zheng, Y.; Chatterjee, A. Nat. Chem. Biol. 2017, 13, 446. doi:10.1038/nchembio.2312
- (a) He, J.; Kimani, F. W.; Jewett, J. C. J. Am. Chem. Soc. 2015, 137, 9764. DOI: 10.1021/jacs.5b04367 (b) Jensen, S. M.; Kimani, F. W.; Jewett, J. C. ChemBioChem2016, 17, 2216. DOI: 10.1002/cbic.201600508 (c) Kimani, F. W.; Jewett, J. C. Angew. Chem., Int. Ed. 2015, 54, 4051. DOI: 10.1002/anie.201411277
- Zheng, Y.; Addy, P. S.; Mukherjee, R.; Chatterjee, A. Chem. Sci. 2017, 8, 7211. DOI: 10.1039/C7SC02560B
- Italia, J. S.; Zheng, Y.; Kelemen, R. E.; Erickson, S. B.; Addy, P. S.; Chatterjee, A. Biochem. Soc. Trans. 2017, 45, 555. DOI: 10.1042/BST20160336
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!




















No comments yet.