作者:石油醚
本期热点研究,我们邀请到了本文第一作者来自马克思普朗克分子生理学研究所的博士研究生赵洲为我们分享。
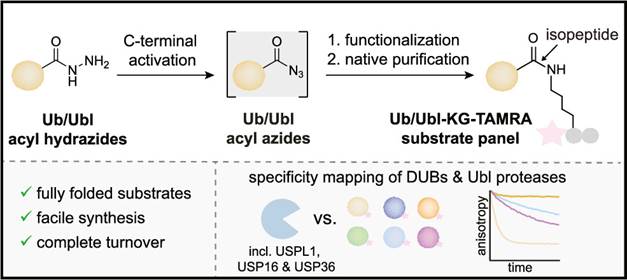
2023年9月15日,JACS在线发表了来自德国马克思普朗克分子生理学研究所Malte Gersch教授团队题为「Native Semisynthesis of Isopeptide-Linked Substrates for Specificity Analysis of Deubiquitinases and Ubl Proteases」的研究论文。在本工作中作者表达纯化出ubiquitin以及其他几种ubiquitin-like protein的C末端进行修饰,得到酰肼的中间体,这一中间体可以通过一步简单的反应制备由赖氨酸连接的荧光偏振底物。
“Native Semisynthesis of Isopeptide-Linked Substrates for Specificity Analysis of Deubiquitinases and Ubl Proteases.
Zhou Zhao, Rachel O’Dea, Kim Wendrich, Nafizul Kazi and Malte Gersch* J. Am. Chem. Soc., 2023, doi: 10.1021/jacs.3c04062”
Q1. 请对“Native Semisynthesis of Isopeptide-Linked Substrates for Specificity Analysis of Deubiquitinases and Ubl Proteases”作一个简单介绍。
在本工作中我们表达纯化出ubiquitin以及其他几种ubiquitin-like protein的C末端进行修饰,得到酰肼的中间体,这一中间体可以通过一步简单的反应制备由赖氨酸连接的荧光偏振底物。至此,我们获得了一系列由异肽键连接的荧光底物,这也是最为接近自然状态的底物。最为关键的是,我们在后续的纯化分离的过程中并不是采用HPLC,而是采用FPLC进行纯化。针对每一种蛋白,我们都优化了不同的纯化策略,使用不同的色谱柱,最终保证蛋白的结构是正确折叠的。圆二色谱的结果也证明我们的底物是具有正确构象的,荧光偏振测试也表明底物可以被相应的蛋白酶完全切割。我们随后对不同的去泛素化酶(DUB)和Ubiquitin-like蛋白酶(ULP)。其中最为值得注意的是USPL1,USP16和USP36。USPL1是一个去SUMO化酶,荧光偏振的实验证明其对SUMO2的选择性大大高于SUMO1。我们又利用结构生物学手段,测定了USPL1和SUMO2/3的晶体结构,进一步分析验证了其选择性的结构基础。而USP16和USP36是已经报道具有去泛素化和去Fubi化酶活,我们的荧光偏振测试表现这两个酶也具有去ISG15酶活,这也是目前报道的仅有的可以具有三重特异性的去泛素化酶。后续我们也会利用这类底物探索更多的酶特异性。
Q2. 有关本次研究的时候遇到过怎样的困难呢?又是怎样克服的呢
基于泛素和泛素样蛋白的探针和底物最大的痛点是蛋白是否可以正确折叠。以往制备这类底物需要使用有机溶剂进行纯化分离,冻干后溶解在DMSO中,最后再稀释到缓冲液中,而这一过程中很大一部分蛋白无法重新折叠,这意味着这部分蛋白无法被相应的蛋白酶识别,直接导致生物活性测试的结果无法定量研究。而我们经过大量尝试,综合利用尺寸排阻色谱,离子交换色谱以及疏水相互作用色谱等技术,获得了纯度高且质量优的荧光偏振底物。这种策略也可以进一步用于其他高质量底物和探针的开发工作中。
Q3. 本次研究主体,有没有什么让您感觉特别辛苦和烧脑呢?
蛋白纯化是最为痛苦的环节。因为蛋白接上了的TAMRA后,其性质变化很大,很容易在特定的pH析出。所以我们试了很多溶液和不同的色谱柱。目前我们仍在优化纯化的方法,期待可以得到更为通用的方法并且探索其他ubiquitin-like protein。
Q4. 将来想继续研究化学的哪个方向呢?
本人博士期间主要研究去泛素化酶,这类酶可能是很好的药物研发靶点,希望后续能开展一些药物筛选的工作,发现具有全新机制的调节剂作为化学探针或者药物研发的先到化合物。
Q5. 最后,有什么想对各位读者说的吗?
如果感兴趣我们的底物,可以联系我们。
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载.
















No comments yet.