什么是(鄰)碳硼烷
鄰-碳硼烷( o-carborane) 是一種碳硼烷家族中極端穩定且相對廉價的一種硼碳化合物,其分子式為C2B10H12。
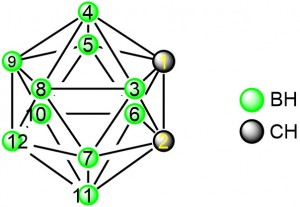
Fig.1 o-carborane numbering system
含鄰位碳硼烷籠的分子在硼中子捕獲療法(BNCT) [1]、藥物化學[2]、超分子組裝[3]以及發光分子[4]的研發中有著重要應用。因此,開發新的合成方法,在碳硼烷骨架的不同位點引入多種功能基團一直是硼化學領域的研究熱點。
C-取代的碳硼烷衍生物
鄰位碳硼烷獨特的籠狀三維結構以及其獨特的電子性質使得每一個籠結構上的氫原子都具有不同的性質。鄰位碳硼烷與碳相連的氫原子具有一定的酸性,與硼相連的氫原子具有一定的堿性(類似hydride)。所以鄰碳硼烷的C-H鍵可以被強堿活化形成碳負離子,再與親電試劑反應得到C-取代的鄰位碳硼烷衍生物。
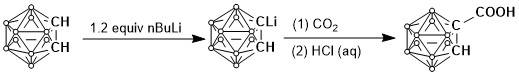
例如:碳硼烷單羧酸的合成
B-取代的碳硼烷衍生物
比起碳端修飾,碳硼烷硼端引入功能化基團是一個更具有挑戰性的難題,主要體現在兩個方面。由於硼的電負性較低,導致B-H鍵的極化程度遠比相對應的C-H鍵低得多,隨之受影響的就是對親核試劑的反應性更差。例如,碳硼烷B-H對有機鋰試劑或者格氏試劑是不起反應的。另一方面,碳硼烷十個硼頂點包含四種不同的電子環境經常帶來複雜的取代方式,以至於產生許多異構體。碳硼烷籠電子離域的特點使得其本身性質類似於芳香的碳氫化合物,可以與親電試劑反應。這也為各式各樣硼功能化化合物的合成提供了有效的途徑。
例如碳硼烷的B-H鍵可以與如路易斯酸等強親電試劑發生親電取代反應[5,6]。
除此以外,還可以使用巢式碳硼烷與硼鹵試劑反應合成B端取代的碳硼烷[7,8]。
目前合成碳硼烷衍生物的方法极其有限,并且现有的方法需要苛刻的反应条件、较长的反应时间、较差的官能团容忍性。而且鄰碳硼烷還有10個並不完全等價的B-H鍵,化學家們正在探索如何選擇性的活化/功能化B-H鍵。隨著有機化合物C-H鍵活化/功能化研究的進行,硼化學家借鑒了這一思路來合成更多的碳硼烷衍生物。
鄰碳硼烷B-H键选择性活化/功能化研究
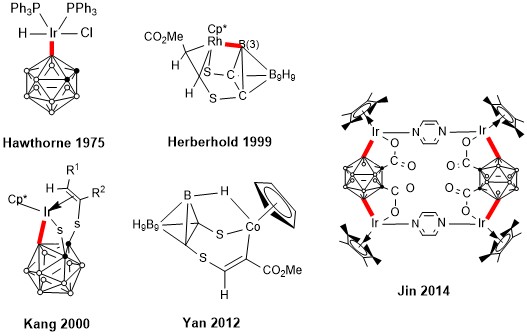
在過去的研究中,硼化學工作者業已發現選擇性的B-M鍵的形成。其中絕大多數,都是靠雜原子導向距離較近、電子匹配、位阻合適的B-H鍵[9-13]。
這些金屬有機化合物中都含有B-M鍵,有些需要碳硼烷籠上的雜原子導向活化鄰位B-H鍵,另一些是由金屬直接與某些位點的B-H鍵在非雜原子導向的情況下作用活化了B-H鍵。從這些化合物結構中傳遞出來的有利信息是:B-H鍵可被金屬選擇性的活化,這為發展碳硼烷選擇性B-H活化/功能化提供了理論基礎。然而美中不足之處是:由於所形成的B-M鍵過於穩定,從而使化合物只停留在B-M鍵形成的階段,碳硼烷底物只能與等當量的金屬化合物化合,而不能實現催化循環。
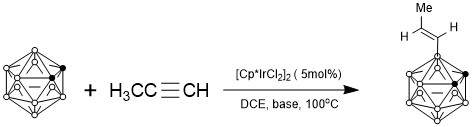
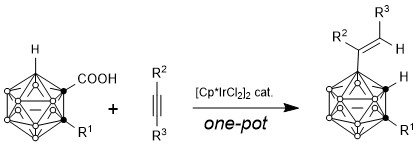
儘管碳硼烷B-H催化活化/功能化的實現有諸多困難,但在1988年Sneddon課題組報道了使用催化量的[Cp*IrCl2]2實現無導向基的碳硼烷與末端炔烴反應生成B(3)位被烯基取代的碳硼烷[13]。這也是唯一一例碳硼烷在金屬催化下與末端炔烴反應的報道。
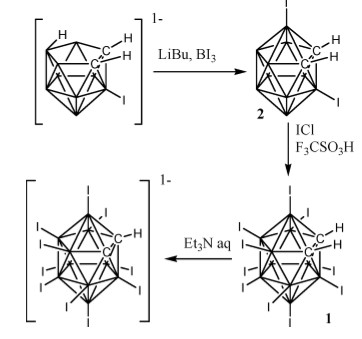
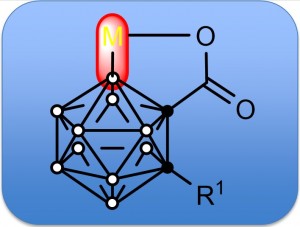
雖然鄰位碳硼烷有10個B-H鍵,但因原子鏈接關係不同從而有不同的性質。根據對碳硼烷籠的理論計算,電子云分佈密度如下:B (9, 12)> B (8, 10)> B( 4, 5, 7, 11)> B(3, 6) [14]。雖然如此,但碳硼烷上B原子電子云分佈相差較小,因此選擇性活化B-H鍵仍較困難。
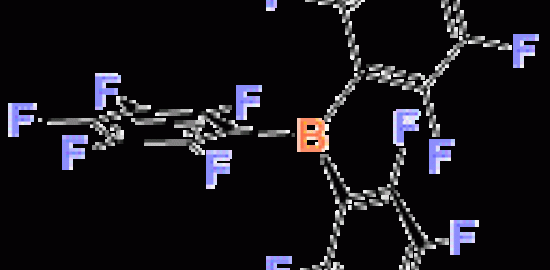
2013年謝作偉課題組報導了首例無導向基導向的Pd(II)催化B(8, 9, 10, 12)位四氟化反應[15]。反應可能是由電子相對豐富的B位點對於親電的醋酸鈀進行親電取代反應而引發的。由於B(8, 9, 10, 12)電性類似,因此只能得到四氟取代的化合物。
與此工作類似,2015年與2016年西南科技大學Cao Ke課題組發表了在無導向基作用下碳硼烷B(8)或B(9)位點單芳基化或烯基化反應[16, 17]。
其反應機理如圖所示
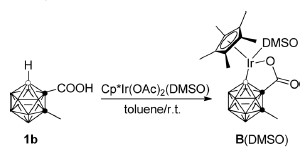
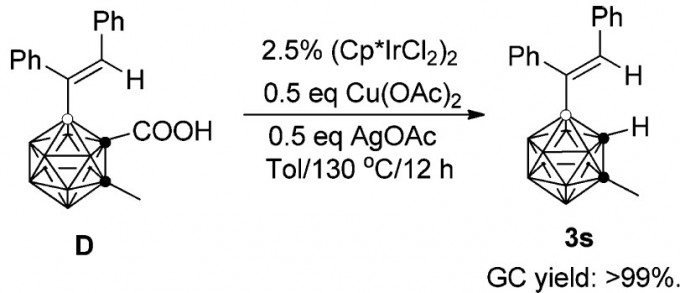
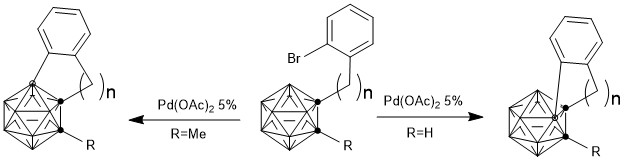
2014年,谢作伟课题组首次报道了以羧基作為導向基團實現的碳硼烷B(4)烯基化反應。[18]
在分離過程中,發現一種副產物的結構為:
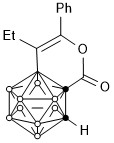
另外,等量的底物與等量的金屬催化劑B(4)活化的金屬配合物。
此外,該課題組還做了脫羧實驗:
該實驗可側面證明羧基作為導向基團,在導入烯基后即可在加熱過程中脫羧。
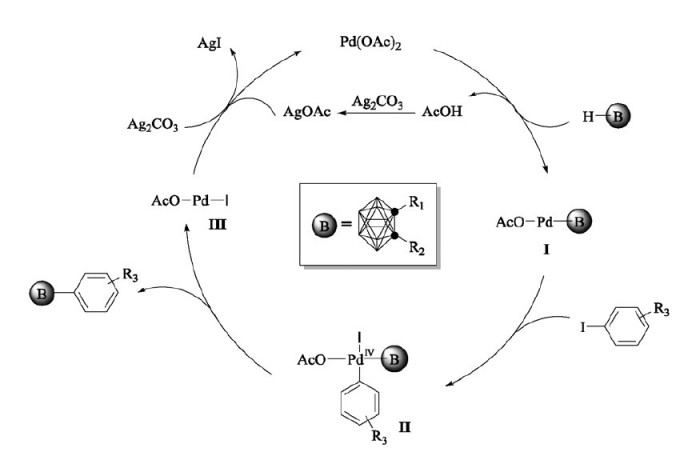
接下來,謝作偉課題組實現了以羧基為導向基,Pd(OAc)2為催化劑,實現的碳硼烷B(4,5)位活化雙芳基化反應。[19,20]
機理實驗證明,該反應先得到B(4)芳基化的中間體(因為B4位點更加富電子,Pd催化劑的親電進攻首先會進攻B4),再得到B(5)芳基化的最終產物。導向基團羧基在B(4,5)位雙官能團化之後分解脫羧。另外一個機理實驗證明該反應的過程為Pd(II)-Pd(IV)-Pd(II)過程,而非Pd(0)-Pd(II)-Pd(0)。
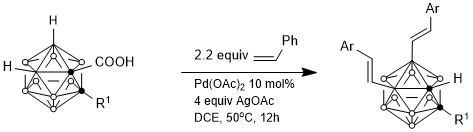
與芳基化類似,謝作偉課題組報道了碳硼烷B(4,5)位烯基化反應。此反應經過了Pd(II)-Pd(0)-Pd(II)的催化過程,烯烴插入B-Pd鍵,β-H與Pd(II)消除形成Pd-H配合物,AgOAc作為氧化劑使Pd(0)變成Pd(II),重新進入催化循環。
此外,在2015年謝作偉課題組報道了碳硼烷B(3)或B(4)區域選擇性活化/功能化的反應。[21]反應雖未有導向基團導向,但反應位點卻受苯環與碳硼烷鏈接位置的控制。此反應的區域選擇性由B的電子效應以及C端位阻共同調控。
参考文献
- Boron Science: New Technologies and Applications: Taylor & Francis/ CRC, Boca Raton, 2011;
- M. L. Beer, J. Lemon and J. F. Valliant; J. Med. Chem., 2010, 53, 8012; DOI: 10.1021/jm100758j
- F. Issa, M. Kassiou and L. M. Rendina*; Chem. Rev., 2011, 111, 5701; DOI: 10.1021/cr2000866
- C. Shi, H. Sun, X. Tang, W. Lv, H. Yan, Q. Zhao, J. Wang and W. Huang; Angew. Chem. Int. Ed., 2013, 52, 13434; DOI: 10.1002/anie.201307333
- F. Teixidor, G. Barbera, C. Vinas, R. Sillanpa1a1 and R. Kivekas, Inorg. Chem., 2006, 45, 3496; DOI: 10.1021/ic060124y
- B. P. Dash, R. Satapathy, J. A. Maguire and N. S. Hosmane, Org. Lett., 2008, 10, 2247; DOI: 10.1021/ol8005248
- M. F. Hawthorne and P. A. Wegner, J. Am. Chem. Soc., 1968, 90, 896; DOI: 10.1021/ja01006a009
- K. Aizawa, K. Ohta and Y. Endo, Heterocycles, 2010, 80, 369; DOI: 10.3987/COM-09-S(S)32
- E. L. Hoel, M. F. Hawthorne, J. Am. Chem. Soc., 1975, 97, 6388; DOI: 10.1021/ja00855a017
- M. Herberhold, H. Yan, W. Milius and B. Wrackmeyer, Angew. Chem. Int. Ed., 1999, 38, 3689; DOI: 10.1002/(SICI)1521-3773(19991216)38:24<3689::AID-ANIE3689>3.0.CO;2-T
- J.-Y. Bae, Y.-J. Lee, S.-J. Kim, J. Ko, S. Cho and S. O. Kang, Organometallics, 2000, 19, 1514; DOI: 10.1021/om990900s
- R. Zhang, L. Zhu, G. Liu, H. Dai, Z. Lu, J. Zhao, H. Yan J. Am. Chem. Soc., 2012, 134, 10341; DOI: 10.1021/ja303334t
- M. G. L. Mirabelli and L. G. Sneddon, J. Am. Chem. Soc., 1988, 110, 449; DOI: 10.1021/ja00210a023
- R.Zhang, L. Zhu, G. Liu, H. Dai, Z. Lu, J. Zhao and H. Yan, J. Am. Chem. Soc., 2005, 127, 10158; DOI: 10.1021/ja052981r
- Z. Qiu, Y. Quan and Z. Xie, J. Am. Chem. Soc., 2013, 135, 12192; DOI: 10.1021/ja405808t
- K. Cao, Y. Huang, J. Yang and Ji Wu, Chem. Commun., 2015, 51, 7257; DOI: 10.1039/C5CC01331C
- J. Wu, K. Cao, T.-T. Xu, X.-J. Zhang, L. Jiang, J. Yang and Y. Huang , RSC Adv., 2015, 5, 91683; DOI: 10.1039/C5RA18555F
- Y. Quan and Z. Xie, J. Am. Chem. Soc., 2014, 136, 15513; DOI: 10.1021/ja509557j
- Y. Quan and Z. Xie, Angew. Chem. Int. Ed., 2016, 55, 1295; DOI: 10.1002/anie.201507697
- H. Lyu, Y. Quan and Z. Xie, Angew. Chem. Int. Ed., 2015, 54, 10623; DOI: 10.1002/anie.201504481
- Y. Quan and Z. Xie, J. Am. Chem. Soc., 2015, 137, 3502; DOI: 10.1021/jacs.5b01169
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载


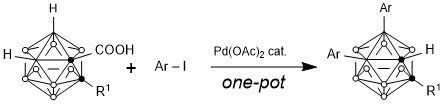





















No comments yet.