本文作者:石油醚
概要
Richard P. Hsung:威斯康星大学麦迪逊分校教授,有机化学家,
课题组主页: https://pharmacy.wisc.edu/hsung-group/
经历
1990年 凯尔文学院化学与数学系,学士
1992年 芝加哥大学有机化学,硕士(Professor Jeffrey D. Winkler)
1995年 芝加哥大学有机化学,博士(Professor William D. Wulff)
1996年 芝加哥大学,博士后(Professor Lawrence R. Sita)
1997年 哥伦比亚大学,博士后(Professor Gilbert Stork)
1997-2006年 明尼苏达大学,助理教授,副教授
2006- 威斯康星大学麦迪逊分校教授
获奖与荣誉
The University of Wisconsin Vilas Distinguished Achievement Professor: 2017
Distinguished Visiting Professor at University of Hong Kong: 2016
Eli Lilly Open Innovation Drug Discovery Award: 2016
Laura and Edward Kremers Endowed Chair in Natural Products Chemistry: 2016 – 2021
Distinguished Visiting Professor at RIKEN: 2015
The City of Tianjin Ocean-River Friendship Medal of Honor: 2013
The 15 Most Prolific Authors for American Chemical Society Journal Organic Letters: 2013
The University of Wisconsin William F. Vilas Associate Award: 2010 – 2012
National Thousand Talent Distinguished Visiting Professor at Tianjin University: 2010 – 2013
Chair of The 57th Gordon Research Conference on Organic Reactions and Processes: 2010
Distinguished Visiting Professor at University of Hong Kong: 2010
Raymond A. and Dorothy A. Wilson Visiting Professor at UCLA: 2008
American Cancer Society Peer Review Committee on Cancer Drug Development: 2007 – 2011
The National Science Foundation Career Development Award: 2001 – 2006
The Camille Dreyfus Teacher and Scholar Award: 2001 – 2003
The University of Minnesota McKnight Professor of Chemistry: 2001 – 2003
- W. Johnson Pharmaceutical Research Institute Faculty Award: 1998 – 2000
研究方向
1.[3+3]杂环-加成1-8
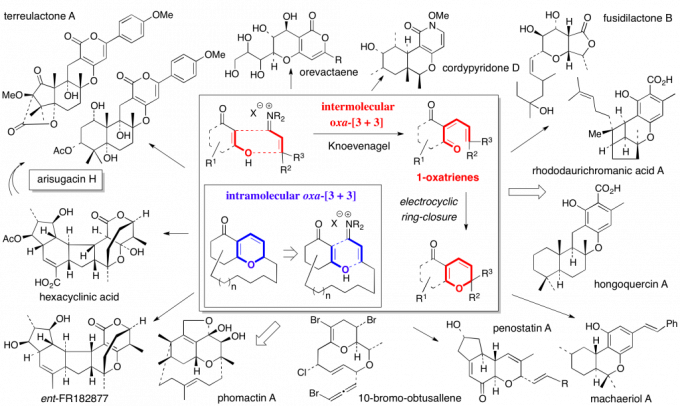
Hsung教授小组已经开发出一种形式化的[3 + 3]环加成反应,即从简单的α,β-不饱和亚胺和1,3-二羰基等价物(如乙烯基酰胺)或其他化合物构建复杂的二氢吡喃类和二氢吡啶类杂环。该反应通过一个串联过程进行,包括Knoevenagel缩合,然后是1-氧杂或1-氮杂三烯中间体的6-π电子关环。这种串联过程的环加成反应的最终结果是两个σ键的形成以及与杂原子相邻的一个新立体中心的构建。立体中心手性的起源则是由手性乙烯基酰胺控制,而且这种反应的一种分子内变体最近也被开发出来。此过程使Hsung教授小组能够完成多种复杂的天然产物的全合成,例如:arisugacin A, simulenoline, huajiaosimuline, tangutorine, hongoquercin A, perhydrohistrionicotoxin, cylindricines, lepadiformine, the entire lepadin family, the aza-phenylene family, rhododaurichromanic acids, and most recently, phomactin A(图 1和图 2)。
图 1 氧杂[3+3]环加成用于天然产物全合成
图 2 氮杂[3+3]环加成用于天然产物全合成
2.手性联烯酰胺与炔酰胺的合成方法
Hsung小组开发了两类结构的有机结构单元或有机合成子:手性联烯和炔酰胺。这些缺乏电子的联烯酰胺与炔胺的手性变体比传统的联烯酰胺与炔酰胺在热稳定性好和实验上更容易处理,从而使它们在合成上更有用,并适用于传统的联烯酰胺与酰胺的不可能的反应上,如分子内歧化和过渡金属催化等反应。
A.联烯酰胺的化学9-16
Hsung教授小组率先使用手性联烯酰胺进行串联环氧化和羟烯丙基阳离子[4 + 3]环加成反应的方法。联烯酰胺的环氧化被证明其是手性氮稳定的烯丙基阳离子的极好来源。Hsung教授小组开发了高度区域与立体选择性的分子间和分子内羟基烯丙基阳离子[4 + 3]环加成反应。最近, Hsung教授小组使用铜-双噁唑啉系统实现第一个不对称[4 + 3]环加成反应,而且更重要的是, Hsung教授小组与UCLA的Ken Houk教授和墨尔本大学的Elizabeth Krenske博士合作,开始建立一个用于理解和预测[4 + 3]环加成反应的区域选择性的理论模型(目前尚未探索)(图 3)。
图 3 联烯酰胺化学
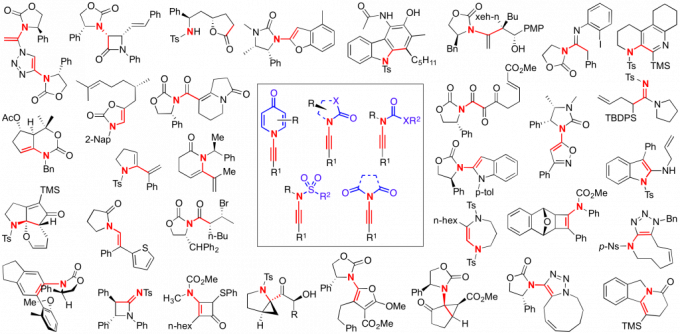
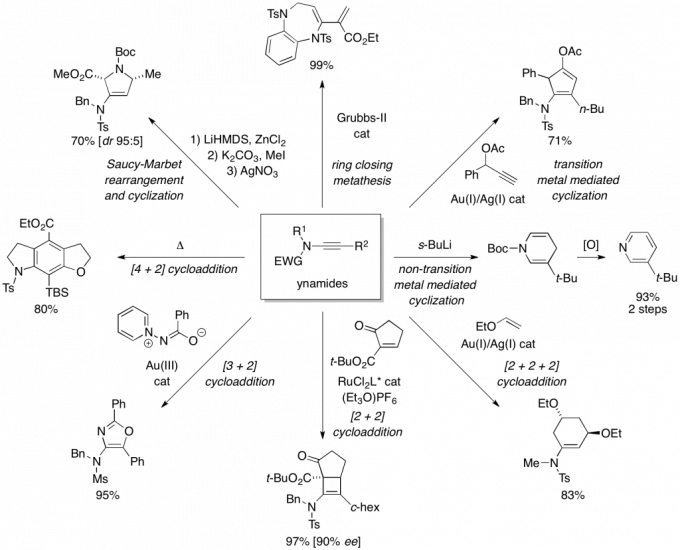
B 炔酰胺的化学17-20
随着世界各地众多研究小组的追加入,Hsung教授小组已将炔酰胺的化学发展成为了一个新兴的领域。Hsung-Lab的工作重新激发了化学家对这一非常有趣的炔酰胺类的兴趣。 16 年前,Hsung教授特别重视开发酰胺的高效合成方法,使得炔酰胺可以成为有机合成中的一类普遍适用的化合物。为了实现这一目标,Hsung-Lab开发了Cu(II)催化酰胺的N-炔基化直接合成手性炔酰胺的方法。课题组的工作及随后的工作,包括我的同事Shannon Stahl的出色工作,都对该领域产生了巨大的影响,使许多研究小组可以使用炔胺作为有机官能团自由地开发自己感兴趣的方法。最近,终于成功地开发出了一种具有α,β-不饱和羰基体系的[2+2]环加成反反应合成炔酰胺(图 4和图 5)。
图 4 炔酰胺化学
图 5 炔酰胺的应用
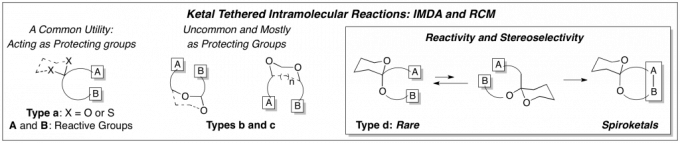
3.环缩醛活化21
分子内反应是有机合成化学的一个重要研究领域,因为分子内反应可以迅速为高度区域选择性和立体选择性反应中产生各种结构复杂的化合物。虽然在一个给定的分子内反应中有许多将反应性束缚在一起的方式,但是缩醛并没有被广泛用作暂时或永久的束缚物,其在有机合成中的作为活化基团一直被低估。基于此,Hsung-Lab开发了于构建天然产物的环缩醛化学
A.缩醛循环策略22
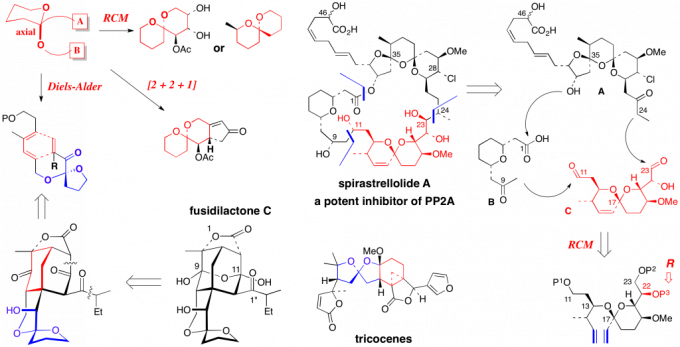
本文讨论了尚未被广泛研究环缩醛束缚的分子内反应,特别是分子内Diels-Alder [IMDA]和RCM反应,也同时讨论了一种合成Fsidilactone C的方法。Fsidilactone C是一种含有螺环酮的天然产物,它首先引起了Hsung-Lab对环缩醛策略的兴趣。这些研究之所以具有重要意义,是因为它们可以导致在概念上和本质上与螺环酮相关的复杂天然产物的构建方法不同。例如最近利用环缩醛化学合成了Agialospirol(图 6,7)。
图 6 缩醛活化
图 7 缩醛活化
B.乙烯基缩醛的阳离子[2 + 2]环加成
H-Lab一直在开发热驱动构建环丁烷的 [2 + 2]环加成反应23,这项工作将极大地促进尚未开发的环加成化学领域。一个成功的阳离子形式的[2 + 2]环加成反应还将代表一种模拟环丁烷的过程。 具体来说,课题组成功完成了分子内Gassman类阳离子[2 + 2]环加成反应,目前正在探索其在天然产物合成中的应用(图 8)。
图 8 缩醛活化
其他
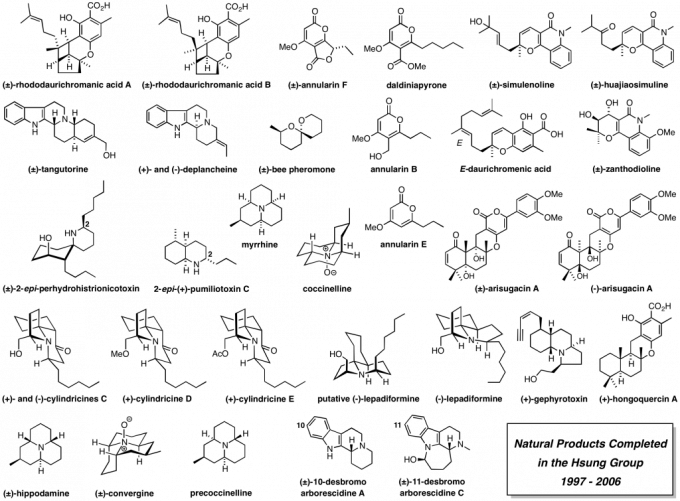
明尼苏达大学完成的全合成
图 9 全合成
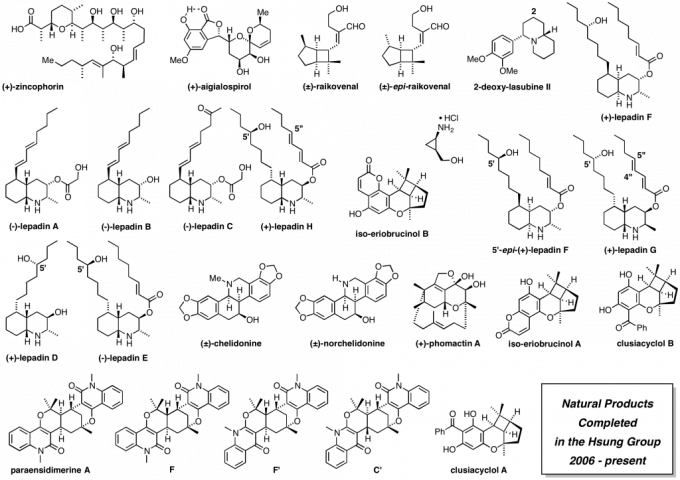
威斯康星大学麦迪逊分校完成的全合成
图 10 全合成
图 11 全合成
参考文献
- Antoline, J. E.; Krenske, E. H.; Lohse, A. G.; Houk, K. N.; Hsung, R. P., J. Am. Chem. Soc. 2011,133(36), 14443-14451, doi:10.1021/ja205700p.
- Krenske, E. H.; He, S.; Huang, J.; Du, Y.; Houk, K. N.; Hsung, R. P., J. Am. Chem. Soc. 2013,135(14), 5242-5245, doi:10.1021/ja312459b.
- Sklenicka, H. M.; Hsung, R. P.; McLaughlin, M. J.; Wei, L.-l.; Gerasyuto, A. I.; Brennessel, W. B., J. Am. Chem. Soc. 2002,124(35), 10435-10442, doi:10.1021/ja020698b.
- Hsung, R. P.; Wei, L.-L.; Sklenicka, H. M.; Douglas, C. J.; McLaughlin, M. J.; Mulder, J. A.; Yao, L. J., Org. Lett. 1999,1(3), 509-512, doi:10.1021/ol990107v.
- Fang, L.-C.; Hsung, R. P., Org. Lett. 2014,16(6), 1826-1829, doi:10.1021/ol500390a.
- Cole, K. P.; Hsung, R. P., Org. Lett. 2003,5(25), 4843-4846, doi:10.1021/ol030115i.
- Shen, H. C.; Wang, J.; Cole, K. P.; McLaughlin, M. J.; Morgan, C. D.; Douglas, C. J.; Hsung, R. P.; Coverdale, H. A.; Gerasyuto, A. I.; Hahn, J. M.; Liu, J.; Sklenicka, H. M.; Wei, L.-L.; Zehnder, L. R.; Zificsak, C. A., J. Org. Chem. 2003,68(5), 1729-1735, doi:10.1021/jo020688t.
- Grant, S. B.; John, B. F.; Richard, P. H., Current Organic Synthesis 2010,7(4), 363-401, doi:10.2174/157017910791414490.
- Huang, J.; Hsung, R. P., J. Am. Chem. Soc. 2005,127(1), 50-51, doi:10.1021/ja044760b.
- Xiong, H.; Hsung, R. P.; Berry, C. R.; Rameshkumar, C., J. Am. Chem. Soc. 2001,123(29), 7174-7175, doi:10.1021/ja0108638.
- Xiong, H.; Huang, J.; Ghosh, S. K.; Hsung, R. P., J. Am. Chem. Soc. 2003,125(42), 12694-12695, doi:10.1021/ja030416n.
- Frederick, M. O.; Mulder, J. A.; Tracey, M. R.; Hsung, R. P.; Huang, J.; Kurtz, K. C. M.; Shen, L.; Douglas, C. J., J. Am. Chem. Soc. 2003,125(9), 2368-2369, doi:10.1021/ja021304j.
- Hsung, R. P.; Zificsak, C. A.; Wei, L.-L.; Douglas, C. J.; Xiong, H.; Mulder, J. A., Org. Lett. 1999,1(8), 1237-1240, doi:10.1021/ol990211c.
- Song, Z.; Hsung, R. P., Org. Lett. 2007,9(11), 2199-2202, doi:10.1021/ol070791a.
- Lu, T.; Lu, Z.; Ma, Z.-X.; Zhang, Y.; Hsung, R. P., Chem. Rev. 2013,113(7), 4862-4904, doi:10.1021/cr400015d.
- Wei, L.-l.; Xiong, H.; Hsung, R. P., Acc. Chem. Res. 2003,36(10), 773-782, doi:10.1021/ar030029i.
- Li, H.; Hsung, R. P., Org. Lett. 2009,11(19), 4462-4465, doi:10.1021/ol901860b.
- DeKorver, K. A.; Li, H.; Lohse, A. G.; Hayashi, R.; Lu, Z.; Zhang, Y.; Hsung, R. P., Chem. Rev. 2010,110(9), 5064-5106, doi:10.1021/cr100003s.
- Wang, X.-N.; Yeom, H.-S.; Fang, L.-C.; He, S.; Ma, Z.-X.; Kedrowski, B. L.; Hsung, R. P., Acc. Chem. Res. 2014,47(2), 560-578, doi:10.1021/ar400193g.
- Hsung, R. P., Tetrahedron 2006,62(16), 3781-3782, doi:10.1016/j.tet.2006.01.076.
- Song, Z.; Lohse, A. G.; Hsung, R. P., Nat. Prod. Rep. 2009,26(4), 560-571, doi:10.1039/B821450F.
- Liu, J.; Hsung, R. P., Org. Lett. 2005,7(11), 2273-2276, doi:10.1021/ol050653q.
- Kurdyumov, A. V.; Hsung, R. P., J. Am. Chem. Soc. 2006,128(19), 6272-6273, doi:10.1021/ja054872i.



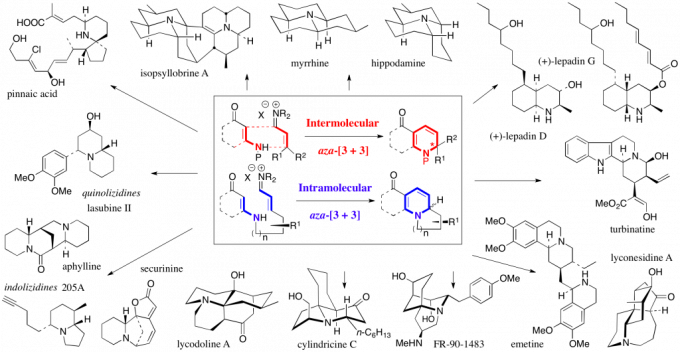
























No comments yet.