投稿作者 齐藩
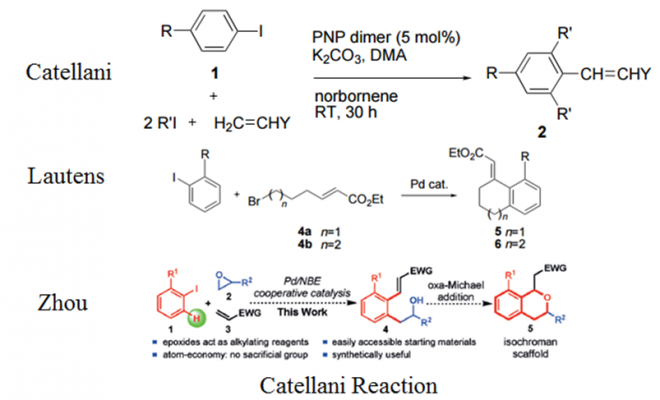
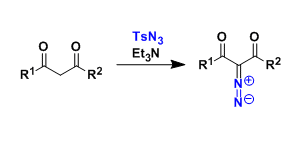
1997年意大利化学家Catellani首次报道了此反应,并详细研究了反应机理,因此也由其名字命名。该反应利用钯催化剂,利用反应性较高的降冰片烯通过migratory insertion作用将钯催化剂定位到苯环邻位,从而实现钯催化的三组分的有序偶联反应。现在从事该反应研究主要有Mark Lautens,然后余金权、Tobias Ritter等也做过这一反应的相关研究。今天主要介绍Mark Lautens和近期Zhou等人对这一反应的拓展。
Catellani教授的工作
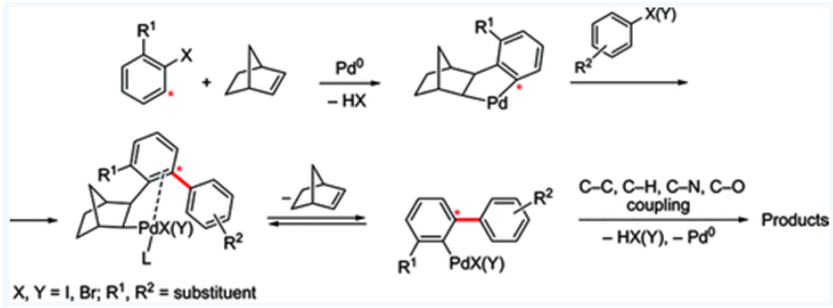
Catellani教授主要的兴趣在于发展钯催化的三组分有序偶联反应,反应利用使用钯催化剂、降冰片烯相当于有机催化剂,实现了两种芳基卤代烃偶联得到联苯类钯物种,该中间体再与烯烃、炔烃、芳基硼酸发生偶联反应1。
图1. Catellani有序反应策略
Lautens的环化策略
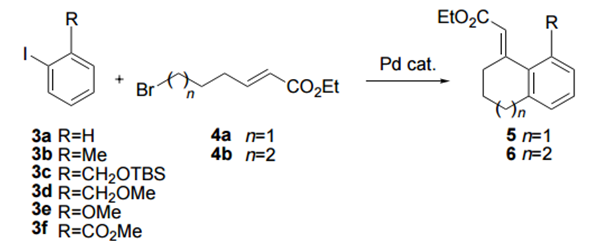
2000年,Mark Lautens等在Catellani等人的工作基础上通过卤代烃端基的烯基修饰,然后通过分子内的Heck反应构建了碳环和杂环等环状化合物2。此后该小组基于Catellani反应开发了一系列钯催化的多米诺反应,利用降冰片烯介导的邻位官能化,通过底物末端的修饰可以合成多样的碳环、杂环、稠环及多环化合物等。
图2. 分子内Heck反应成环
图3. Lautens在成环反应中的策略
Zhou的拓展
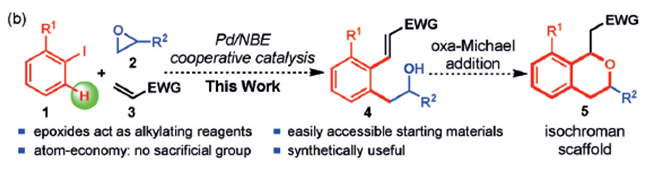
最近Zhou等3报道了一种协同催化体系,利用二价钯催化剂、Xphos,5-降冰片烯-2-甲酸钾为催化体系能够利用环氧乙烷为烷基化试剂,烯烃作为亲核试剂发生Catellani反应。该反应所得产物可通过氧Michael加成反应合成异色满衍生物,该结构常出现在一些复杂天然产物中。
图4. 反应设想
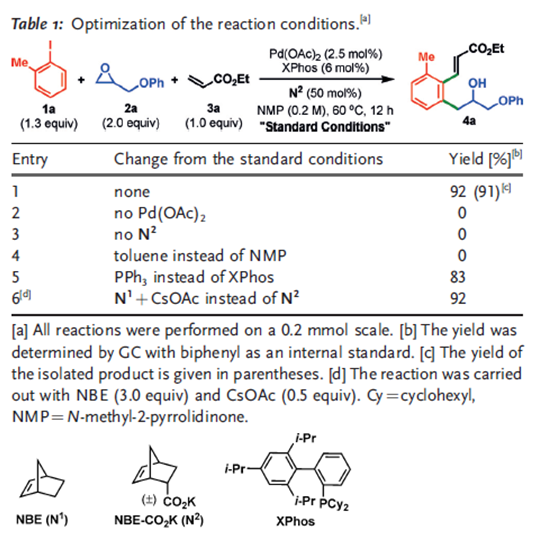
作者选用邻甲基碘苯、2-苯氧甲基环氧乙烷和苯烯酸酯为反应底物,对反应条件进行了探索,筛得反应条件为Pd(OAc)2/XPhos为催化剂,N2为有机催化剂,NMP溶剂中60 ˚C条件下反应12 h。改变反应条件发现,没有钯催化剂和N2都不能实现这一转化。溶剂替换成非极性溶剂甲苯反应无法实现。用小位阻配体三苯基膦代替XPhos产率有所下降,利用N1和CsOAc组合替换N2能够得到同等产率的产物,这表明N2在这一转化中既充当了有机催化剂介导了邻位的烷基化,又担当了碱的角色。
图5. 条件筛选
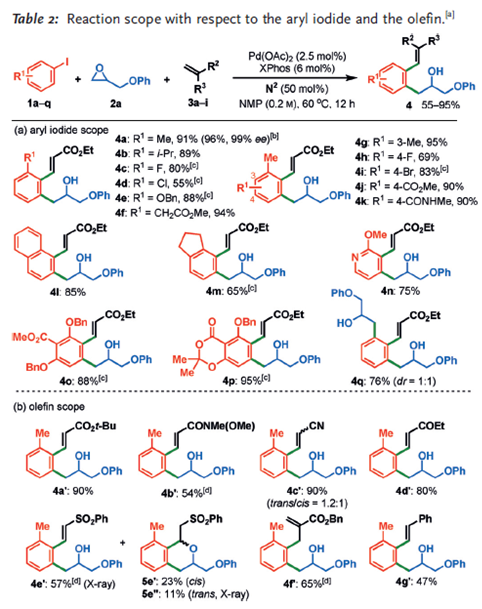
反应的底物适用范围研究表明,带有给电子取代基和吸电子取代基的芳基卤代烃都能适用,邻位取代基中,除氯取代产率较低外,其他如甲基、异丙基、氟、苄氧基等都能取得不错的收率,当邻位定位甲基,苯环3,4取代基取代的卤代烃反应都能取代中等到良好的产率,给电子和供电子取代基都能兼容。双环芳基卤代烃、吡啶卤代烃及多取代的芳基碘代烃都能很好地完成这一转化。烯烃的底物研究表明,带有吸电子取代基的烯烃反应效果较好,当苯砜基连在烯烃末端时,可以直接诱导得到少量Michael加成的成环产物。
图6. 卤代烃与烯烃的拓展
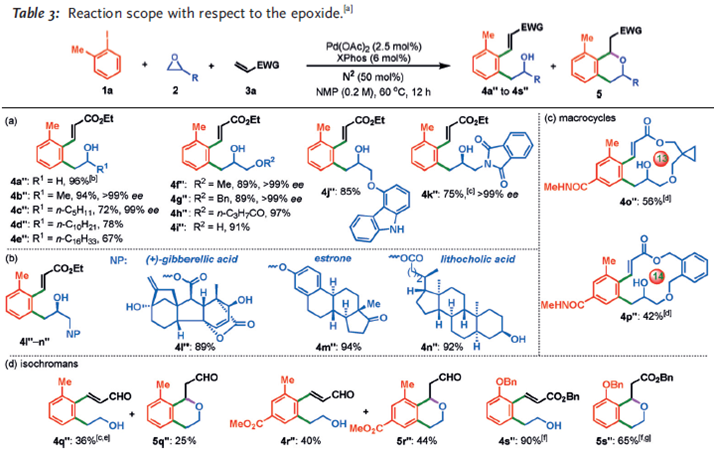
环氧化物的底物适用性研究表明,环氧乙烷烷基取代的底物都能取代不错的收率,其中对映纯的环氧乙烷衍生物能取得较高的ee值,3-烷氧基取代的环氧乙烷底物都能较好地兼容,即便是3-羟基取代的底物也能以高产率得到相应的产物。β保护的氨基环氧乙烷也能兼容,天然产物衍生的底物也能取得不错的收率。与Lautens策略类似,作者也以中等产率通过分子内的Heck偶联反应构建了13元-14元的大环内酯化合物。当环氧乙烷为底物时,甲酰基乙烯为Michael接受体时,反应会得到部分成环产物。丙烯酸苄酯为底物时,则不会得到成环产物,但是在Cs2CO3的作用下容易转化得到成环产物。
图7. 环氧乙烷的拓展
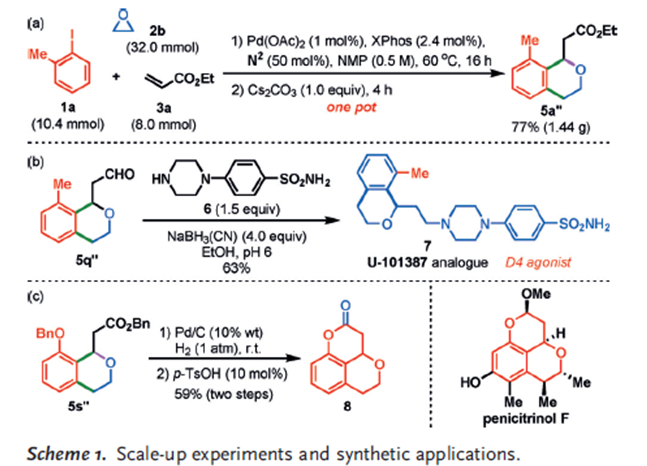
因此作者将在第一步Catellani反应后,加入Cs2CO3将该方法发展成为一锅法,可直接用于异色满类化合物的合成。并且反应可以放大到克级。该方法也可用于激动剂U-101387类似物的合成,还可用于天然产物penicitrinol F核心骨架的构建。
图8. 放大试验与合成应用
总结
Catellani反应由Catellani最初发现用于钯催化的三组分有序偶联反应一步同时构建三个碳碳键,Mark Lautens等在Catellani等人的工作基础上通过卤代烃端基的修饰,将该方法用于多样的碳环、杂环、稠环及多环化合物的合成,Lautens等的工作极大地该方法在碳环、杂环等化合物合成中的应用。Zhou等用环氧乙烷化合物替代卤代烃,所得到的化合物通过Michael加成可用于异色满类化合物的合成,其他研究者与Zhou发展其他活性化合物作为烷基化试剂,也丰富了Catellani反应在合成上的可能性。Catellani反应在发展与丰富过程中还有很多精彩的工作,本篇只重点介绍了几个例子,期待该反应有更精彩的合成设计与应用。
文献
- Catellani, M.; Motti, E.; Della Ca’, N., Catalytic Sequential Reactions Involving Palladacycle-Directed Aryl Coupling Steps. Accounts of chemical research 2008,41 (11), 1512-1522.DOI:10.1021/ar800040u.
- Lautens, M.; Piguel, S., A New Route to Fused Aromatic Compounds by Using a Palladium‐Catalyzed Alkylation – Alkenylation Sequence. Angewandte Chemie International Edition 2000,39 (6), 1045-1046.doi:10.1002/(SICI)1521-3773(20000317)39:6<1045::AID-ANIE1045>3.0.CO;2-Q
- Cheng, H. G.; Wu, C.; Chen, H.; Chen, R.; Qian, G.; Geng, Z.; Wei, Q.; Xia, Y.; Zhang, J.; Zhang, Y.; Zhou, Q., Cover Picture: Epoxides as Alkylating Reagents for the Catellani Reaction (Angew. Chem. Int. Ed. 13/2018). Angewandte Chemie International Edition 2018,57 (13), 3265-3265.doi.org/10.1002/anie.201801898.
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!


















No comments yet.