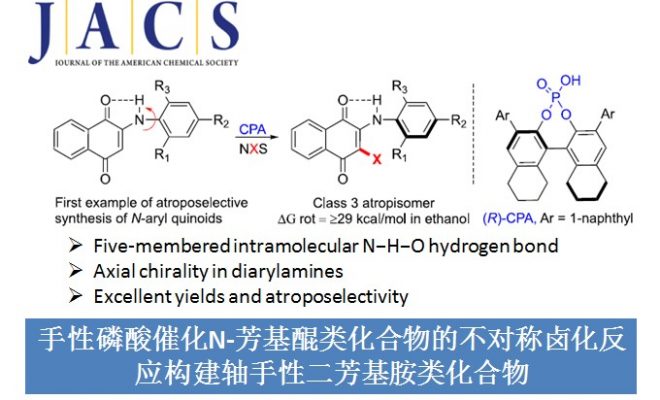
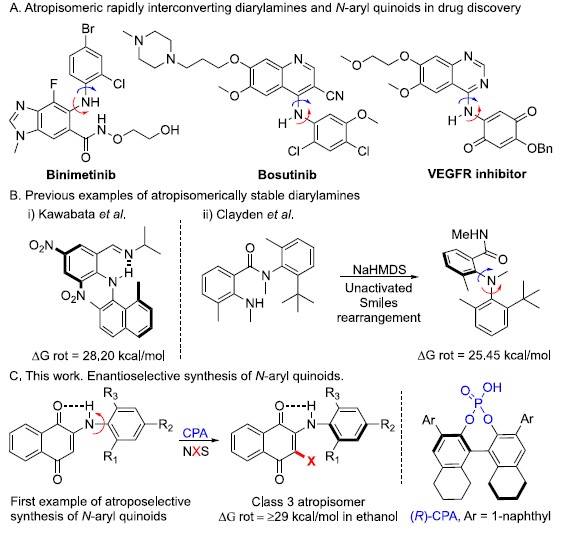
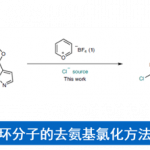
轴手性化合物广泛存在于药物和天然产物中,因而,轴手性化合物的合成受到化学家们的广泛关注。目前关于联芳基、苯甲酰胺以及苯胺类轴手性化合物的合成已经取得了不错的进展,但同样重要的轴手性二芳基胺类化合物的合成被很大程度被忽略了(Scheme 1A)。Kawabata课题组[1]成功构建了一系列分子内具有N-H-N氢键的轴手性二芳基胺类化合物,但该类化合物对分子内氢键的长度极其敏感,若去掉芳基上的吸电子基,相应化合物的立体化学稳定性则会迅速降低(Scheme 1B)。最近,Clayden课题组[2]构建了分子内无氢键作用的轴手性二芳基胺类化合物,但这类化合物在室温条件下都会迅速消旋化(Scheme 1B)。为了开发新的有效合成立体化学稳定的轴手性二芳基胺类化合物,美国圣地亚哥州立大学Gustafson课题组首次报道了手性磷酸催化N-芳基醌类化合物的不对称卤化反应,能以良好至优秀的收率和选择性得到一系列轴手性二芳基胺类化合物。同时,作者发现构建的轴手性二芳基胺类化合物分子内存在N-H-O氢键,所以该类化合物能稳定存在。
“Catalytic Atroposelective Synthesis of N‑Aryl Quinoid Compounds”
Vaidya, S. D.; Toenjes, S. T.; Yamamoto, N.; Maddox, S. M.; Gustafson, J. L.* J. Am. Chem. Soc. 2020, 142, 2198-2203. DOI: 10.1021/jacs.9b12994
Scheme 1. 研究背景
论文作者介绍
Jeffrey L. Gustafson
研究经历
- 2006, B.S., Chemistry; San Diego State University;
- 2011, Ph.D., Organic Chemistry; Yale University;
- 2011-2013, NIH Postdoctoral Fellow; Yale University.
研究内容
(a) The development of chemical methodologies that enable the enantioselective synthesis of complex molecules; (b) The application of these methodologies to access new selective small molecule probes pertaining to aberrant protein phosphorylation; and (c) The design, synthesis and evaluation of small molecule vanadate complexes as phosphatase inhibitors.
论文概要
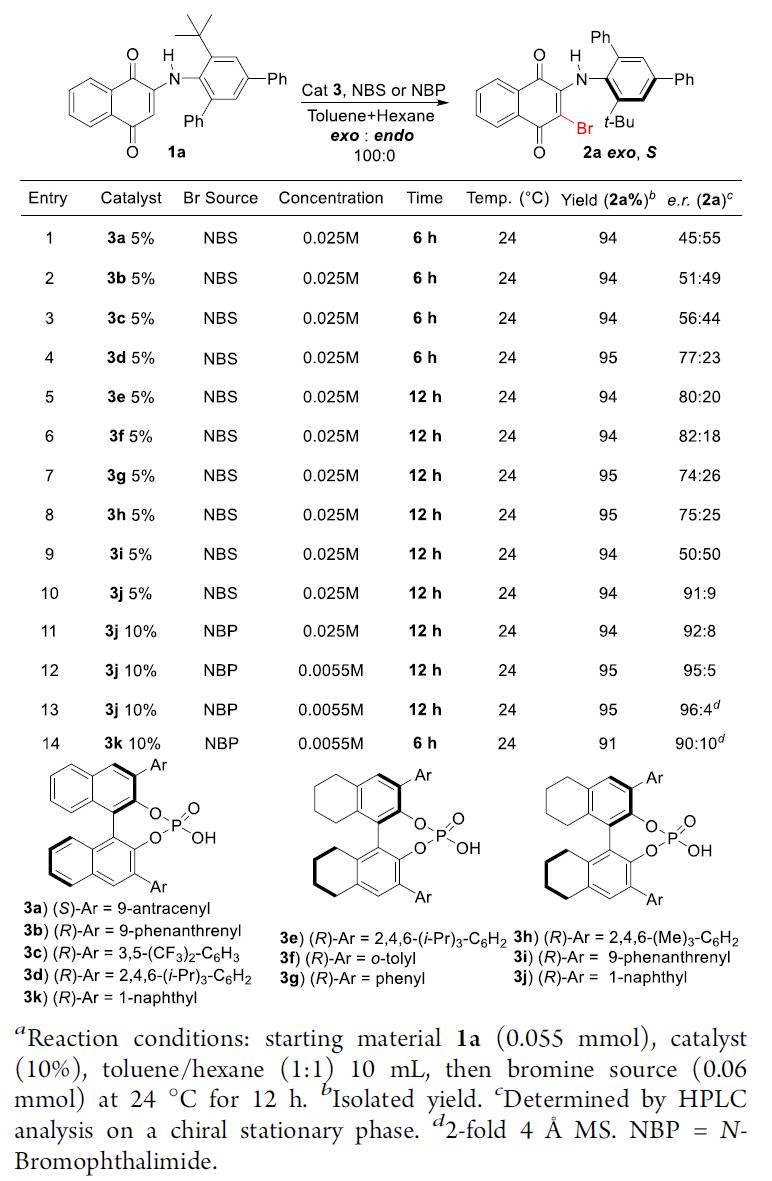
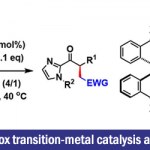
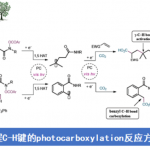
以N-芳基醌类化合物1a和NBS作为模板底物,作者对各种反应条件进行反复筛选,确定最佳条件为(Table 1):10 mol% 3j为最优催化剂,甲苯和正己烷的混合溶剂为最优溶剂,4Å分子筛为添加物,在24oC条件下反应12 h,能以95%的收率和92的对映选择性得到相应产物3a。
Table 1. 条件筛选
在最优反应条件下,作者对反应的底物范围进行了考察。各种2,4-二芳基取代、杂环、萘换取代、2-芳基-4-氯取代的N-芳基醌均能较好的适应反应条件,能以良好至优秀的收率和对映选择性得到相应轴手性二芳基胺类化合物。但N-芳基醌6位的叔丁基换成异丙基或三氟甲基,相应产物的对映选择性明显降低。若将NBS换成NCS或NIS,其相应产物的对映选择性也会降低。同时,若将N-芳基醌中的氮原子保护住,则反应不能正常进行。
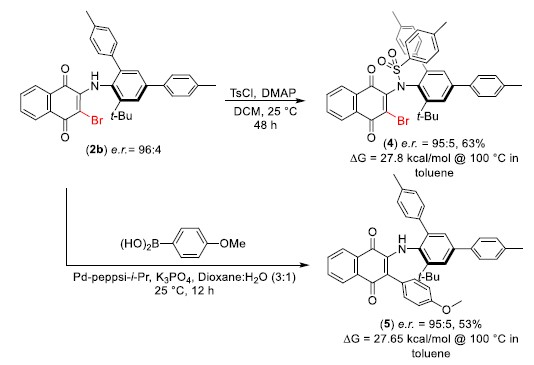
随后,为了证明反应的应用潜力,作者又进行了一系列衍生反应。2b中的氮在碱性条件下可被Ts基团取代,能以良好的收率和优秀的对映选择性得到化合物4。同时,2b发生偶联反应,可以中等的收率和优秀的对映选择性得到化合物5。
Scheme 2. 衍生反应
论文总结评价
美国圣地亚哥州立大学Gustafson课题组首次报道了手性磷酸催化N-芳基醌类化合物的不对称卤化反应,能以良好至优秀的收率和选择性得到一系列轴手性二芳基胺类化合物。同时,作者发现构建的轴手性二芳基胺类化合物分子内存在N-H-O氢键,所以该类化合物能稳定存在。该策略为高效合成轴手性二芳基胺类化合物提供了一种新方法。
参考文献
- [1] (a) Kawabata, T.; Jiang, C.; Hayashi, K.; Tsubaki, K.; Yoshimura, T.; Majumdar, S.; Sasamori, T.; Tokitoh, N. Am. Chem. Soc. 2009, 131, 54-55. DOI: 10.1021/ja808213r (b) Hayashi, K.; Matubayasi, N.; Jiang, C.; Yoshimura, T.; Majumdar, S.; Sasamori, T.; Tokitoh, N.; Kawabata, T. J. Org. Chem. 2010, 75, 5031-5036. DOI: 10.1021/jo100586b
- [2] Costil, R.; Dale, H. J. A.; Fey, N.; Whitcombe, G.; Matlock, J. V.; Clayden, J. Angew. Chem., Int. Ed. 2017, 56, 12533-12537. DOI: 1002/anie.201706341
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!



















No comments yet.