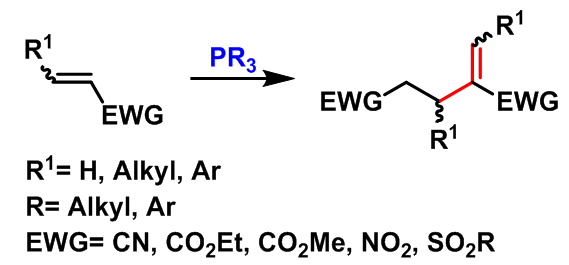
概要
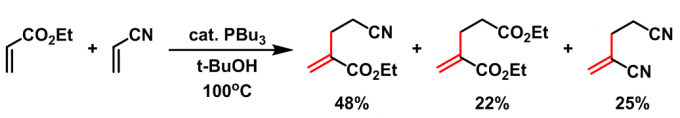
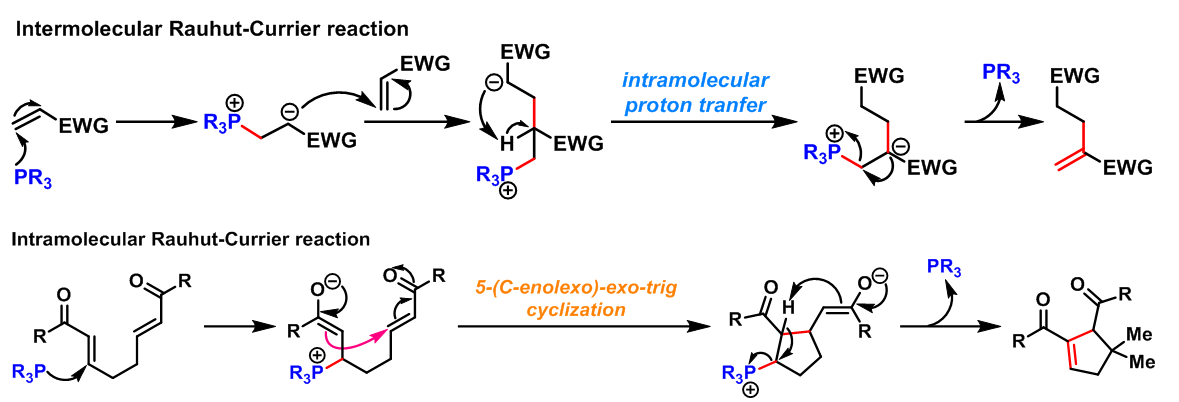
Rauhut-Currier反应(Rauhut-Currier reaction, RC reaction)又称为Rauhut-Currier二聚反应(Rauhut-Currier demerization)是在少量质子源如叔丁醇存在下,有机膦催化的缺电子烯烃的二聚反应。该反应在1963年,由美国氨腈公司(American Cyanamide Company) 的M.M. Rauhut与H. Currier首次报道[1]。1970年,McClure报道了首例膦催化下两种活化烯烃之间的交叉Rauhut-Currier反应[2]。然而,该反应条件下,目标产物的产率与选择性较低。
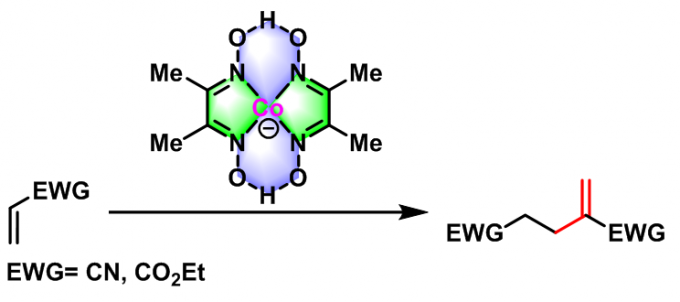
1977年,D. A. White 研究组报道了二(丁二酮肟)合钴(I)阴离子催化的活化烯烃的二聚反应[3]。
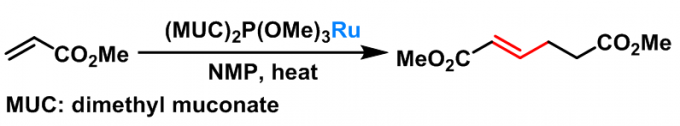
1986年R. J. McKinney研究组报道了均相钌催化的Rauhut-Currier反应[4], 并对影响反应速率及反应选择性的各类因素进行了系统研究。
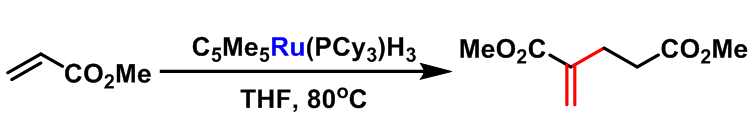
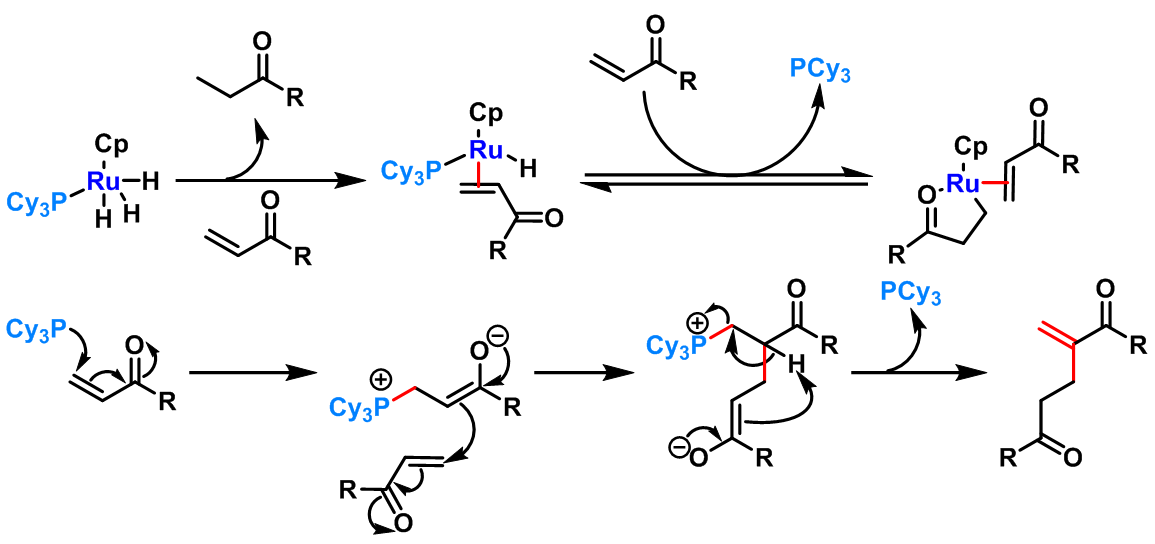
1998年,C. S. Yi 研究了C5Me5Ru(PCy3)H3促进的Rauhut-Currier反应[5],并成功实现了将丙烯酸酯及其它α,β-不饱和羰基化合物转化为1,5-二羰基化合物的反应。
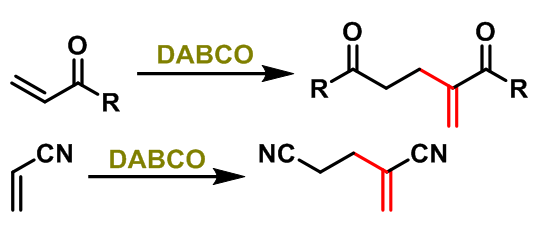
1987年,D. V. Basavaiah报道了DABCO(有机胺)催化的α,β-不饱和酮与α,β-不饱和腈的二聚反应[6],取得了优良的产率。
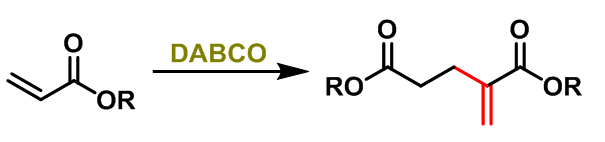
1990年,S.E. Drewes 报道了DABCO (有机胺) 催化的α,β-不饱和酯的二聚反应[7],研究表明在该反应条件下同样取得优良的产率。
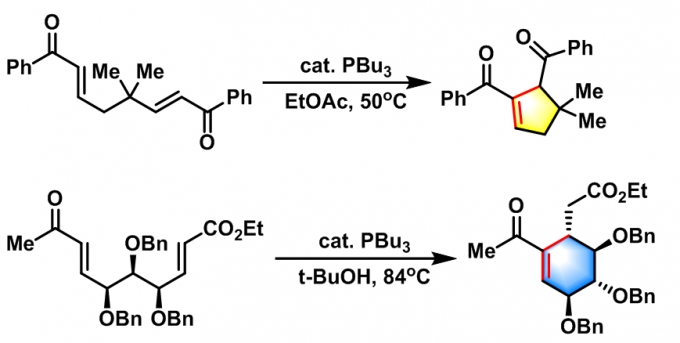
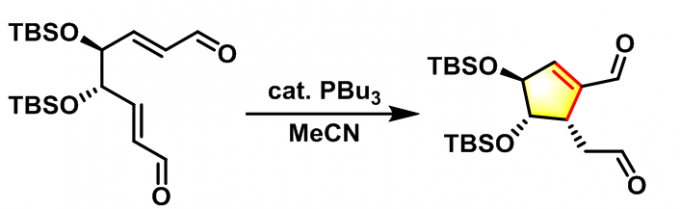
2002年M.J. Krische 等报道了有机膦催化的Michael环化异构化反应(Michael cycloisomerisation),即分子内Rauhut-Currier反应[8](intramolecular Rauhut-Currier reaction, IRC reaction, 又称为插烯Morita (森田 健一, 東洋レーヨン株式会社基礎研究所, Morita Kenichi, The Basic Research Laboratories Toyo Rayon Company Ltd)-Baylis-Hillman reaction),成功合成了各种五元与六元环化合物。
随后,W. R. Roush 研究组将上述反应扩展至其它活化烯烃及醛类化合物[9]–[11]。
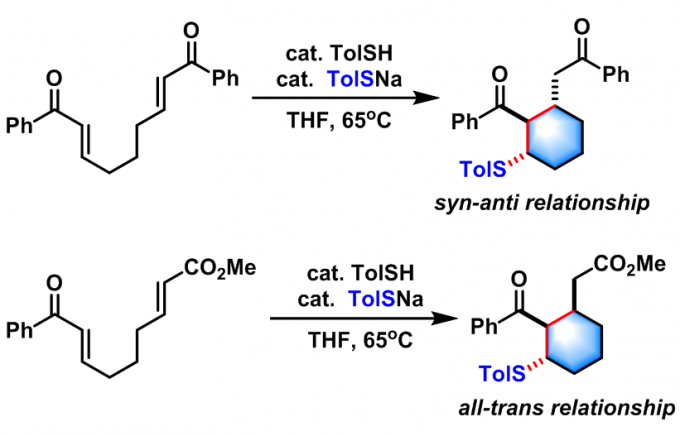
P.J. Murphy采用硫醇催化剂参与的Rauhut-Currier反应,成功实现了对称双苯烯酮及不对称enone-enoate的合成[12]。
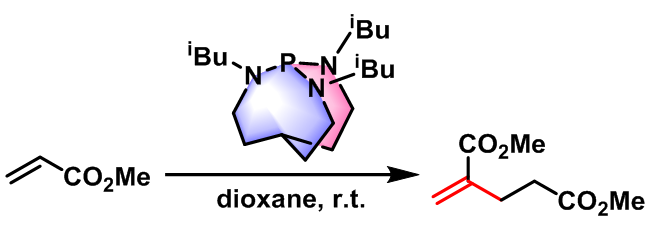
2003年,J. G. Verkade采用具有较大位阻的超强碱proazaphosphatranes作为催化剂,成功实现了的head-to-tail二聚,并获得优良的产率[13]。
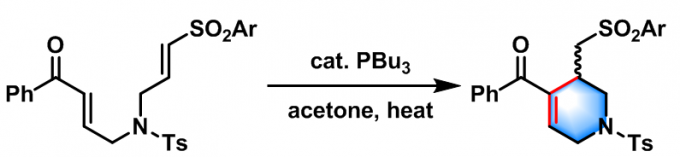
2004年,M. J. Krische[14]将底物应用范围扩展至烯基砜。
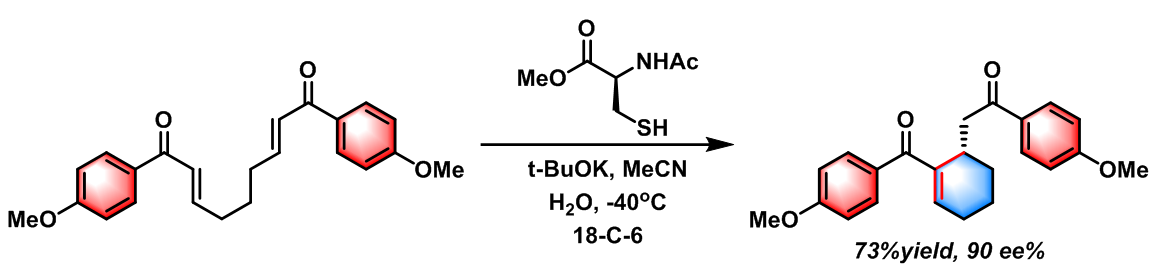
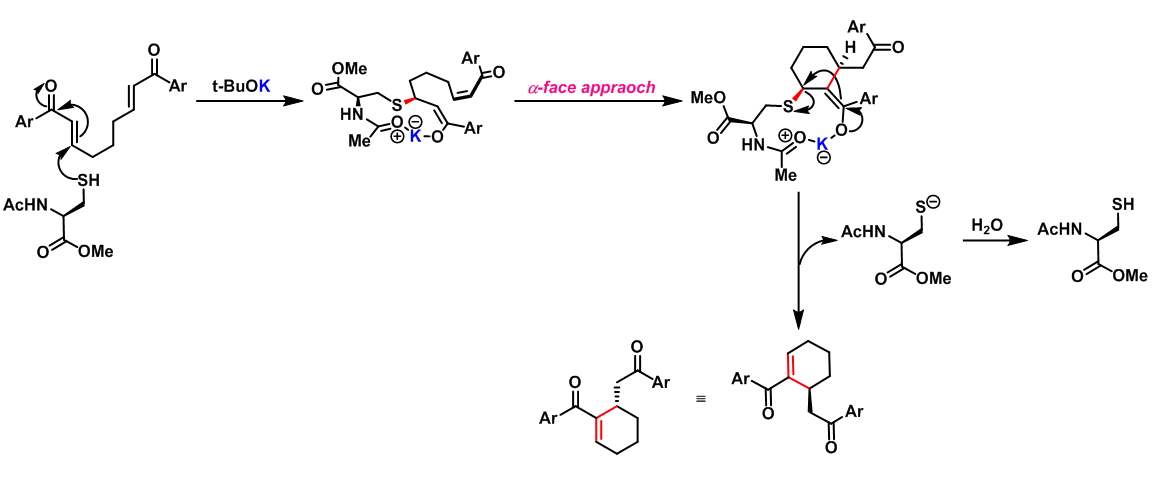
2007年S. J. Miller 报道了由保护型半胱氨酸(Protected Cysteine)催化的首例对映选择性Rauhut-Currier反应[15]。
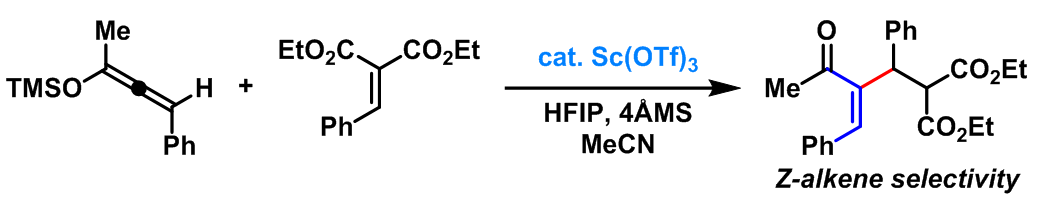
2008年,K. A. Scheidt 报道了在Lewis酸(Sc(OTf)3)条件下进行的硅氧基联烯(α-酰基乙烯基等价物)的分子内Rauhut-Currier反应[16]。该反应条件具有优良的官能团兼容性、产率及Z-选择性。引入手性配体即可获得优良的对映选择性。
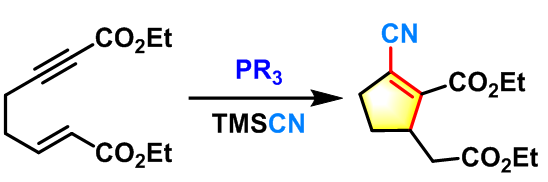
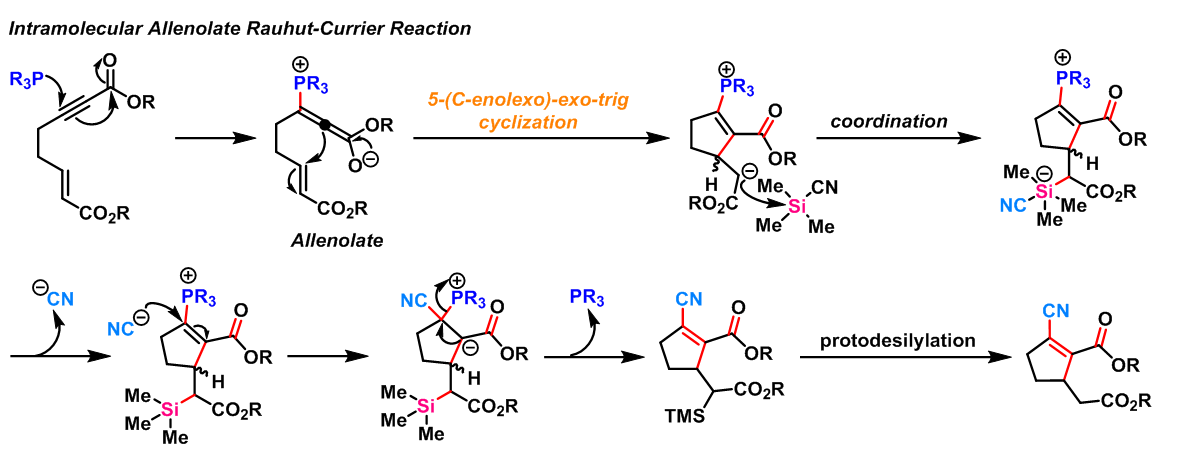
2012年,J. A. MacKay 报道了由分子内联烯烯醇(Allenolate)参与的Rauhut-Currier反应,该条件可以获得传统的条件下无法获得的产物[17]。
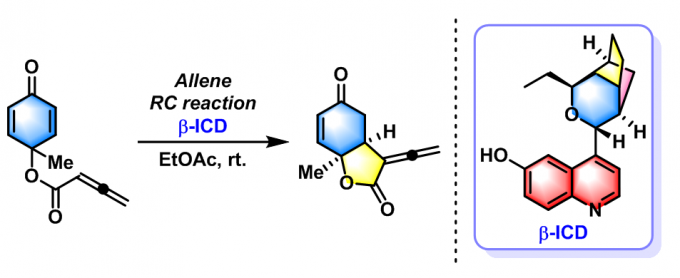
2016年,Y. Lu通过对映选择性分子内联烯醇负离子(Allenolate)的Rauhut-Currier反应,成功完成了环己二烯酮的去对称化反应[18]。
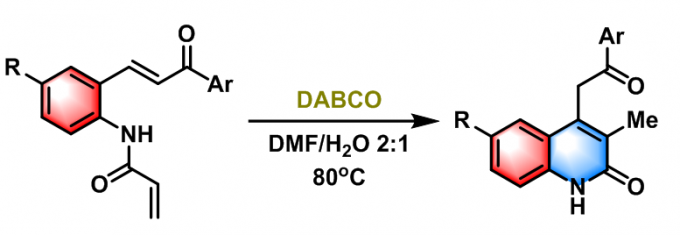
2017年, K. C. Bharadwaj采用丙烯酰胺的Rauhut-Currier反应,完成了quinolone类化合物的合成[19]。
目前Rauhut-Currier反应已经广泛应用于各类生物活性天然产物构建时的关键步骤[20]– [24]。
基本文献
- [1] M. M. Rauhut, H. Currier, U.S. Patent 1963, 3074999.
- [2] J. D. McClure, J. Org. Chem. 1970, 35, 3045. doi: 10.1021/jo00834a039.
- [3] D. A. White, Synth. React. Inorg.Met.Org. Chem. 1977, 7, 433.doi: 10.1080/00945717708069720.
- [4] R. J. McKinney, M. C. Colton, Organometallics 1986, 5, 1080.doi: 10.1021/om00137a003.
- [5] C. S. Yi, N. Liu, J. Organomet. Chem. 1998, 553, 157. doi: 10.1016/S0022-328X(97)00591-3.
- [6] D. V. Basavaiah, V. L. Gowriswari, T.K. Bharathi, Tetrahedron Lett.1987, 28, 4591.doi:10.1016/S0040-4039(00)96573-0.
- [7] S.E. Drewes, N.D. Emslie, N. Karodia, Synth. Commun. 1990, 20, 1915.doi:10.1080/00397919008053121.
- [8] S. A. Frank, D. J. Mergott, W. R. Roush, J. Am. Chem. Soc. 2002, 124, 2404. doi: .10.1021/ja017123j.
- [9] D. J. Mergott, S. A. Frank, W. R. Roush, Org. Lett. 2002, 4, 3157. doi: 10.1021/ol026540d.
- [10] L.C. Wang, A.L. Luis, K. Agapiou, H.Y. Jang, M.J. Krische, J. Am. Chem. Soc. 2002, 124, 2402.doi: 10.1021/ja0121686.
- [11] J. L. Methot, W. R. Roush, Adv. Synth. Catal. 2004, 346, 1035. doi: 10.1002/adsc.200404087.
- [12] P. M. Brown, N. Kappel, P. J. Murphy, Tetrahedron Lett. 2002, 43, 8707. doi: 10.1016/S0040-4039(02)02142-1.
- [13] W. P. Su, D. McLeod, J. G. Verkade, J. Org. Chem. 2003, 68, 9499.doi: 10.1021/jo034815c.
- [14] A. L. Luis, M. J. Krische, Synthesis, 2004, 2579. doi: 10.1055/s-2004-831191.
- [15] C. E. Aroyan, S. J. Miller J. Am. Chem. Soc. 2007, 129, 256. doi:10.1021/ja067139f.
- [16] T. E. Reynolds, M. S. Binkley, K. A. Scheidt, Org. Lett. 2008, 10, 2449. doi: 10.1021/ol800745q.
- [17] J. A. MacKay, Z. C. Landis, S. E. Motika, M. H. Kench, J. Org. Chem., 2012, 77, 7768. doi: 10.1021/jo3015769.
- [18] W. Yao, X. Dou, S. Wen, J. Wu, J. J. Vittal,Y. Lu, Nature Commun. 2016, 7, 13024.doi: 10.1038/ncomms13024.
- [19] K. C. Bharadwaj, Tetrahedron 2017, 21, 5690. doi: 10.1016/j.tet.2017.08.002.
- [20] J. L. Methot, W. R. Roush, Org. Lett., 2003, 5, 4223.doi: 10.1021/ol0357550.
- [21] D. J. Mergott, S. A. Frank, W. R. Roush, Org. Lett., 2002, 4, 3157.doi: 10.1021/ol026540d.
- [22] K. Agapiou, M. J. Krische, Org. Lett. 2003, 5, 1737. doi: 10.1021/ol030035e.
- [23] Krafft, M. E.; Haxell, T. F. N. J. Am. Chem. Soc. 2005, 127, 10168.doi: 10.1021/ja052146+.
- [24] P. Webber, M. J. Krische, J. Org. Chem. 2008, 73, 9379. doi: 10.1021/jo802165k.
反应机理
- 有机膦催化
- 钌催化剂催化
- 对映选择性Rauhut-Currier反应
- 分子内联烯烯醇参与的Rauhut-Currier反应
参考文献
- [1] M. M. Baizer, J. D. Anderson, J. Org.Chem. 1965, 30, 1357.doi: 10.1021/jo01016a004.
- [2] C. S. Yi, N. Liu, J. Organomet. Chem. 1998, 553, 157. doi: 10.1016/S0022-328X(97)00591-3.
- [3] C.D. Hall, N. Lowther, B.R. Tweedy, A.C. Hall, G. Shaw, J. Chem. Soc. Perkin Trans. 2 1998, 2047.doi: 10.1039/A707559F .
- [4] R. R. Huddleston, M. J. Krische, Synlett 2003, 12. doi: 10.1055/s-2003-36213.
- [5] Carrie E. Aroyan, Alpay Dermenci and Scott J. Miller Tetrahedron 65, 2009, 4069. doi:10.1016/j.tet.2009.02.066.
- [6] W.D.Teng, R.C. Huang, K. W. Kwong, M. Shi, P. H. Toy, J. Org. Chem. 2006, 71, 368.doi: 10.1021/jo051802l.
反应实例
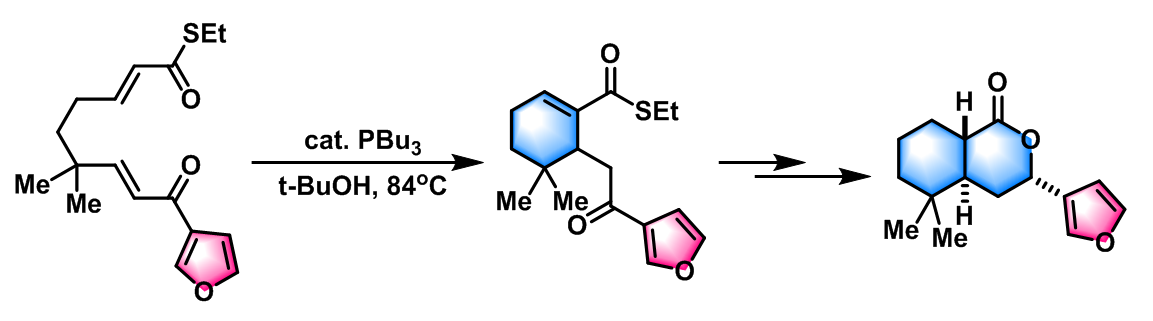
- FR182877的全合成[1]
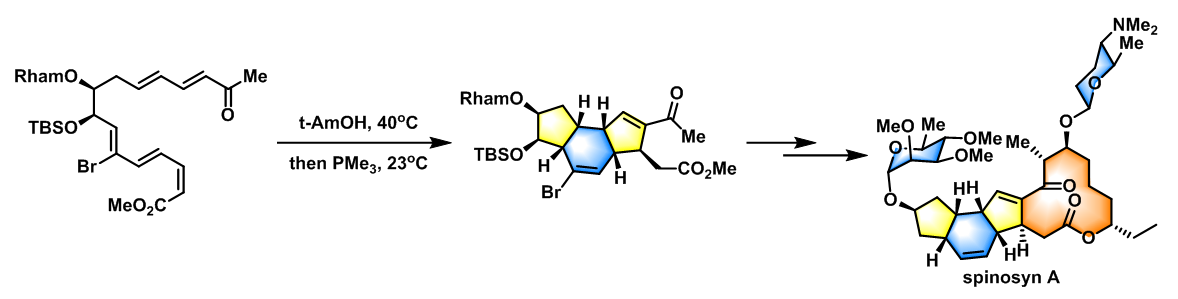
- spinosyn A Tricyclic Nucleus的全合成[2]
- (±)-ricciocarpin A的全合成[3]
实验步骤
氮气气氛下,向圆底烧瓶中加入甲基乙烯基酮(1 eq.)、氢醌 (0.006 eq.)、Ph3P (7.1 mmol)及叔丁醇(底物浓度为0.16 M)。将上述反应混合物在118oC下搅拌直至反应结束。反应结束后,将溶剂与未转化的甲基乙烯基酮通过减压蒸馏除去。将残余物 通过小型Vigreux分馏柱进行蒸馏(在1.2 mmHg压力下,收集55-75oC的馏分) 获得粗产物。将粗产物通过2-ft spinning-band 分馏柱进一步分馏 (在5 mmHg压力下,收集91-92oC的馏分)纯化,获得相应目标产物。
实验技巧
参考文献
- [1] J. L. Methot, W. R. Roush, Org. Lett., 2003, 5, 4223.doi: 10.1021/ol0357550.
- [2] D. J. Mergott, S. A. Frank, W. R. Roush, Org. Lett., 2002, 4, 3157.doi: 10.1021/ol026540d.
- [3] K. Agapiou, M. J. Krische, Org. Lett. 2003, 5, 1737. doi: 10.1021/ol030035e.
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!




















No comments yet.