本文作者:石油醚
概要
Tomislav Rovis:美国哥伦比亚大学(Columbia University)化学系教授,有机化学家,
课题组主页:https://rovislab.wixsite.com/home
经历
1986-1990年 多伦多大学(University of Toronto)获得学士学位
1993-1998年 多伦多(University of Toronto)大学获得博士学位(Prof. Mark Lautens)
1998-2000年 哈佛大学(Harvard University)NSERC博士后研究员(Prof. David A. Evans)
2000-2005年 科罗拉多州立大学(,Colorado State University)化学系助理教授
2005-2008年 科罗拉多州立大学( Colorado State University)副教授
2008-2016年 科罗拉多州立大学(,Colorado State University)教授
2016- 哥伦比亚大学(Columbia University)化学系教授
获奖经历
2016 Alexander von Humboldt Foundation Fellowship
2016 Research Excellence Award (OVPR – CSU)
2015 Thomson Reuters Highly Cited Researcher
2014 Arthur C. Cope Scholar Award
2014 Japan Society for the Promotion of Science Fellowship
2013 ISHC Katritzky Junior Award in Heterocyclic Chemistry
2013 Fellow of the American Association for the Advancement of Science
2010 Roche Excellence in Chemistry Award
2008-2016 John K. Stille Chair in Chemistry
2007-2012 Herman Frasch Foundation Grantee
2005-2007 Monfort Professor
2005 Alfred P. Sloan Fellow
2005 Boehringer-Ingelheim Research Award
2004 Amgen Young Investigator
2004 Johnson & Johnson Focused Giving Grantee
2004 Eli Lilly Grantee
2003 NSF CAREER Awardee
2003 GlaxoSmithKline Scholar
2000-2004 Merck Research Laboratories Unrestricted Grant Recipient
研究方向
在过去的十年中,Rovis小组的研究涵盖不对称催化,有机催化以及有机金属化学等方面的研究课题题。自该课题组成立以来,Rovis团队在上述领域已经取得一系列重要的合成方法学研究进展,主要涉及乙烯基缩醛或乙烯基醚的立体选择性重排;镍催化的各种环状内消旋酸酐的去对称化反应;采用本实验室发展各类方法学合成重要的天然产物。在N-杂环卡宾(NHC)作为有机催化剂的领域,R-Lab同样有突出的贡献,尤其在三唑基卡宾(triazolylidene-based carbenes)催化的酰基负离子,偶氮-烯醇负离子 (azolium-enolate)以及高烯醇化合物反应活性方面的开创性研究。同时,Rovis小组采用本课题组发展的方法学,顺利完成一系列对于药物化学或者药物研发领域十分重要的含氮与氧杂环分子。本课题组目前的研究更加关注以下几方面:
1.光氧化还原反应催化1-3
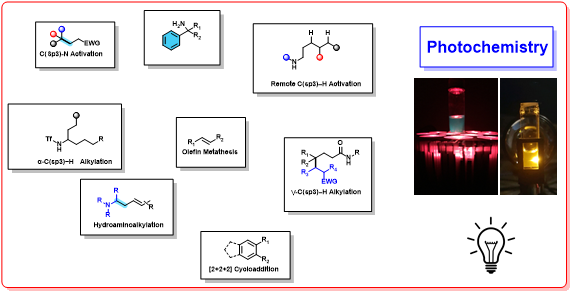
光氧化还原催化使化学家能够采用可见光的能量来作为主要驱动力从而使惰性化学键产生活化。光子的普遍存在性与可调控性,使光催化方法学成为实现传统的非反应活性化学键官能团化的理想的外部条件。研究表明,金属-多重吡啶配合物(metal poly-pyridyl complexes)在吸收可见光后,能够作为稳定的Co(II)前催化剂的氧化剂或还原剂4-6。R-Lab的研究方向之一是将光氧化还原催化与钴催化相结合,从而产生出新的催化活性物种,进而在材料科学中开辟新的研究领域。Rovis小组在这一领域的另一目标是开发一种脂族胺C(Sp3)-H官能团化的统一策略。 在这方面,R-Lab发现,通过光化学方法,使N-H键氧化,随后通过分子内氢原子转移(HAT),能够进一步阐述烷基自由基。接下来,Rovis小组选择各类自由基受体,捕获产生的相应烷基自由基,进而合成出一系列各种官能团化的胺产物。同时,通过改变氮原子中连接的导向基团,能够决定烷基自由基中间体进一步反应的位点选择性,从而顺利实现胺底物在不同位置的官能团化7,例如α8,β,γ9和δ10。目前,R-lab正在对含氮与氧的脂肪族链状分子的C(Sp3)-H官能团化的原位瞬态导向基团(in situ transient directing groups)进行进一步研究(Fig 1)。
Fig 1 光催化
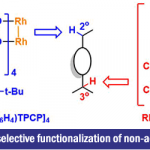
2.铑催化11
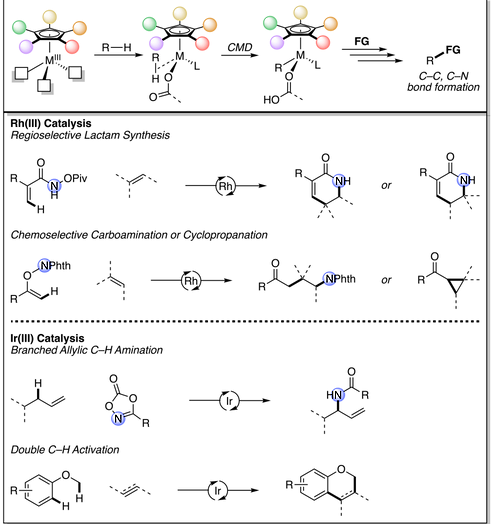
Rovis教授小组的研究方向同样涉及通过Rh(III)-环戊二烯基配合物促进新型合成转化。在这一方向的研究领域之一便是C(Sp2)-碳中心的导向金属化(directed metalation),形成Rhodacyclic中间体。 之后,通过Rhodacyclic中间体与不饱和化合物(如烯烃,炔烃或重氮化合物)之间的插入反应,进一步形成不同大小的含氮杂环。 此外,通过巧妙设计导向基团,进而开发出一种较为有趣的胺碳化反应(carboamination)。在这一反应中,首先发生C-H键12-15活化,随后,通过导向基团的去除,再经过还原消除过程,形成碳-氮键,最终获得非环产物。此外,R-lab同样对Rh(III)配合物中Cp配体的立体位阻与电子参数等因素对16-22整体反应性的影响进行系统地研究。目前,Rovis教授研究发现,采用Rh(III)配合物所催化反应的区域选择性、非对映选择性、化学选择性以及反应活性均受到Cp配体性质的显著影响(Fig 2)。
Fig 2 铑催化
3.酶催化
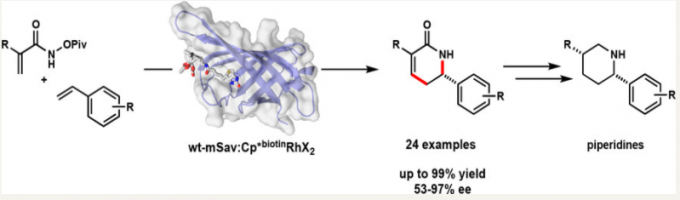
自然界中发现的酶可以高效地实现一系列有机合成转化过程。R-Lab十分关注自然界中存在的酶催化过程,并将其应用于实验室中的合成转化,尤其是通过金属有机试剂促进的化学转化。近年来,通过将金属有机辅助因子(organometallic cofactor)与宿主蛋白质(host protein)结合而形成的人工金属酶(artificial metalloenzymes),已经有证实是传统催化模式的一种有效的替代方法。Rovis教授小组采用生物素-链霉亲和素技术(biotin-streptavidin technology),从而与Rh(III)辅因子结合,形成能够在水相环境中完成C-H活化的金属酶。选择定点突变(site-directed mutagenesis)能够产生出反应活性性增强,同时选择性获得提升的链霉亲和素(streptavidin, SAV)金属酶库。更加确切地讲,Rovis教授目前在该领域的研究主要关注的是采用这类金属酶作为大分子催化剂(macro-catalysts),进而提高Rh(III)催化的C-H活化反应体系的反应活性与选择性23(Fig 3 )。
Fig 3 酶催化
其他
1.Chem–Station对Tomislav Rovis教授的“可选择环尺寸的双胺化”的工作做的介绍24。
2. Chem–Station对Tomislav Rovis教授的“光氧化还原催化伯胺的脱胺基烷基化反应”的工作做的介绍。
参考文献
- Ashley, M. A.; Rovis, T., J. Am. Chem. Soc. 2020,142(43), 18310-18316, doi:10.1021/jacs.0c08595.
- Nicastri, M. C.; Lehnherr, D.; Lam, Y.-h.; DiRocco, D. A.; Rovis, T., J. Am. Chem. Soc. 2020,142(2), 987-998, doi:10.1021/jacs.9b10871.
- Theunissen, C.; Ashley, M. A.; Rovis, T., J. Am. Chem. Soc. 2019,141(17), 6791-6796, doi:10.1021/jacs.8b13663.
- Ravetz, B. D.; Tay, N. E. S.; Joe, C. L.; Sezen-Edmonds, M.; Schmidt, M. A.; Tan, Y.; Janey, J. M.; Eastgate, M. D.; Rovis, T., ACS Cent. Sci. 2020,6(11), 2053-2059, doi:10.1021/acscentsci.0c00948.
- Thullen, S. M.; Rovis, T., J. Am. Chem. Soc. 2017,139(43), 15504-15508, doi:10.1021/jacs.7b09252.
- Ruhl, K. E.; Rovis, T., J. Am. Chem. Soc. 2016,138(48), 15527-15530, doi:10.1021/jacs.6b08792.
- Thullen, S. M.; Treacy, S. M.; Rovis, T., J. Am. Chem. Soc. 2019,141(36), 14062-14067, doi:10.1021/jacs.9b07014.
- Ashley, M. A.; Yamauchi, C.; Chu, J. C. K.; Otsuka, S.; Yorimitsu, H.; Rovis, T., Angew. Chem. Int. Ed. 2019,58(12), 4002-4006, doi:10.1002/anie.201812227.
- Chen, D.-F.; Chu, J. C. K.; Rovis, T., J. Am. Chem. Soc. 2017,139(42), 14897-14900, doi:10.1021/jacs.7b09306.
- Chu, J. C. K.; Rovis, T., Nature 2016,539(7628), 272-275, doi:10.1038/nature19810.
- Filloux, C. M.; Rovis, T., J. Am. Chem. Soc. 2015,137(1), 508-517, doi:10.1021/ja511445x.
- Piou, T.; Rovis, T., Acc. Chem. Res. 2018,51(1), 170-180, doi:10.1021/acs.accounts.7b00444.
- Archambeau, A.; Rovis, T., Angew. Chem. Int. Ed. 2015,54(45), 13337-13340, doi:10.1002/anie.201504150.
- Romanov-Michailidis, F.; Sedillo, K. F.; Neely, J. M.; Rovis, T., J. Am. Chem. Soc. 2015,137(28), 8892-8895, doi:10.1021/jacs.5b04946.
- Piou, T.; Rovis, T., J. Am. Chem. Soc. 2014,136(32), 11292-11295, doi:10.1021/ja506579t.
- Lee, S.; Semakul, N.; Rovis, T., Angew. Chem. Int. Ed. 2020,59(12), 4965-4969, doi:10.1002/anie.201916332.
- Lee, S.; Lei, H.; Rovis, T., J. Am. Chem. Soc. 2019,141(32), 12536-12540, doi:10.1021/jacs.9b07012.
- Lei, H.; Conway, J. H.; Cook, C. C.; Rovis, T., J. Am. Chem. Soc. 2019,141(30), 11864-11869, doi:10.1021/jacs.9b06366.
- Phipps, E. J. T.; Rovis, T., J. Am. Chem. Soc. 2019,141(17), 6807-6811, doi:10.1021/jacs.9b02156.
- Piou, T.; Romanov-Michailidis, F.; Ashley, M. A.; Romanova-Michaelides, M.; Rovis, T., J. Am. Chem. Soc. 2018,140(30), 9587-9593, doi:10.1021/jacs.8b04243.
- Piou, T.; Romanov-Michailidis, F.; Romanova-Michaelides, M.; Jackson, K. E.; Semakul, N.; Taggart, T. D.; Newell, B. S.; Rithner, C. D.; Paton, R. S.; Rovis, T., J. Am. Chem. Soc. 2017,139(3), 1296-1310, doi:10.1021/jacs.6b11670.
- Neely, J. M.; Rovis, T., J. Am. Chem. Soc. 2014,136(7), 2735-2738, doi:10.1021/ja412444d.
- Hassan, I. S.; Ta, A. N.; Danneman, M. W.; Semakul, N.; Burns, M.; Basch, C. H.; Dippon, V. N.; McNaughton, B. R.; Rovis, T., J. Am. Chem. Soc. 2019,141(12), 4815-4819, doi:10.1021/jacs.9b01596.
24.可选择环尺寸的双胺化
























No comments yet.