本系列内容是为帮助大家能够直面全合成中应克服的困难而编写的。列举了一些在全合成过程中遇到的棘手问题的解决方案,采用了小问答的形式介绍给大家。
本期介绍的合成问题来自北海道大学的宮下正昭・谷野圭持等人在2004年发表的Norzoanthamine全合成。
第四回问题请直戳(问题直达)。本次为解答篇。
Total Synthesis of Norzanthamine
Miyashita, M.; Sasaki, M.; Hattori, I.; Sakai, M.; Tanino, K. Science 2004, 305, 495. DOI:10.1126/science.1098851
解答例
无论如何不解决反应以及副反应机理的话,此题无法下手。
预期反应希望通过酮基转换成炔基反应。通过无水Tf2O将酮基转化为enol triflate,之后再通过碱基(DBU)作用下的β消除最后得到预期化合物。
而实际上,在形成B的同时,也生成了副反应产物C。仔细观察化合物C会发现,反应处的碳原子的氧化度发生了改变。实际上,这个副反应是通过分子内邻位的H原子正位于醚氧键的α位上,由于缺电子性羰基处发生了氢负离子重排。在Tf2O反应下与A到B同步发生,之后向着各自反应进行。也就是说,由于氢负离子重排,羰基发生还原,之后由于碱基环境下的分子内环化反应,副反应生成物C就这样子粗线了。
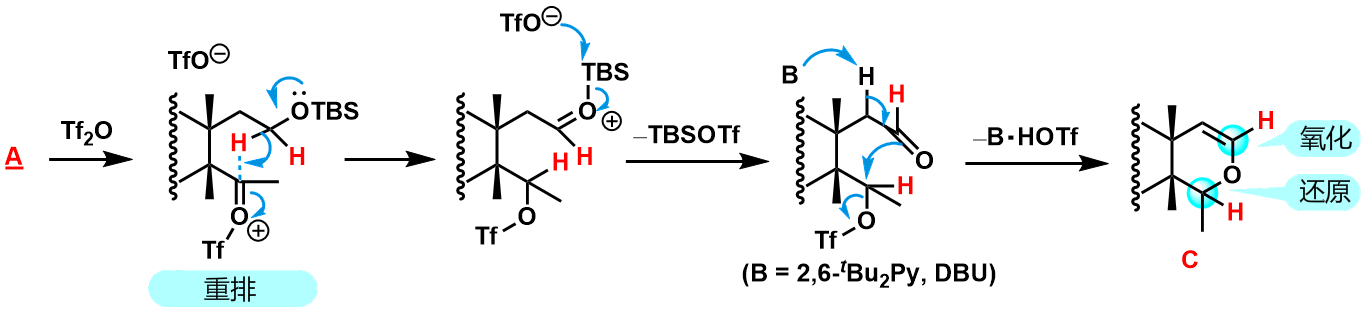
理解了上述内容之后,我们就需要考虑如何抑制C的生成。于是就想到了增加反应分歧点——氢负离子重排的位置的反应难度。让A到B的反应途径不会发生的话,就可以解决这一问题了。
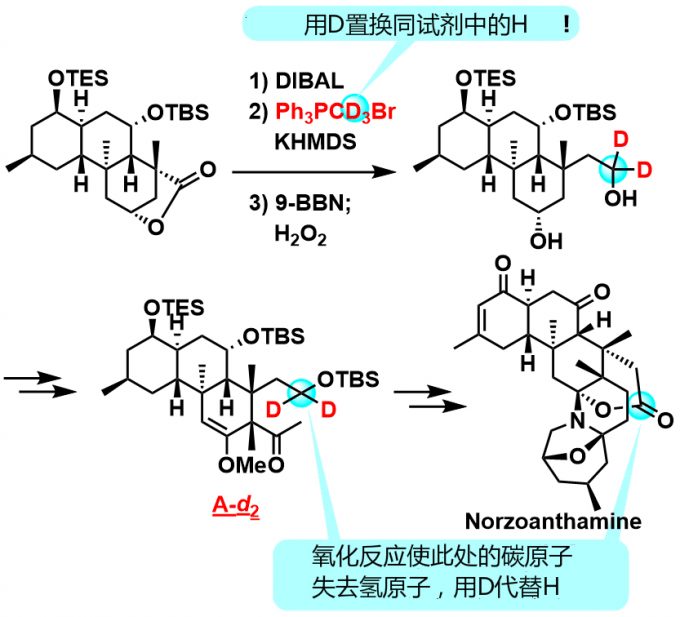
在问题篇中,提出:反应底物氘化之后就可以解决此问题。利用动力学同位素效应(Kinetic Isotope Effect, KIE)便可推测出来。简单地说KIE就是利用比反应相关原子质量数更大的同位体将其置换,降低反应速度。如此一来,不希望发生质子转移的那个H原子用氘原子替换的话,就可以抑制重排的发生了。
于是乎,就可以想到氘化物就是下图所示的A-d2
那么 让我们来看看整个过程吧。
首先,基本的合成路径并没有大幅度改变,用较为容易得到的Ph3PCD3Br作为引入氘原子的试剂。这样的话不仅可以控制药品制剂的价格,也可以防止反应路径大幅增加,节省了基础研究经费以及时间。
此外,让我们来看一看最后如何去掉全部氘原子,不在生成物种残留的手法吧。这里利用了氘化后的碳原子最终会氧化形成羰基这一性质,这样多有的D都将被氧化,生成物种也不会残留。
正因为可以从整体上把握合成路径的整体趋势,本期特意为大家选取了这个全合成问题作为「全合成・教你摆脱绝境的一手」的练习,本期的问题真的是非常好的解决办法。
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!



























No comments yet.