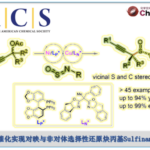
2016年、犹他大学・Matthew S. Sigman等人、成功实现了缺电子的末端烯烃的手性1,1-二芳基化反应。该反应中作者运用了手性阴离子相转移催化剂 (chiral anion phase-transfer, CAPT)、作为Pd催化剂的手性配体成功实现了高手性选择性的合成。同时通过对分子结构特性的多变量分析,解析了为何能得到生成高手性产物的一些重要要素。
“Development and Analysis of Pd(0) Catalyzed Enantioselective 1,1-Diarylation of Acrylates Enabled by Chiral Anion Phase Transfer”
Yamamoto, E.; Hilton, M. J.; Orlandi, M.; Saini, V.; Toste, F. D.; Sigman, M. S.* J. Am. Chem. Soc. 2016, 138, 15877. DOI: 10.1021/jacs.6b11367
研究的难点(问题点)
1,1-二芳基烷烃是各种生物活性物质的重要组成骨架单位之一。该结构可以通过末端烯烃与2种芳基供体进行三组分反应进行简便合成获得。这类反应在本论文作者以前的工作中已经有有过报道,而当时的手性反应一直没有解决[1]。当时的研究中,作者发现使用含N或者含P的手性配体后,反应活性显著下降,因此在当时作者没有进一步筛选配体。
继而在去年,作者用了CAPT[2],这个相转移试剂的加入,使得手性选择性实现困难的本反应,也能得到高选择性的进行,得到高手性产物。
解决手法
Pd催化剂与CAPT的组合早在2015年Toster等人报道的1,1-二芳基硼化反应[3]中就已经被证明是非常有效的。不溶性的重氮盐与CAPT磷酸阴离子形成的离子pair,使得重氮盐溶解性增强,在体系内以手性ion pair存在。然后由Pd(0)得到的芳基Pd(II)与烯烃反应,经过重排插入/β消除/向π-苄基活性种的重排,最后生成硼酸化反应。而当时该反应是单芳基化的硼酸化反应,因此,运用类似的该方法,进行二芳基化反应的研究在当时还是很值得期待的。
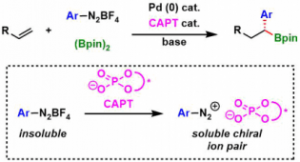
具体实验方法
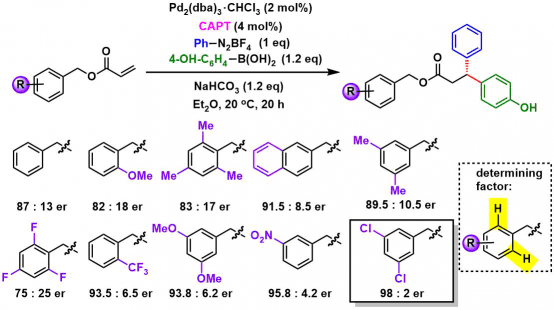
①溶剂的筛选
作者以苄酯、苯基重氮盐、4-羟基苯基硼酸为底物进行反应条件的筛选。以正己烷为溶剂的时候,反应完全没有进行。而改用THF,提高了重氮盐的溶解性后,反应进行了,但是手性选择性很差。因此作者认为,如果加入相转移阴离子CAPT在改善重氮盐的溶解性的同时,也能促进手性选择性的产生。
②CAPT结构的筛选
CAPT构造与er的关联性,作者进行了深入研究,这个工作量其实还是很大的。作者具体对3,3’位芳香环,2-位取代或者2,6-取代的情况进行了筛选,发现取代基位阻的大小对ee的选择性有显著影响。作者对于CAPT磷酸阴离子的模型结构进行了多变量要素的分析,得到了以下三个与手性选择性相关的要素。
- C3的芳基与BINAP之间的二面角(α)
- P=O的伸缩频率(νPOsy)
- C3芳基上的间位取代基(B1meta)

③底物结构最优化筛选
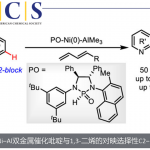
作者在得到最优结构的CAPT(标题图中所示)后、再通过筛苄基上的取代基、观察了这位置上的取代基对手性选择性的影响。通过对比发现、取代基为吸电子基团,特别是在3,5-取代的话都得到了非常好的结果。同时用②中的方法,对多变量的要素进行解析后发现2,6位氢原子的缺电性与选择性的高低具有直接的相关性。
苄基与反应位点距离比较远,所以CAPT上的9-蒽基与底物的苄基间存在的非共价键结合的相互作用,也是对手性选择性的提高具有重要贡献的。
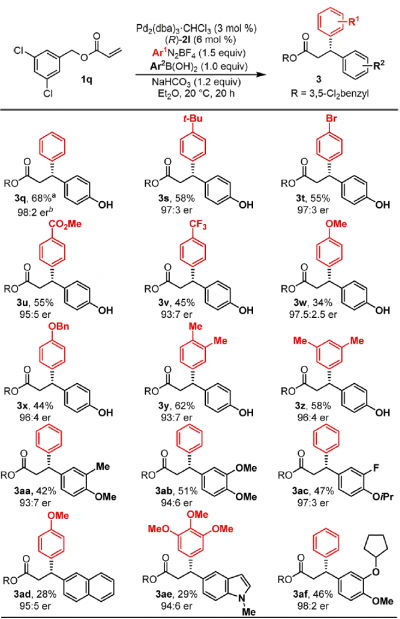
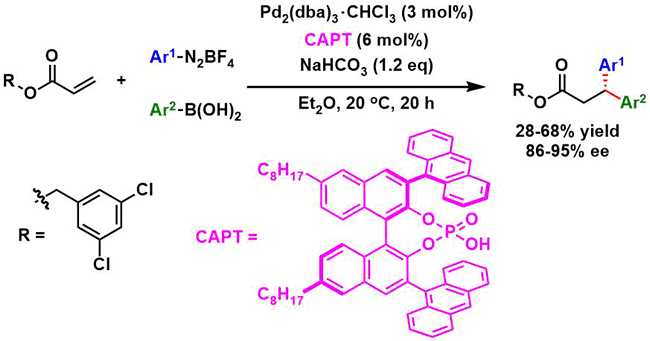
④底物拓展
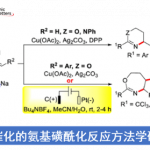
3,5-氯苯丙烯酸酯作为底物,进行了各种二芳基化反应的底物拓展(下图所示)。不管是富电子・缺电子的芳香环,反应都能进行,然而,缺电子的芳香化的情况,其手性选择性稍微比较低。另外对于芳香基硼酸反应试剂来说,只有含有富电子的芳香环的才能参与反应。这是因为该二芳基化与Heck反应有一个竞争性的缘故。因此,Pd与硼酸间的transmetallization这一步需要的反应底物必须是非常快的。另外硼酸与磷酸的直接相互作用也是导致transmetallization比较难发生的一个原因。
还需要注意的点
- 底物局限于苄基酯,从以前的报道[3]中都出现过酯・腈・烯烃等以底物都能进行芳基硼酸化反应。而其实二芳基化与芳基硼酸化相比,困难度是几何倍数提高的,这可能是由于transmetallization能的不同。
同时该读的相关文献?
- chiral ion pair催化体系的review[2]
- 名大的大井组的不对称阴离子配体的Pd催化体系[4]
参考文献
- (a) Liao, L.; Jana, R.; Urkalan, K. B.; Sigman, M. S. J. Am. Chem. Soc. 2011, 133, 5784. DOI: 10.1021/ja201358b (b) Saini, V.; Sigman, M. S. J. Am. Chem. Soc. 2012, 134, 11372. DOI: 10.1021/ja304344h (c) Saini, V.; Liao, L.; Wang, Q.; Jana, R.; Sigman, M. S. Org. Lett. 2013, 15, 5008. DOI: 10.1021/ol4023358
- Chiral ion pair的综述: (a) Phipps, R. J.; Hamilton, G. L.; Toste, F. D. Nat. Chem. 2012, 4, 603. doi:10.1038/nchem.1405 (b) Brak, K.; Jacobsen, E. N. Angew. Chem., Int. Ed. 2013, 52, 534. DOI: 10.1002/anie.201205449
- Nelson, H. M.; Williams, B. D.; Miró, J.; Toste, F. D. J. Am. Chem. Soc. 2015, 137, 3213. DOI: 10.1021/jacs.5b00344
- (a) Ohmatsu, K.; Ito, M.; Kunieda, T.; Ooi, T. Nat. Chem. 2012, 4, 473. doi:10.1038/nchem.1311 b) Ohmatsu, K.; Ito, M.; Kunieda, T.; Ooi, T. J. Am. Chem. Soc. 2013, 135, 590. DOI: 10.1021/ja312125a
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!



















No comments yet.