本文作者:杉杉
导读:
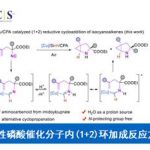
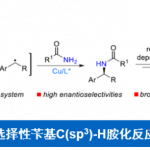
近日,浙江大学的史炳锋课题组在ACS Catal.中发表论文,报道一种全新的通过Co(III)/CCA (chiral carboxylic acid)催化体系促进的对映选择性C-H键酰胺化反应方法学,进而成功完成一系列具有硫立体生成中心的手性亚砜亚胺 (sulfoximines)分子的构建。
Catalyzed by a Single H-Bond Donor Organocatalyst Synthesis of Sulfur-Stereogenic Sulfoximines via Co(III)/Chiral
Y. Zhou, T. Zhou, P. Qian, J. Li, B. Shi, ACS Catal.2022, 12, 9806. doi: 10.1021/acscatal.2c02691.
正文:
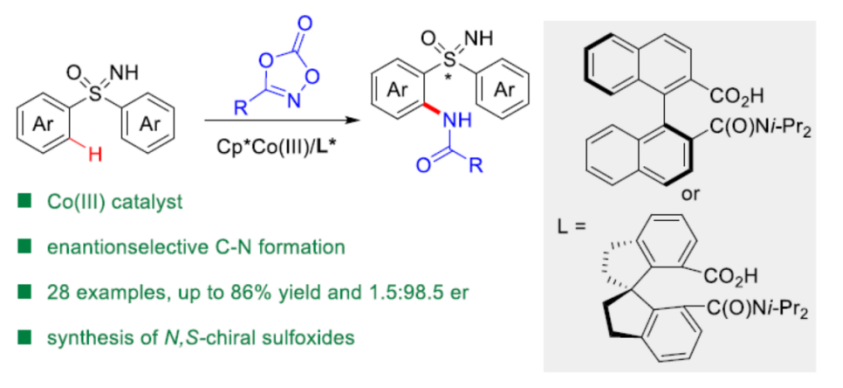
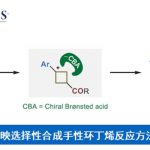
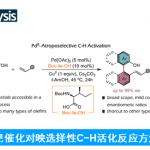
具有硫立体生成中心的亚砜亚胺分子具有良好的生物与药理活性。目前,已经成功设计出多种构建手性亚砜亚胺分子的合成转化策略[1]-[9] (Scheme 1a)。这里,受到近年来对于廉价金属催化的C-H键官能团化反应方法学[10]-[11]相关研究报道的启发,浙江大学的史炳锋团队成功设计出一种全新的采用Co(III)/CCA催化体系促进的对映选择性C-H键酰胺化反应方法学 (Scheme 1b)。
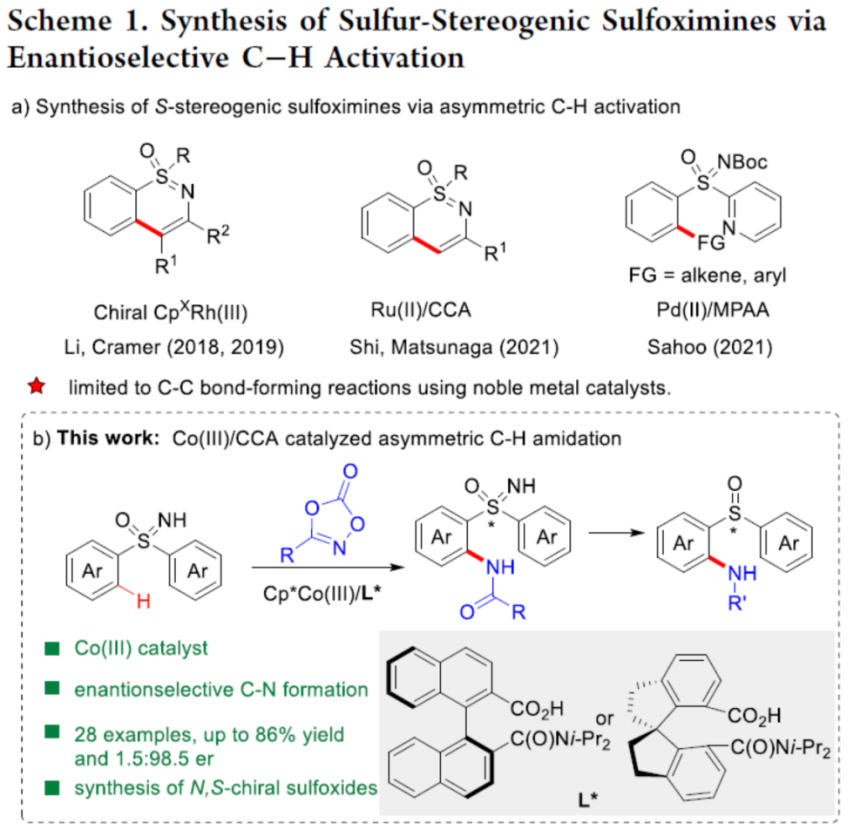
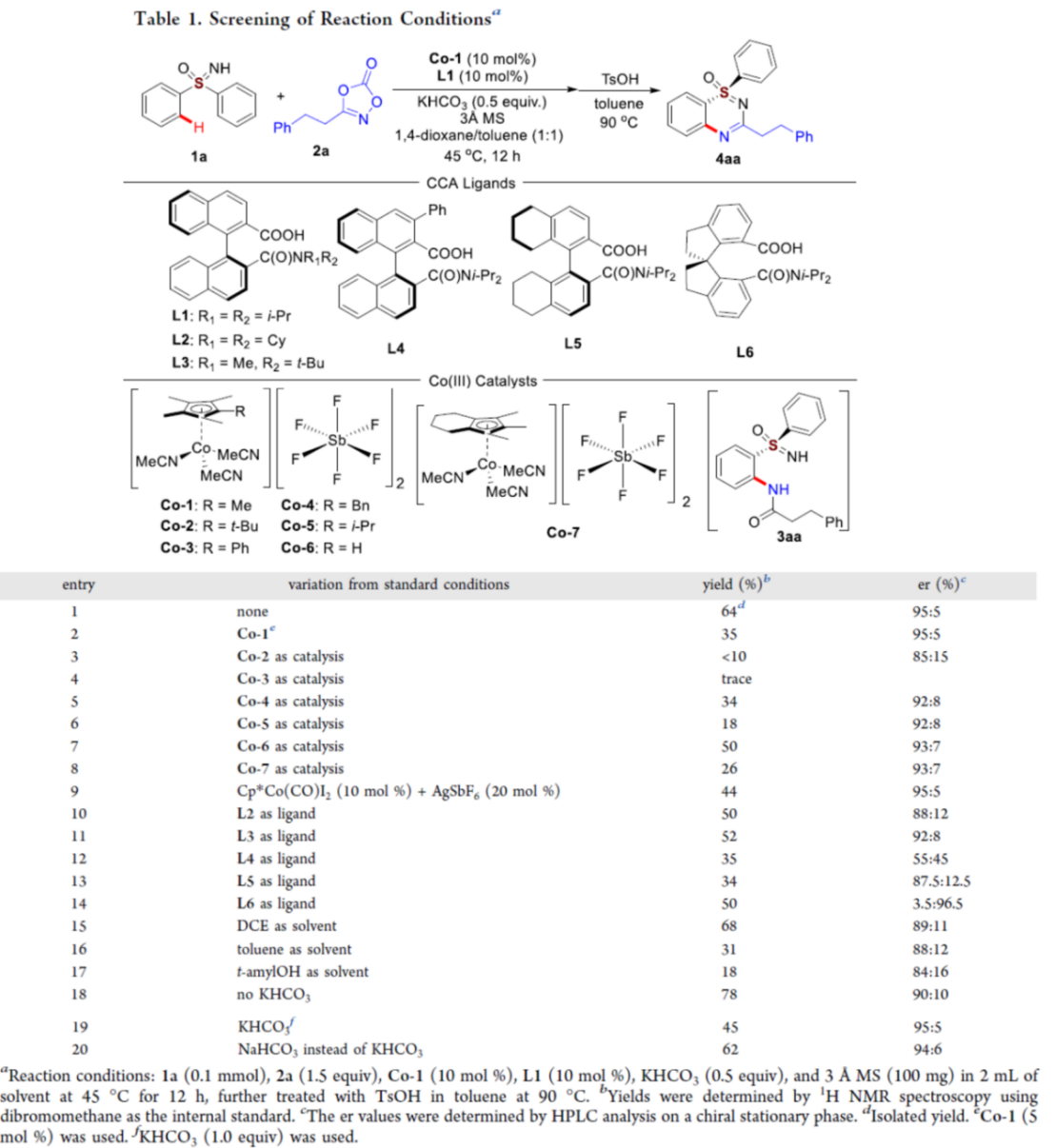
首先,作者采用亚砜亚胺衍生物1a与3-苯乙基-1,4,2-二噁唑-5-酮2a作为模型底物,进行相关反应条件的优化筛选 (Table 1)。进而确定最佳的反应条件为:采用Co-1作为催化剂,L1作为手性配体,KHCO3作为碱,3Å MS作为添加剂,在1,4-二氧六环与甲苯 (1:1 v/v)的混合反应溶剂中,反应温度为45 oC,反应进行12 h之后,再在甲苯溶剂中,反应温度为90 oC,通过TsOH促进的脱水与环化过程,进一步转化为相应的杂环产物4aa (95:5 er )。
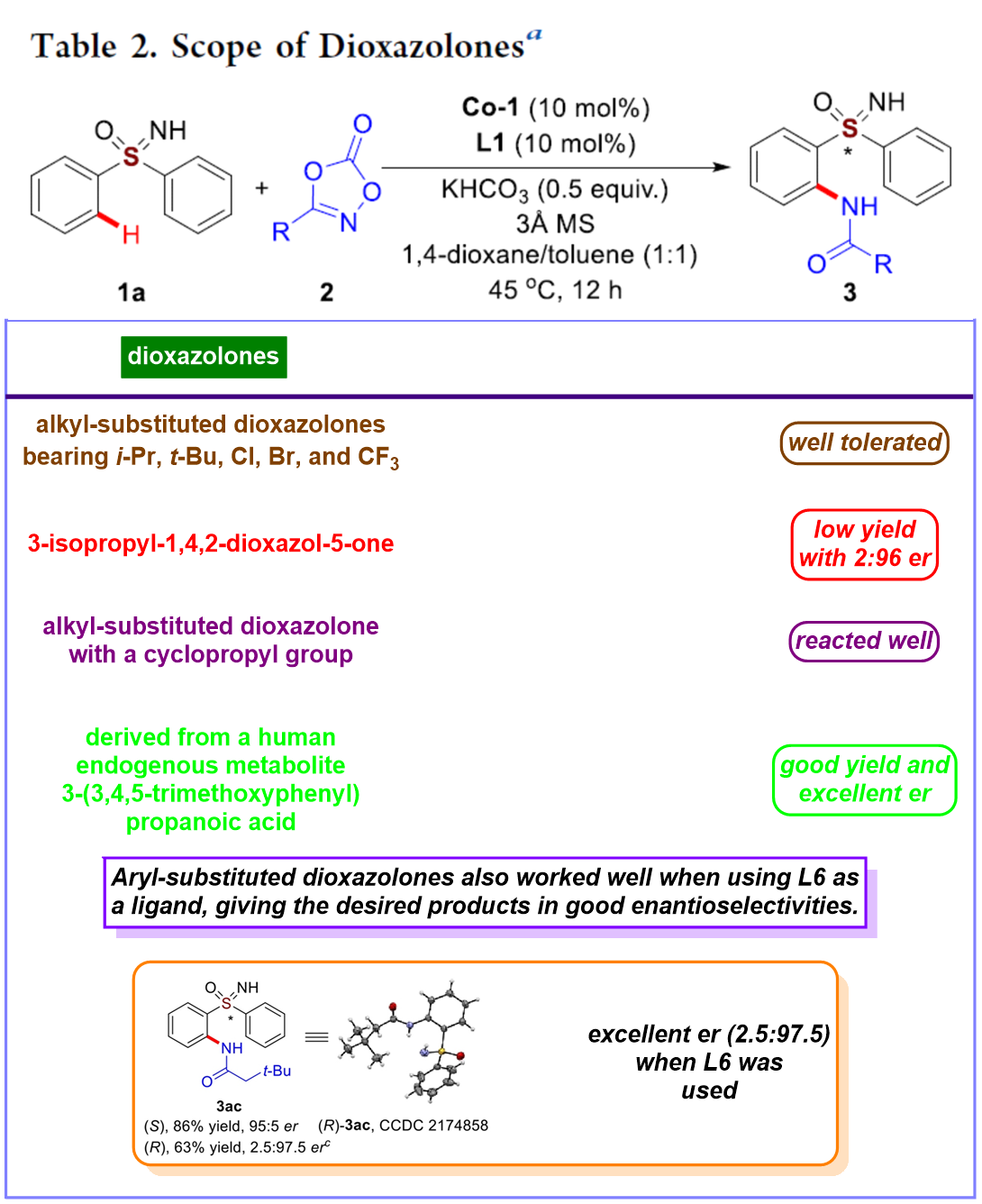
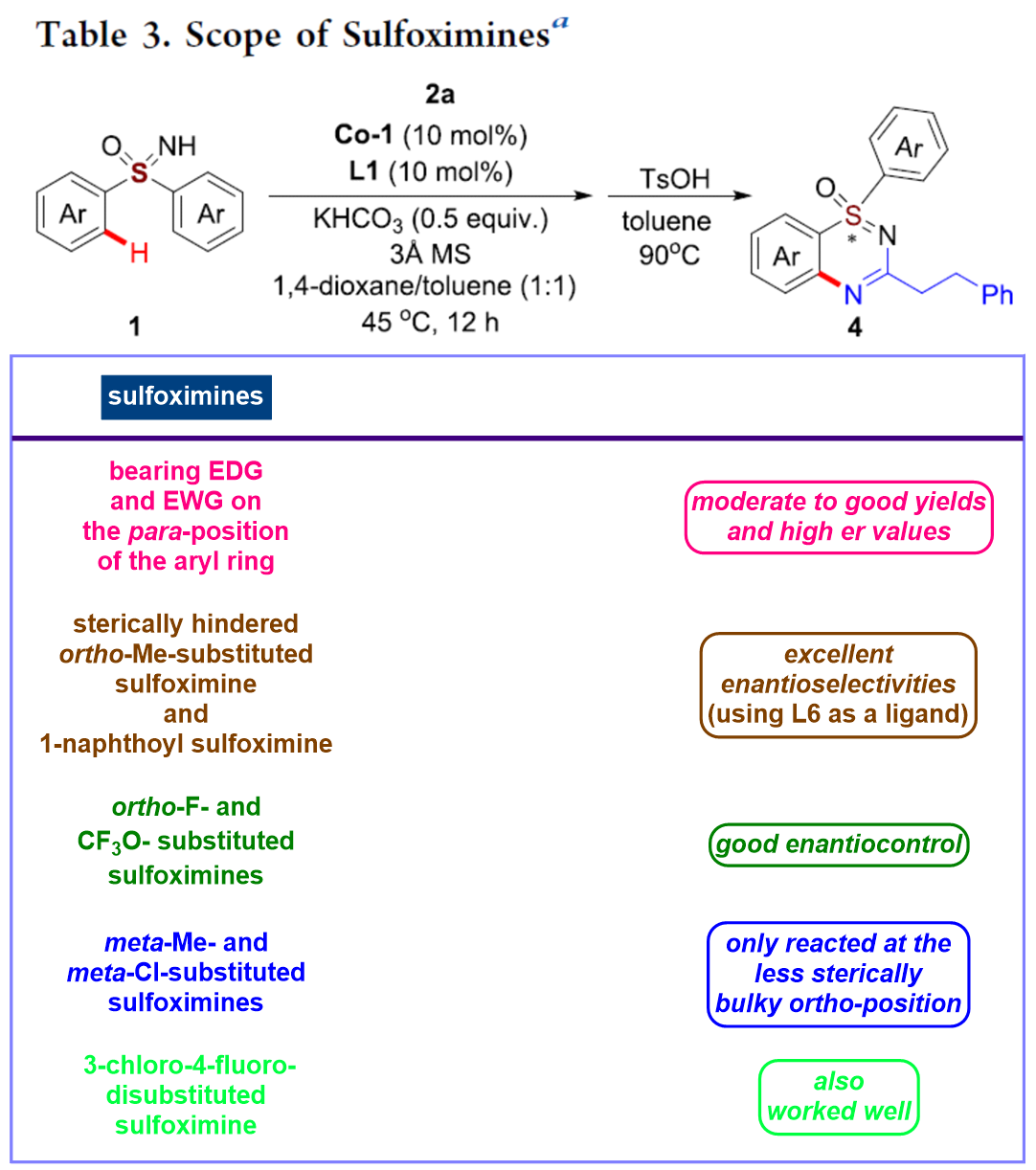
在上述的最佳反应条件下,作者分别对一系列双噁唑酮底物 (Table 2)以及亚砜亚胺底物 (Table 3)的应用范围进行深入研究。
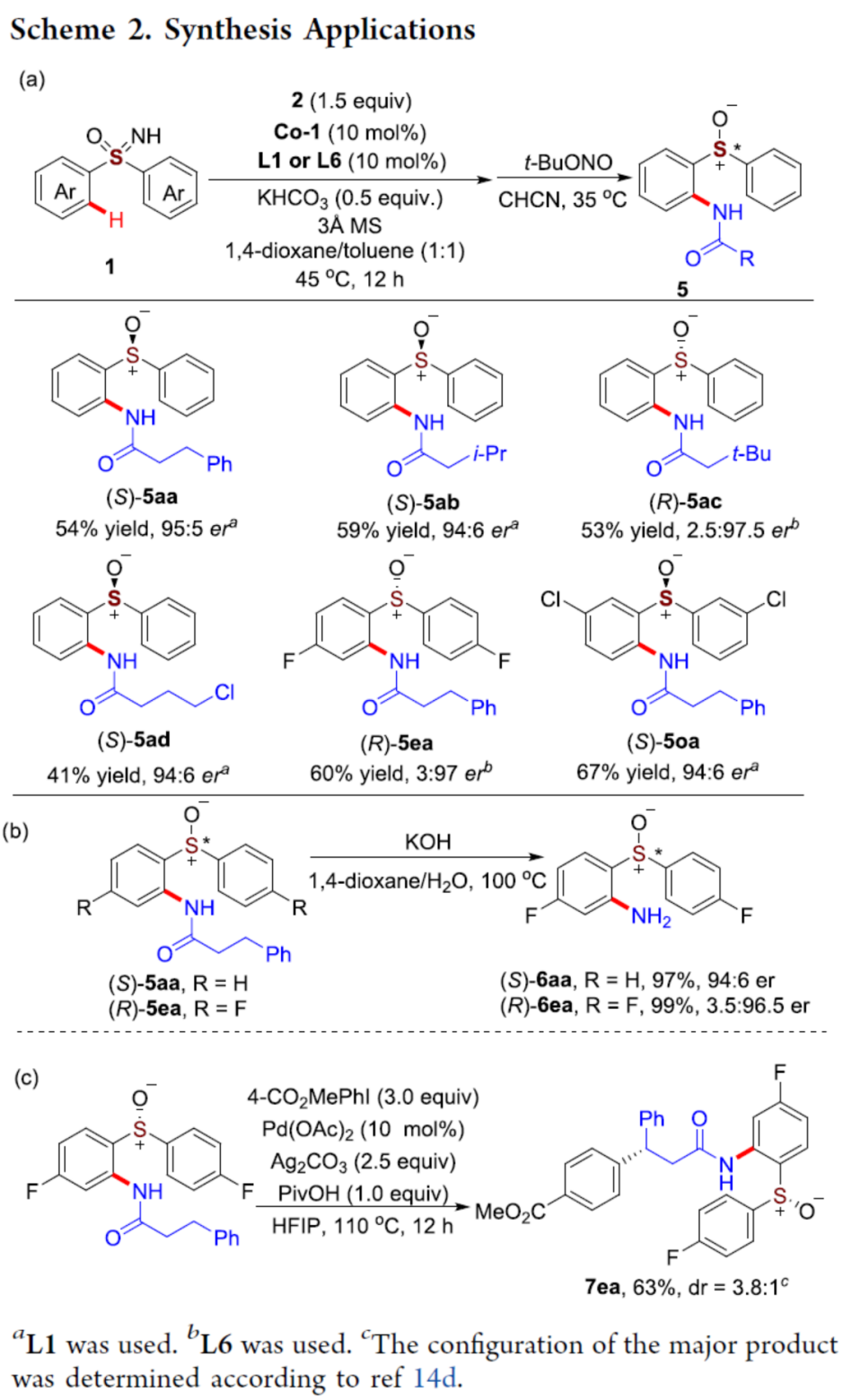
之后,该小组通过如下的一系列研究进一步表明,这一全新的对映选择性C-H酰胺化策略具有潜在的合成应用价值 (Scheme 2)。
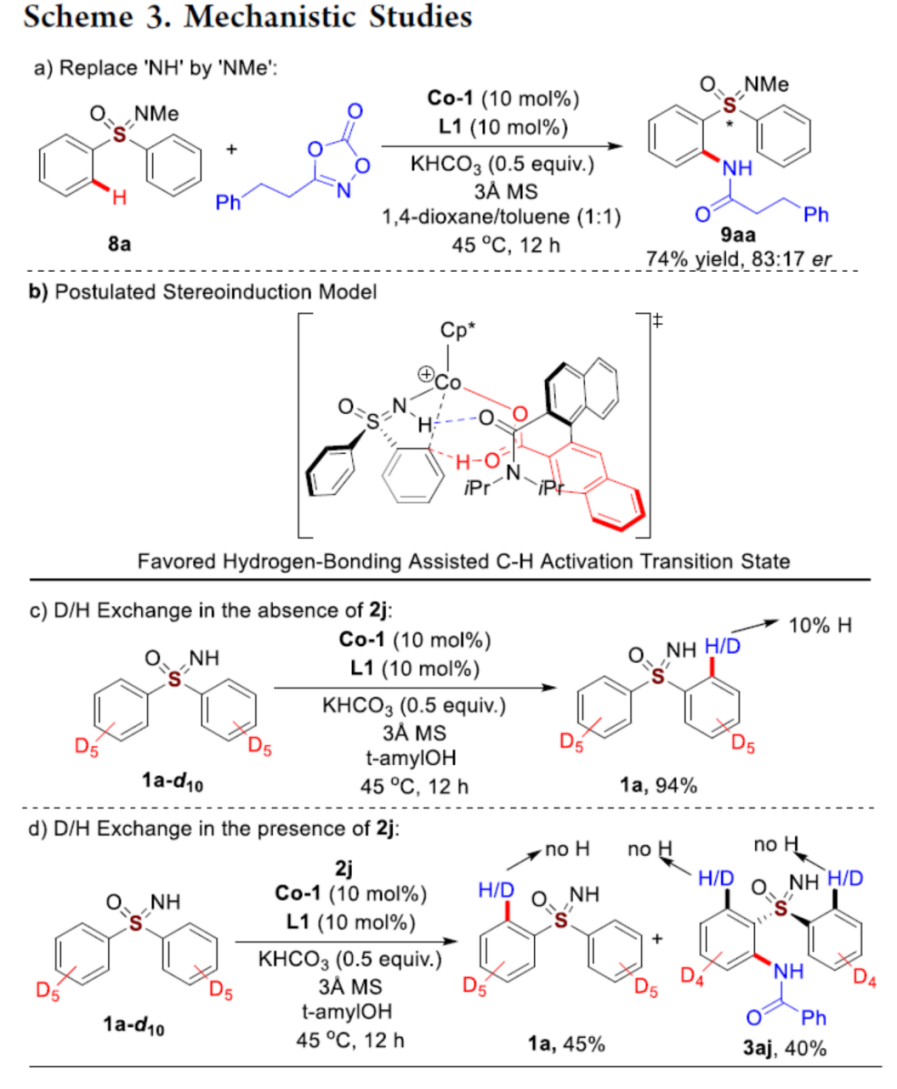
接下来,作者通过一系列实验 (Scheme 3a)研究表明,游离的NH对于上述反应过程中的对映选择性控制尤为关键。之后,作者提出一种合理的立体诱导模型 (Scheme 3b)。同时,该小组进一步通过D/H交换实验的相关研究表明,C-H键活化为可逆的反应步骤,而后续与双噁唑酮进行偶联时的反应速率显著快于相应的C-H键活化步骤 (Schemes 3c-3d)。
总结:浙江大学的史炳锋团队成功设计出一种全新的通过Co(III)/CCA催化体系促进的对映选择性C-H键酰胺化反应方法学,进而成功完成一系列具有硫立体生成中心的手性亚砜亚胺分子的构建。这一全新的对映选择性C-H键酰胺化策略具有广泛的底物应用范围、优良的官能团兼容性以及优良的对映选择性等优势。
参考文献:
- [1] E. Wojaczyńska, J. Wojaczyński, Chem. Rev. 2020, 120, 4578. doi:10.1021/acs.chemrev.0c00002.
- [2] J. Wang, M. Frings, C. Bolm, Angew. Chem., Int. Ed. 2013, 52, 8661. doi:10.1002/anie.201304451.
- [3] Y. Tang, S. J. Miller, J. Am. Chem. Soc. 2021, 143, 9230. doi:10.1021/jacs.1c04431.
- [4] S. Fang, Z. Liu, H. Zhang, J. Pan, Y. Chen, X. Ren, T. Wang, ACS Catal. 2021, 11, 13902. doi:10.1021/acscatal.1c03966.
- [5] Q. Zhang, B. Shi, Acc. Chem. Res. 2021, 54, 2750. doi:10.1021/acs.accounts.1c00168.
- [6] J. Mas-Rosello J. Herraiz, B. Audic, A. Laverny, N. Cramer, Angew. Chem., Int. Ed. 2021, 60, 13198. doi:10.1002/anie.202008166.
- [7] M. Brauns, N. Cramer, Angew. Chem., Int. Ed. 2019, 58, 8902. doi:10.1002/anie.201904543.
- [8] T. Zhou, P. Qian, J. Li, Y. Zhou, H. Li, H. Chen, B. Shi, J. Am. Chem. Soc. 2021, 143, 6810. doi:10.1021/jacs.1c03111.
- [9] K. Mukherjee, N. Grimblat, S. Sau, K. Ghosh, M. Shankar, V. Gandon, A. K. Sahoo, Chem. Sci. 2021, 12, 14863. doi:10.1039/D1SC04299H.
- [10] Y. Liu, P. Li, Q. Yao, Z. Zhang, D. Huang, M. Le, H. Song, L. Liu, B. Shi, Org. Lett. 2019, 21, 1895. doi:10.1021/acs.orglett.9b00511.
- [11] Y. Liu, P. Xie, L. Liu, J. Fan, Z. Zhang, X. Hong, B. Shi, J. Am. Chem. Soc. 2021, 143, 19112. doi:10.1021/jacs.1c08562.
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载


















No comments yet.