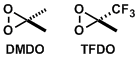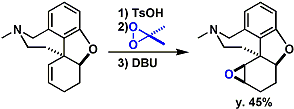- 概要
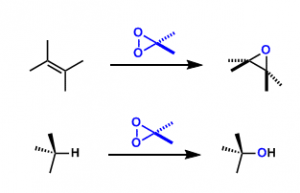
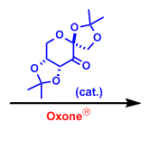
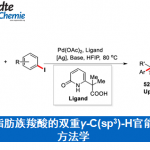
丙酮与Oxone反应配制的甲基二环氧乙烷(DMDO),可以用于烯烃的环氧化反应。另一种过氧化酮甲基三氟甲基二环氧乙烷(TFDO)的反应性是DMDO的600倍。
与mCBPA相比,该反应具有以下优点:1.反应可在中性条件下进行,2.反应中只生成丙酮副产物,后处理比较简单,3.氧化剂自身廉价易得。但是,该氧化试剂由于稳定性比较差,所以得现配现用。另外还必须在减压蒸馏的条件下配制,操作方面也比较麻烦。
对于特定的底物,可以对其中的双键进行环氧化得到环氧化物产物。
- 基本文献
- Murray, R. W.; Jayaraman, R. J. Org. Chem. 1985, 50, 2847. DOI: 10.1021/jo00216a007
- Adam, W.; Chan, Y.-Y.; Cremer, D.; Gauss, J.; Scheutzow, D.; Schindler, M. J. Org. Chem. 1987, 52, 2800. DOI: 10.1021/jo00389a029
- Mello, R.; Fiorentino, M.; Sciacovelli, O.; Curci, R. J. Org. Chem. 1988, 53, 3890. DOI:10.1021/jo00251a053
- Mello, R.; Fiorentino, M.; Fusco, C.; Curci, R. J. Am. Chem. Soc. 1989, 111, 6749. DOI:10.1021/ja00199a039
- Adam, W.; Hadjiarapoglou, L.; Nestler, B. Tetrahedron Lett. 1990, 31, 331. doi:10.1016/S0040-4039(00)94547-7
- Yang, D.; Wong, M.-K.; Yip. Y.-C. J. Org. Chem. 1995, 60, 3887. DOI: 10.1021/jo00117a046
- Frohn, M.; Wang, Z.-X.; Shi, Y. J. Org. Chem. 1998, 63, 6425. DOI: 10.1021/jo980604+
- Yang, D.; Wong, M.-K.; Wang, X. -C.; Tang, Y.-C. J. Am. Chem. Soc. 1998, 120, 6611. DOI:10.1021/ja980916u
- Ferraz, H. M. C.; Muzzi, R. M.; Vieira, T. O.; Viertler, H. Tetrahedron Lett. 2000, 41, 5021. doi:10.1016/S0040-4039(00)00769-3
<review>
- Murray, R. W. Chem Rev. 1989, 89, 1187. DOI: 10.1021/cr00095a013
- Curci, R.; Dinoi, A.; Rubino, M. F. Pure Appl. Chem. 1995, 67, 811. doi: 10.1351/pac199567050811
- Curci, R.; D’Accolti, L.; Fusco, C. Acc. Chem. Res. 2006, 39, 1. DOI: 10.1021/ar050163y
- Adam, W.; Saha-Moller, C. R.; Zhao, C.-G. Org. React. 2002, 61, 219.
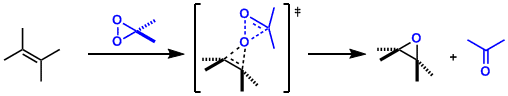
- 反应机理
- 反应实例
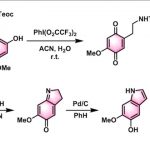
Morphine的合成[1]
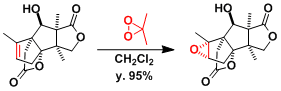
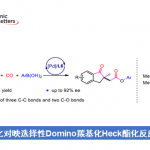
Merrilactone A的合成[2]
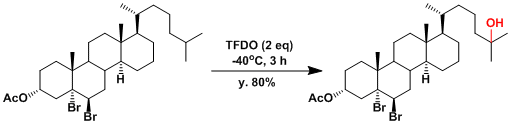
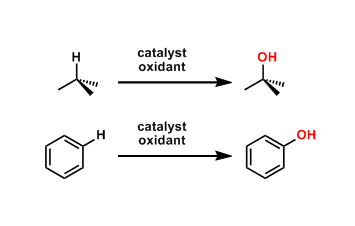
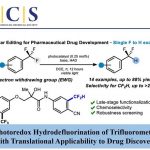
选择性C-H氧化实例[3]: 甲基的反应性比亚甲基高。
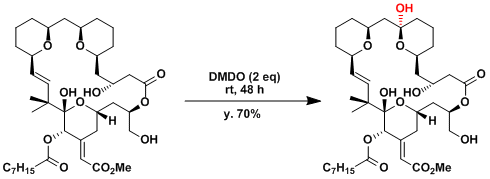
Bryostatin Analogue的合成应用[4]
- 实验步骤
甲基二环氧乙烷的配制[5a]

在装有搅拌子的三颈瓶中加入蒸馏水(120mL)、丙酮(100mL)、碳酸氢钠(45g),在冰浴下剧烈搅拌5分钟。分三次在该溶液中加入Oxone(90g),保持冰浴状态,搅拌15~20分钟。生成的DMDO通过减压蒸馏纯化获得(使用50-120 mmHg的简易泵、1-2h)。接收瓶的话需要保持在-78℃,并且在瓶中需要加入4A的分子筛以达到除水的目的。DMDO的浓度可以用茴香硫醚NMR滴定法测定。
- 实验技巧
※生成过氧化物的反应通常有爆炸的危险性,所以需要配备防爆挡板。
※DMDO具有挥发性,所以反应需要在通风橱中进行。
※由于该氧化剂的氧化反应性很强,所以绝对要避免接触到皮肤或者吸入呼吸道。所以必须得佩戴防护手套,但是不能是橡胶质地的。
- 参考文献
[2] (a) Inoue, M.; Sato, T.; Hirama, M. J. Am. Chem. Soc. 2003, 125, 10772. DOI: 10.1021/ja036587+ (b) Inoue, M.; Sato, T.; Hirama, M. Angew. Chem. Int. Ed. 2006, 45, 4843. doi:10.1002/anie.200601358 (c) Inoue, M.; Lee, N.; Kasuya, S.; Sato, T.; Hirama, M.; Moriyama, M.; Fukuyama, Y. J. Org. Chem. 2007, 72, 3065. DOI:10.1021/jo0700474
[3] (a) Bovicelli, P.; Lupattelli, P.; Mincione, E.; Prencipe, T.; Curci, R. J. Org. Chem. 1991, 57, 2182. DOI:10.1021/jo00033a053 (b) Iida, T.; Yamaguchi, T.; Nakamori, R.; Hikosaka, M.; Mano, N.; Goto, J.; Nambara, T. J. Chem. Soc. Perkin Trans. 1 2001, 2229. DOI: 10.1039/B104938K
[4] Wender, P. A.; Hilinski, M. K.; Mayweb, A, V, W, Org. Lett. 2005, 7, 79. DOI: 10.1021/ol047859w
[5] (a) Li, Y.; Tang, P.; Chen, Y.; Yu, B. J. Org. Chem. 2008, 73, 4323. DOI: 10.1021/jo8003875 (b) Murray, R. W.; Singh, M. Org. Synth. Coll. Vol. 9, 288 (1988). [website]