第一,第二,第三回小编分别为大家介绍了有机叠氮化合物的历史及性质、爆炸性、以及叠氮化试剂。从这一章开始,小编开始为大家介绍有机叠氮化合物的合成。由于反应实在太多,所以这一次先限定于芳香族叠氮化合物的合成。
同时,除了反应本身以外,小编还希望大家能记住本章中登场的很多有名的化学家,每一个反应,领域的发展都少不了那些天才开拓者们。另外,在阅读反应的时候,希望大家尤其是本科生能够一边用亲电,亲核理论考虑,一边学习。当然,还是那句话,小编总有写的不周到的地方,请各位大拿指正,尤其是有错误的地方。
如何导入叠氮:导入形式
怎样使得芳香族底物转化成芳香族叠氮化合物的?开头小编已经说过了,到目前为止,有很多很多反应已经被开发熟知,那么首先从叠氮的导入方法来分类看一下。跌但基团的导入在形式上根据导入的氮的个数不同分为以下四种。
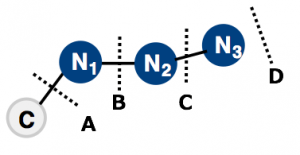
A.叠氮基N3的插入反应(取代反应)
B.重氮基N2的插入反应
C.氮原子”N”的插入反应(从肼或重氮盐转换得到)
D.三嗪衍生物的裂解反应
以上四种中,比较直观容易理解的肯定是A咯。那么,接下来就以A为主,介绍下叠氮N3的插入反应(取代反应、加成反应)。为了方便读者查阅到详细的反应,以下给出的例子中,小编尽力把原文献列出挂在了最后,有兴趣的可以翻阅原文献了解下更详细的内容。
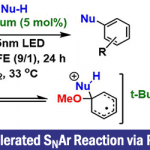
A1. 芳香族亲核置换反应: SNAr

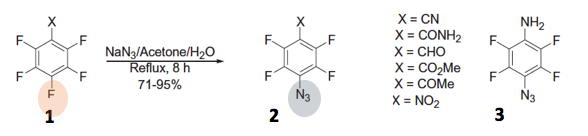
芳香族亲核取代反应是亲核性(N3–)的一种导入的形式。例如,如下图所示的例子。以五氟苯基为底物,在叠氮钠(NaN3)的作用下,其中一个氟发生了芳香族亲核取代反应得到产物2[1]。其中取代基X是酯基或者硝基的话,再经过几步就能转化成如3所示的p-叠氮四氟苯胺化合物。虽然F是离去能比较低的取代基,但是在这个芳香族亲核取代反应中,对芳香环的亲核进攻是该反应的rate-determination step。因此,电负性很高的F取代的芳香环化合物的iso位最容易受亲核进攻,因此在该反应中也作为了发生芳香环亲核取代反映的比较合适的一个取代基。
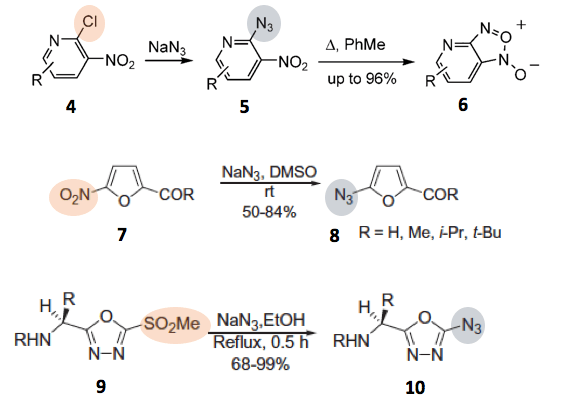
吡啶化合物4或呋喃化合物7等的杂环在取代有硝基等吸电基的时候,也会发生芳香族亲核取代反应[2]。看着有点可怕的化合物1,3,4-恶二唑化合物9作为缺电子的的杂环如果2位上是一个离去性比较好的官能团(下图中是磺酸酯基)的话,就易于发生SNAr反应。在这里可以想成「亚胺的加成・消除」反应。顺便说一句,10的合成是化学大家Woodward合成的,并且用作新的多肽合成的原料。
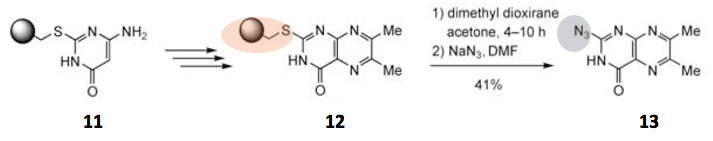
下图中稍微展示了下其应用实例。下图所示原料化合物嘧啶11に在硫醚连接处连有聚苯乙烯树脂。在转换成12后被dimethyl dioxirane氧化,转换成吸电性的砜基后,再进行SNAr反应导入叠氮基团得到目标产物13[4]。
A2. 使用有机金属进行的叠氮化反应
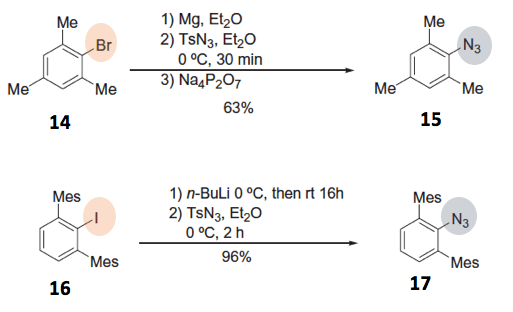
芳香族化合物首先转换成有机锂试剂或者格式试剂后,再导入叠氮的反应。在这里值得注意的是,与上述的SNAr反应不同,该反应中的芳香环是作为亲核剂,而叠氮试剂是作为亲电剂进行的反应。在上篇叠氮化试剂中小编也提到过,作为亲电的叠氮化试剂,常用的有TsN3和TfN3。对于富电子的芳香环14或16,最终转换成了高收率的叠氮化产物[5]。乍一看该反应可能是有机金属试剂进攻磺酰基,但是实际上是进攻最末端的N,形成三氮烯盐。最后切断磺酰基与N之间的键通常使用Na4P2O7,这个亲核剂的进攻位置在以后再详细描述。
杂环有机金属试剂也是同样。以18为底物与TsN3反应,首先形成上述所说的三氮烯盐19,然后加入Na4P2O7,反应得到20。苯并唑21的反应也是一样[6]。
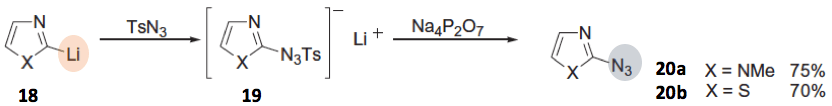
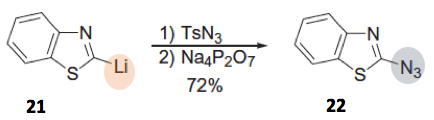
A3. 过渡金属催化的(Cu)偶联反应
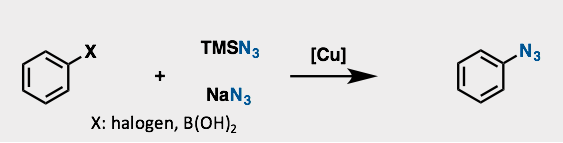
「可不可以,从经济上考虑,利用廉价稳定的叠氮化试剂(叠氮化钠等亲电叠氮化试剂),从安全,水的稳定性方面,不使用有机金属试剂,并且对一些非缺电子芳环进行叠氮化反应?」
答案当然是yes!这就是铜催化的偶联反应[7]。
例如,以卤素取代的芳香族化合物或者硼酸取代的芳环卫原料,在铜催化下与NaN3反应,就可以得到芳香环叠氮化合物。该方法对于官能团的兼容性也十分好。如下图所示的以化合物23这样的羧酸无保护的氨基酸作为底物,直接可以转换成叠氮化合物24。另外即使对于有很多个反应点底物25来说,叠氮化偶联反应最终也得到了40%左右产率的(单叠氮化的产率为80%)化合物26。
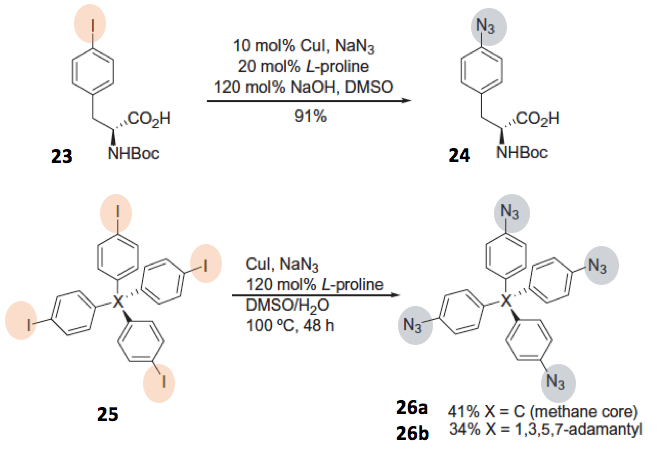
如果底物是硼酸化物的话,反应条件更温和。
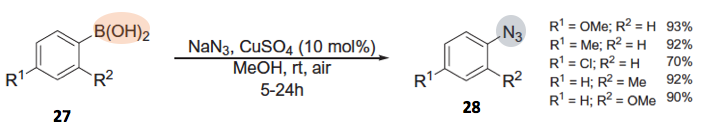
那么这类偶联反应到底是怎么进行的呢。一般的格式来说,以卤代芳烃作为底物的话,首先对铜催化剂进行氧化加成,然后叠氮化试剂亲核进攻后,还原消除得到产物,并且铜催化剂得到再生。反应中的添加的质子化试剂作为阴离子配体发挥作用。对于芳香族硼酸化合物来说,在转移金属化后,叠氮化试剂亲核进攻,最后还原消除。该类反应中由于铜催化剂氧化的需要,氧气是必须的。也就是说在这些反应中,芳香族化合物是亲电试剂,而叠氮化试剂是亲核试剂。
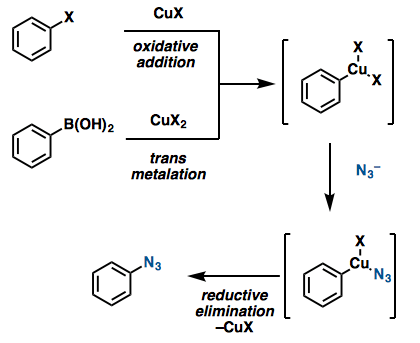
结语
在对芳香化合物导入叠氮基的时候,相比于利用不稳定,高价的N3+来说,利用廉价的N3–,也就是说叠氮化试剂是作为亲核试剂,进行芳香族的亲核取代反应是优先考虑的。
对照以上小编所介绍的三种反应大致上可以归纳为
- 底物是缺电子芳香环的情况=A1
- 富电子芳环,想在低温条件下反应=A2
- 一般的芳环,就是想比较简单的合成产物=A3
参考文献
- (a) Keana, J.F.W. Cai, S.X. J. Org. Chem. 1990, 55, 3640. DOI: 10.1021/jo00298a048 (b) Chehade, K.A.H. Spielmann, H.P. J. Org. Chem.2000, 65, 4949. DOI: 10.1021/jo000402p
- (a) Barlin, G.B. Aust. J. Chem. 1983, 36, 983. (b) Choi, P. Rees, C.W.; Smith, E.H.; Tetrahedron Lett. 1982, 23, 121. DOI: 10.1016/S0040-4039(00)97550-6
- Confalone, P.N.; Woodward, R.B, J. Am. Chem. Soc. 1983, 105, 902. DOI: 10.1021/ja00342a044
- Gibson, C.L.; La Rosa, S.; Suckling, C.J. Tetrahedron Lett. 2003, 44, 1267. DOI: 10.1016/S0040-4039(02)02782-X
- (a) Smith, P.A.S.; Rowe, C.D.; Bruner, L.B. J. Org. Chem. 1969, 34, 3430. DOI: 10.1021/jo01263a047 (b) Gavenonis, J.; Tilley, T.D. Organometallics2002, 21, 5549. DOI: 10.1021/om020509y
- Zanirato, P.; Cerini, S.; Org. Biomol. Chem. 2005, 3, 1508. DOI: 10.1039/B500634A
- (a) Zhu, W.; Ma, D. Chem. Commun. 2004, 888. DOI: 10.1039/B400878B (b) Schilling, C.I. Bräse, S. Org. Biomol. Chem. 2007, 5, 3586. DOI: 10.1039/B713792C (c) Tao, C.-Z.; Cui, X.; Li, J.; Liu, A.-X.; Liu, L.; Guo, Q.-X. Tetrahedron Lett. 2007, 48, 3525. DOI: 10.1016/j.tetlet.2007.03.107
关联书籍
Organic Azides: Syntheses and Applications
- 参考价格¥ 24,139
价格¥ 17,238(2016/11/06 20:55時点) - 出版日2010/02/01
- 商品排位239,780位
- 页码数536页
- ISBN-100470519983
- ISBN-139780470519981
- 出版社Wiley
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!






















No comments yet.