本文作者:alberto-caeiro
Matsubara教授报道了镍催化苯并噻吩衍生物C-S键断裂的去芳构化扩环反应,得到了处于热力学亚稳态,含有10电子非芳香性的苯硫平(Benzothiepines)。
背景介绍
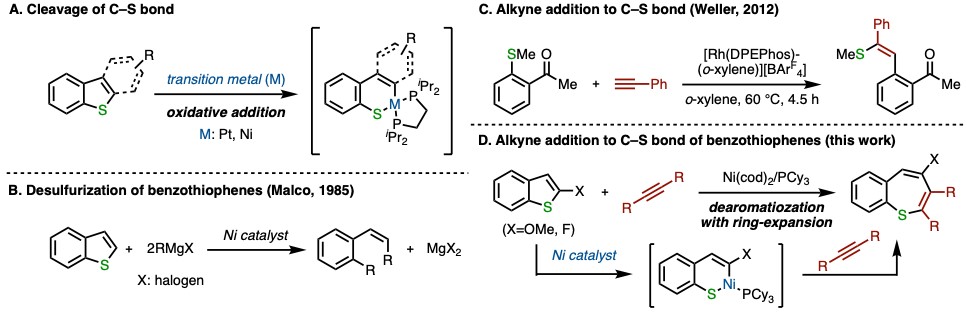
过渡金属催化的C-S键断裂反应常常用于石油化工中含硫芳香化合物的还原脱硫反应中,而作为该类反应重要的中间体,金属配合物对苯并噻吩的C(sp2)-S键插入反应是有许多报道的(图1A)[1,2],而在这些例子中S大多是以硫磺的形式脱除的(图1B)[3]。
在已发表文献中,催化剂直接对噻吩的C-S键进行切断是鲜有报道的,大多都加入了当量格氏试剂进行活化从而使金属镍催化剂能够插入噻吩C-S键(图1B)[3]。但过渡金属催化剂对苯甲硫醚的C(sp2)-S键的插入是已有报道的,如2012年Weller教授报道了使用铑催化剂可对苯甲硫醚C-S键切断后,与炔烃反应得到端位硫甲醚化产物 (图1C)[4]。
此次京都大学的Matsubara教授报道了金属镍催化的苯并噻吩衍生物C-S键断裂后内炔的环化去芳构化反应(图1D)。金属镍对苯并噻吩衍生物的C(sp2)-S键氧化加成后,与炔烃发生[5+2]环化反应后,还原消除得到产物苯硫平(Benzothiepines)。该反应为功能材料苯硫平提供了一种新的合成方法。
Nickel-Catalyzed [5+2] Cycloaddition of 10π-Electron Aromatic Benzothiophenes with Alkynes To Form Thermally Metastable 12π- Electron Nonaromatic Benzothiepines
Inami, T. Takahashi. T. Kurahashi, T. Matsubara, S.
J. Am. Chem. Soc. 2019, 141, 12541. DOI:10.1021/jacs.9b07948
作者介绍

作者:松原 誠二郎 (Matsubara Seijiro)
经历:
- 1977–1981 B.Sc. Kyoto University (Prof. Hitoshi Nozaki)
- 1981–1986 Ph.D. Kyoto University (Prof. Hitoshi Nozaki)
- 1986–1995 Assistant Professor, Kyoto University (Prof. Kiitiro Utimoto)
- 1988–1989 Postdoctoral Fellow, Stanford University (Prof. Barry M. Trost)
- 1995–2006 Associate Professor, Kyoto University (Prof. Koichiro Oshima)
- 2006– Professor, Kyoto University
论文概要
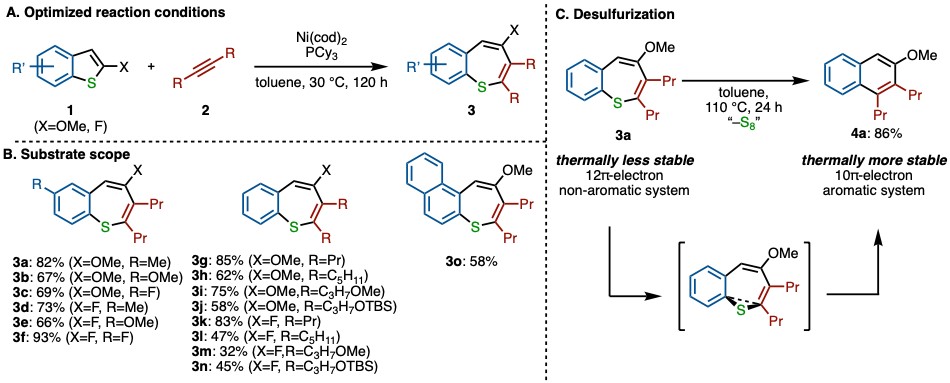
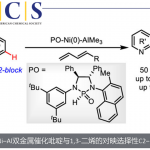
30 ℃下,Ni(cod)2作为镍源,配体为三环己基膦,溶剂为甲苯是反应的最佳条件(图2A)。苯并噻吩的2号位取代基对反应的发生有重要作用,只有为甲氧基或氟原子取代的苯并噻吩衍生物才能发生反应。当底物1的2号位取代基换为三氟甲基,甲基,酯基或没有取代时,反应都不能发生。
在苯环上的取代基则相对较多,5号位被甲基,甲氧基,氟原子,氯原子取代的底物都可反应得到苯硫平衍生物(3a-3f)(图2B)。炔烃方面,其他烷基炔如4-辛炔,6-十二炔,端位为甲氧基,OTBS的醚类炔烃都能以中等至高收率得到产物(3g-3n)。萘并噻吩衍生物也能反应(3o)。
此外,该反应得到的苯硫平衍生物可在高温下,实现无需金属参与的脱硫芳构化过程,得到芳香环产物。这解释了为什么高温下该反应无目标产物生成,只得到脱硫产物8aa。温度过高时,生成的产物脱除的硫磺可毒害催化剂,从而抑制反应的进行。镍催化的苯并噻吩与炔烃的[5+2]环化反应可在30 ℃下进行,通过延长反应时间即可得到高收率,从而使这种非芳香性亚稳态的苯硫平合成提供一种新途径。
综上所述,Matsubara教授报道了一种镍催化的苯并噻吩C-S键断裂的扩环去芳构化反应,产物苯硫平可用于功能分子。期待该方法在含硫原子环状骨架天然产物合成中的应用及苯硫平产物脱硫芳构化的应用。
参考文献
- [1] Vicic, D. A.; Jones, W. D. Deep Hydrodesulfurization in Homogeneous Solution: Access to a Transition-Metal Insertion Complex of 4,6- Dimethyldibenzothiophene. Organometallics 1998, 17, 3411. DOI:1021/om9803568;
- [2] Vicic, D. A.; Jones, W. D. Modeling the Hydrodesulfurization Reaction at Nickel. Unusual Reactivity of Dibenzothiophenes Relative to Thiophene and Benzothiophene. J. Am. Chem. Soc. 1999, 121, 7606. DOI:10.1021/ja9905997;
- [3] Tiecco, M.; Tingoli, M. Regiochemistry and Stereochemistry of Nickel- Promoted, Carbon-Carbon Bond-Forming Reactions of Cyclic Sulfur Compounds. J. Org. Chem. 1985, 50, 3828. DOI: 10.1021/jo00220a029;
- [4] Hooper J. H.; Chaplin A. B.; Gonzaĺez-Rodríguez C;Thompson A. L.;Weller A. S.;Willis M. S. Aryl Methyl Sulfides as Substrates for Rhodium-Catalyzed Alkyne Carbothiolation: Arene Functionalization with Activating Group Recycling. J. Am. Chem. Soc. 2012, 134, 2906. DOI: 10.1021/ja2108992.
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!


















No comments yet.