本文作者:杉杉
导读
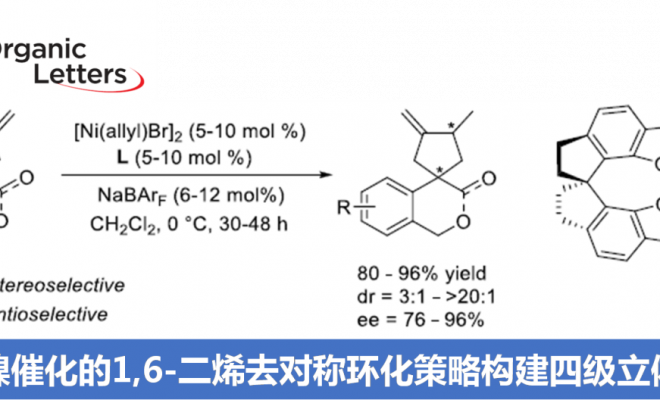
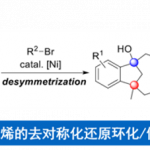
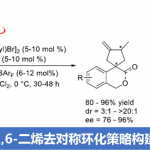
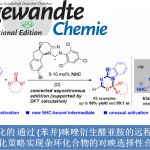
近日,南开大学周其林课题组在Org. Lett.中发表论文,报道一种在手性螺亚磷酰胺 (chiral spiro phosphoramidite)配体存在下,通过镍催化剂参与的1,6-二烯底物的高度对映与非对映选择性去对称环化 (desymmetrizing cyclization) 反应策略。通过这一策略,能够成功实现具有四级立体中心的手性螺内酯及其类似物的构建。并且,该策略具有优良的原子与步骤经济性。
Nickel-Catalyzed Desymmetrizing Cyclization of 1,6-Dienes to Construct Quaternary Stereocenters
T.Zhao, K.Li, L. Yang, S. Zhu, Q. Zhou,
Org. Lett. 2021, 23, 3814. doi: 10.1021/acs.orglett.1c00796.
正文
四级立体中心广泛存在于各类天然产物以及药物分子中。例如,在2018年美国零售额排名前120位的手性小分子药物中,约13%的相关分子中存在四级立体中心。在有机合成研究中,多数四级立体中心源自于天然产物前体 (natural product precursor)。因此,有机合成化学家长期致力于设计能够实现四级立体中心构建的相关策略。并且,已经取得较多的研究进展。迄今为止,四级立体中心的构建主要涉及如下两种策略:(1) 将碳亲核试剂加成至C=C或碳亲核试剂接直与三碳取代的正离子 (tricarbon-substituted)进行结合,(2) 通过预先构建的四级中心 (prebuilt quaternary center)参与的去对称化反应[1]。
在过去的几十年中,去对称化反应方法学在具有四级立体中心手性分子的对映选择性合成研究中备受关注[2],例如在Hajos-Parrish-Eder-Sauer-Wiechert反应中,通过预先构建的α,α-二取代1,3-二酮的去对称环化过程,进而顺利完成各类手性多环分子的合成。并且,这一策略已经广泛应用于一系列天然产物的全合成。此外,通过具有四级碳中心的小环分子的去对称开环 (desymmetric ring-opening)与扩环 (desymmetric ring- expanding)方法学,同样能够实现相应四级立体中心的构建。
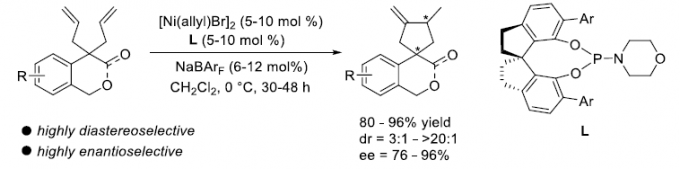
过渡金属催化的1,6-二烯不对称环化方法学为手性环戊烯分子的合成开辟出一种更为有效的反应策略 (Scheme 1a)。然而,目前,仅有一例[3]通过铑催化剂参与的1,6-二烯去对称环化反应策略,进而成功构建四级立体中心的相关文献报道 (Scheme 1b)。同时,在前期的研究中[4],本课题组曾报道采用镍催化剂促进的,通过具有N或O杂原子键合的1,6-二烯底物 ( N- or O-tethered 1,6-diene)参与的对映选择性环化过程,进而成功实现一系列六元手性杂环分子的合成。受到上述研究的启发,作者设想,能否将这一策略进一步应用于具有四级碳中心的1,6-二烯的去对称环化反应,进而完成一系列具有四级立体中心的手性螺内酯分子的构建 (Scheme 1c)。
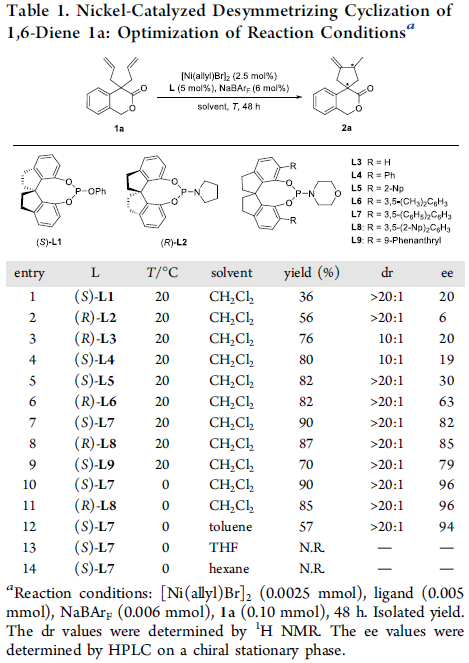
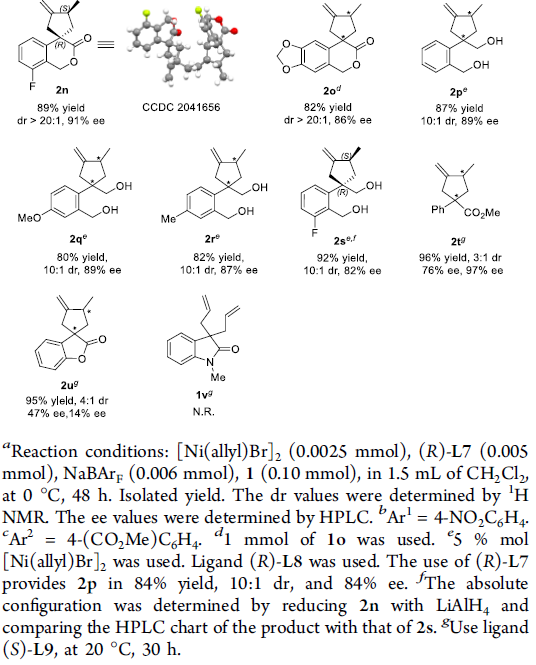
首先,作者采用异色满酮衍生的1,6-二烯 (isochromanone-derived 1,6-diene)1a作为模型底物,进行相关去对称环化反应条件的优化筛选 (Table 1)。进而确定最佳的反应条件为:采用2.5 mol% [Ni(allyl)Br]2作为催化剂,5 mol% (R)-L7作为配体,同时加入6mol%的NaBArF,在DCM溶剂中,0℃下进行反应,最终获得90%收率的产物2a,dr> 20:1,ee为96%。
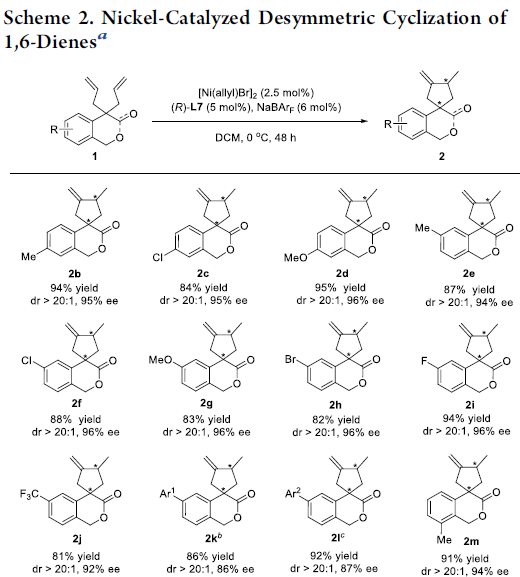
在获得上述最佳反应条件后,作者开始对上述异色满酮衍生的1,6-二烯 1的底物应用范围进行研究 (Scheme 2)。作者发现,芳环中带有吸电子基团与供电子基团取代的异色满酮衍生的1,6-二烯底物,均能够顺利地参与上述的去对称环化反应,并获得相应的螺内酯产物2b–2o,收率为81-95%,dr> 20:1,ee为86-96%,同时能够表现出优良的官能团兼容性。之后,作者进一步对于具有二醇结构单元的1,6-二烯底物进行研究,实验中,作者发现,采用L8配体代替(R)-L7配体,同样能够实现相应的去对称环化过程,并获得相应的环化产物2p–2s,dr为10:1,ee为82-89%。接下来,该小组进一步发现,对于具有酯基取代的1,6-二烯底物,则需要选择L9作为配体,最终,获得环化产物2t,收率为96%,dr为3:1,ee为76%与97%。此外,研究表明,苯并呋喃酮衍生的1,6-二烯 (benzofuranone-derived)底物同样能够顺利完成上述的去对称环化过程,并获得95%收率的产物2u,然而,却获得较低的对映选择性 (47% ee与17% ee)与中等程度的非对映选择性 (dr = 4:1)。接下来,作者进一步发现,上述的标准反应条件对于内酰胺衍生的1,6-二烯 (lactam-derived 1,6-diene)底物1v,却无法良好地进行兼容。
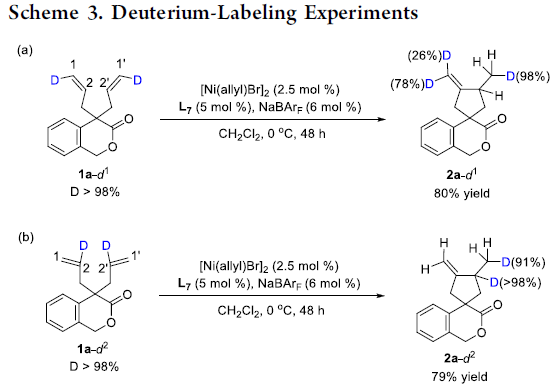
为了进一步阐明上述转化过程的反应机理,作者进行一系列相关的氘标记实验 (deuterium-labeling experiment)研究 (Scheme 3)。首先,该小组采用氘代二烯底物1a–d1与1a–d2进行相关的氘标记实验,并通过对相应产物的1H-NMR谱学分析表明,二烯1a–d1末端位置的氘原子没未发生转移 (Scheme 3a)。同时,作者观察到,二烯1a–d2中的2-氘原子则能够转移至环化产物2a–d2中的1′-位置 (Scheme 3b)。
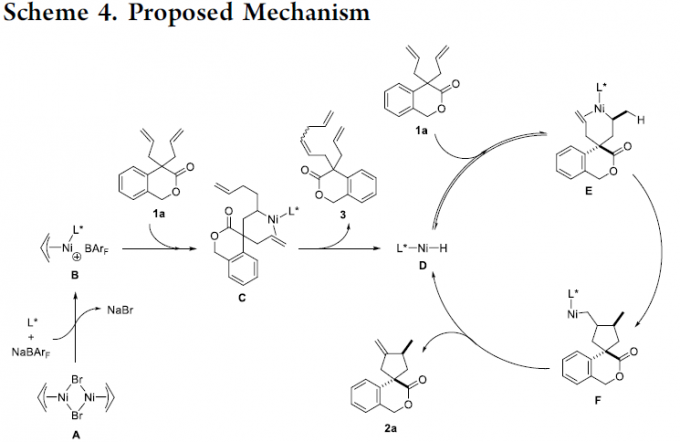
最后,作者提出一种可能的反应机理 (Scheme 4)。首先,在膦配体与NaBArF存在下,通过烯丙基溴化镍二聚体A的解离,形成烯丙基镍B。之后,通过二烯1a中C=C键向B中镍-碳键的迁移插入,形成烷基镍中间体C。接下来,中间体C经历β-H消除过程,形成Ni-H配合物D。同时,通过二烯1a中C=C键向D中Ni-H键的迁移插入过程,进一步形成烷基镍中间体E。之后,中间体E经历后续的环化过程,形成烷基镍中间体F。最后,中间体F经历后续的β-H消除步骤,获得相应的去对称环化产物2a,同时,使反应活性的Ni-H配合物D再生。
总结
南开大学周其林课题组成功设计出一种具有高度对映与非对映选择性的镍催化1,6-二烯的去对称环化反应策略,进而合成出一系列具有四级立体中心的手性螺内酯及其类似物。并且,该策略具有高度的原子与步骤经济性。
参考文献
[1] X. Zeng, Z Cao, Y. Wang, F. Zhou, J. Zhou, Chem. Rev. 2016, 116, 7330. doi: 10.1021/acs.chemrev.6b00094. [2] (a) S. Mukherjee, J. Yang, S. Hoffmann, B. List, Chem. Rev. 2007, 107, 5471. doi: 10.1021/cr0684016.(b) B. Bradshaw, J. Bonjoch, Synlett 2012, 23, 337. doi: 10.1055/s-0031-1290107.
(c) K. Aikawa, T. Okamoto, K. Mikami, J. Am. Chem. Soc. 2012, 134, 10329. doi: 10.1021/ja3032345.
(d) M. S. Manna, S. Mukherjee, Chem. Sci. 2014, 5, 1627. doi: 10.1039/C3SC53102C.
[3] (a) J. Park, K. G. M. Kou, D. K. Kim, V. M. Dong, Chem. Sci. 2015, 6, 4479. doi: 10.1039/C5SC01553G.(b) J. Park, Z. Chen, V. M. Dong, J. Am. Chem. Soc. 2016, 138, 3310. doi: 10.1021/jacs.6b01445.
[4] K. Li, M. Li, Q. Zhang, S. Zhu, Q. Zhou, J. Am. Chem. Soc. 2018, 140, 7458. doi: 10.1021/jacs.8b04703.

















No comments yet.