本文作者:杉杉
导读
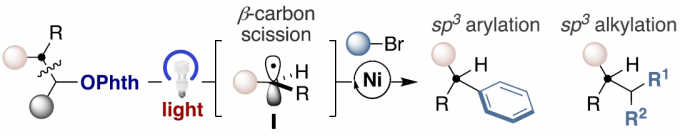
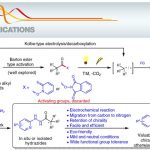
近日,西班牙加泰罗尼亚化学研究所(Institute of Chemical Research of Catalonia/ICIQ)Ruben Martin教授课题组在J. Am. Chem. Soc.发表论文,报道了通过双重催化策略,实现脂族醇衍生物与芳基(烷基)卤化物偶联反应,从而构建sp2-sp3和sp3-sp3骨架,涉及β-键断裂的过程。此外,在后期功能化过程中,该反应同样具有广泛的底物范围以及良好的适用性。
Dual Catalytic Strategy for Forging sp2-sp3 and sp3-sp3Architectures via β-Scission of Aliphatic Alcohol Derivatives
Fei Cong, Xin-Yang Lv, Craig S. Day, and Ruben Martin*J.Am. Chem. Soc.2020, 142, 20594-20599. DOI:10.1021/jacs.0c11172
正文
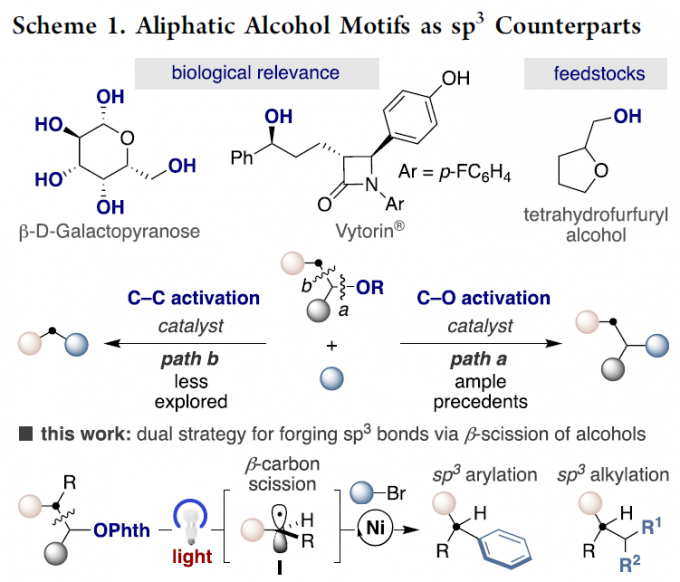
金属催化交叉偶联反应作为直接构建sp3体系的有效策略,可以增加结构的多样性。目前,这些策略主要依赖于目标sp3位点的预功能化,如有机金属、有机卤化物或C-O/C-N亲电试剂等。虽然已成功实现未官能化的sp3 C-H或C-C键的构建,但由于其共价性质和方向性,sp3 C-C键的活化仍然存在一定的问题。近年来,脂族醇固有的sp3键可进行各种策略的设计,如通过sp3 C-O活化(Scheme 1, path a)。相比之下,通过β-键(C-C键)的断裂,将未活化脂族醇用作sp3合成子,从而实现C-C键的构建,却很少被研究(path b)。在此,西班牙加泰罗尼亚化学研究所Ruben Martin教授课题组报道了通过双重催化策略,经β-键断裂的过程(涉及关键的中间体I),从而实现脂族醇衍生物与芳基(烷基)卤化物偶联反应,成功构建sp2-sp3和sp3-sp3体系。
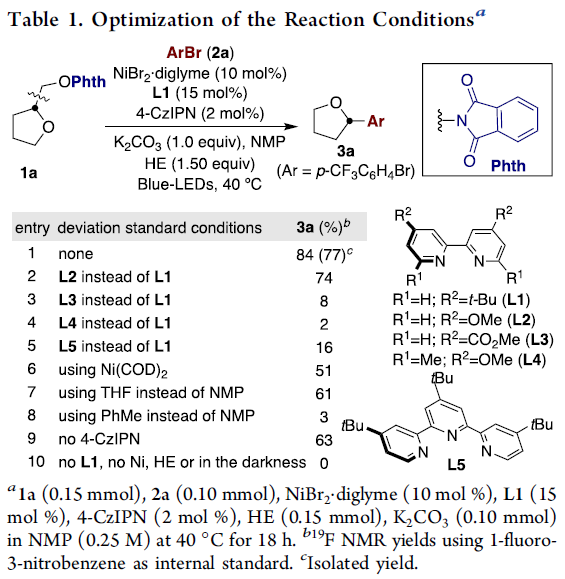
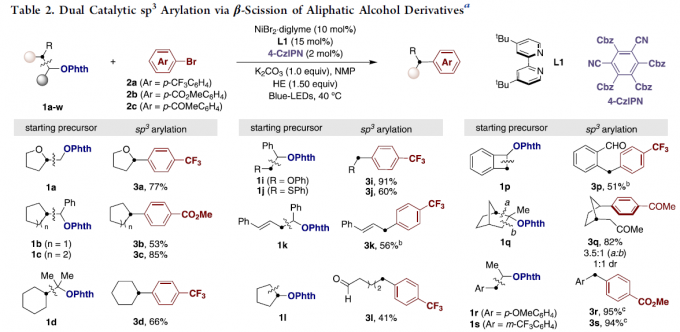
首先,作者以1a和2a作为模型底物,进行了相关芳基化反应条件的筛选(Table 1)。反应的最佳条件为:在Hantzsch酯(HE)存在下,以NiBr2·diglyme (10 mol %)为催化剂,4-CzIPN(2 mol %)为光催化剂,L1(15 mol %)为配体,K2CO3为碱,于NMP溶剂中蓝色发光二极管(LED)照射下40 ℃反应,即可获得77%收率的目标产物3a。
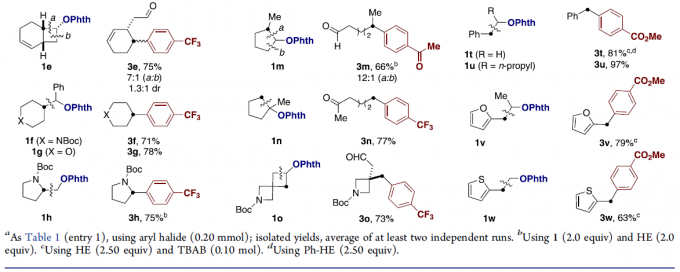
在获得上述最佳反应条件后,作者开始对底物1a-1w进行了扩展(Table 2)。对于不同伯、仲和叔基取代的醚底物,均可顺利进行β-断裂/sp3芳基化反应,获得相应的产物3a–3w。其中,不同环状醇底物可通过开环芳基化生成相应的脂肪族羰基化合物(3e,31–3q)。同时,富电子的呋喃(3v)或噻吩(3w)取代基不会干扰C-C键的形成。
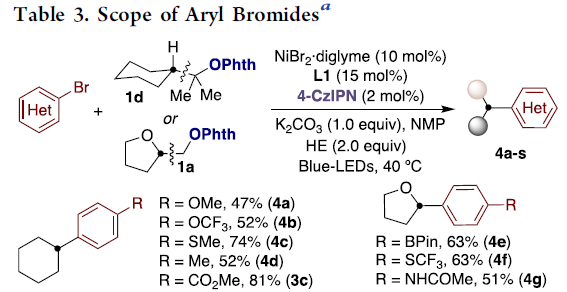
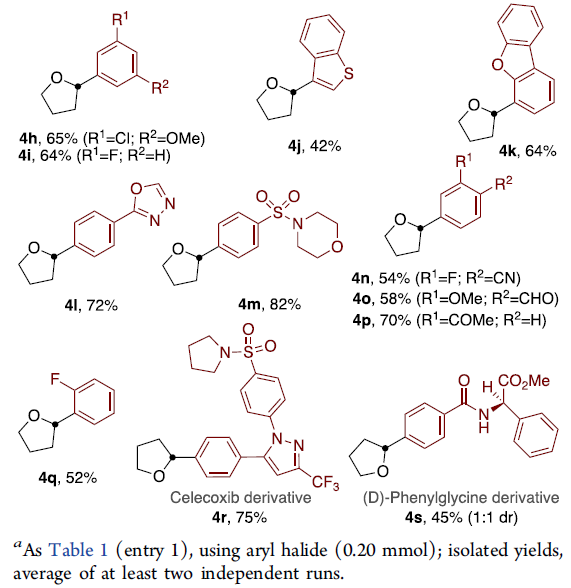
紧接着,作者对芳基卤化物的范围进行了扩展(Table 3)。反应结果表明,芳烃取代不受电子效应和定位效应的影响,均可获得相应的产物4a–4i,4l–4q。值得注意的是,缺电子的底物通常收率更高。同时,具有酮(4p)、腈(4n),磺酰胺(4m,4r)、酰胺(4g,4s)、酯(3c,4s)或醛(4o)取代基时均可耐受。并且,含硫、氧或氮杂环同样可顺利反应(4j,4k,4l,4r)。此外,含有硼酸酯(4e)和卤代芳基(4h,4i,4n,4q)的底物,都与体系相容,为进一步交叉偶联反应提供了多种可能。而以药物塞来昔布(4r)或苯基甘氨酸衍生物(4s)为底物,同样取得了预期的结果,进一步证明了反应的实用性。
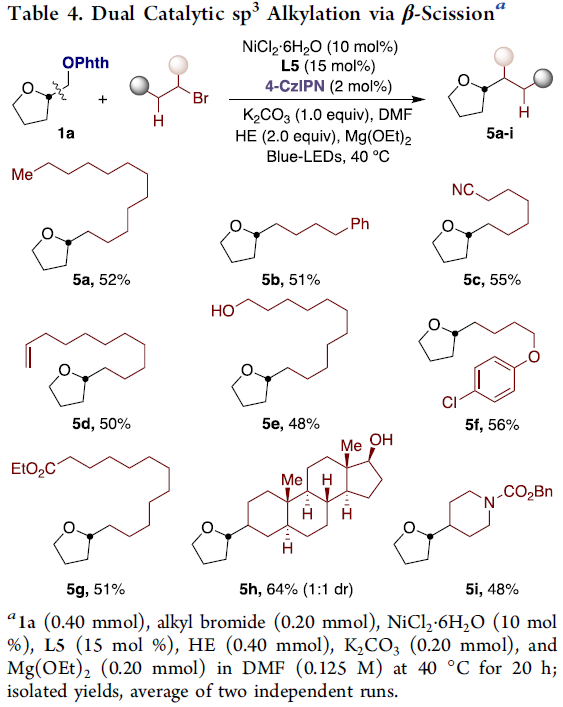
受上述构建sp2-sp3结果的鼓舞,作者对sp3-sp3键的构建进行了研究。使用上述的Ni/L1体系未能实现相应的转化,因此作者再次进行了筛选,当使用Ni/L5体系时,可实现sp3-sp3键的构建。紧接着,作者对烷基卤化物底物范围进行了扩展(Table 4)。反应结果表明,具有腈(5c)、烯烃(5d)、脂族醇(5e,5h)、酯(5g,5i)或芳基卤化物(5f)的未活化烷基卤化物,均可顺利进行反应。
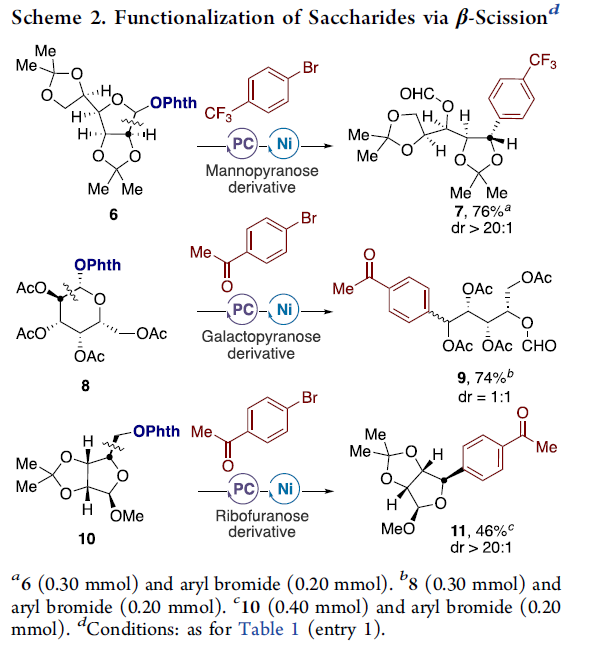
为了进一步证明反应的实用性,作者选择了糖类化合物(6,8和10)进行相关β-断裂/sp2-sp3键的构建,从而获得具有高非对映选择性的官能化产物7、9和11(Scheme 2)。
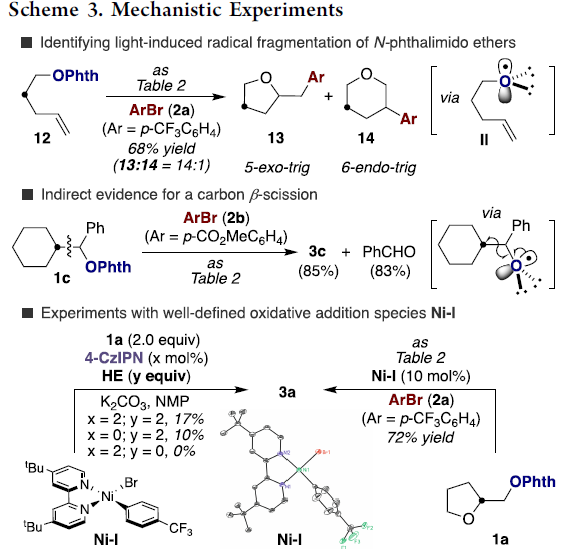
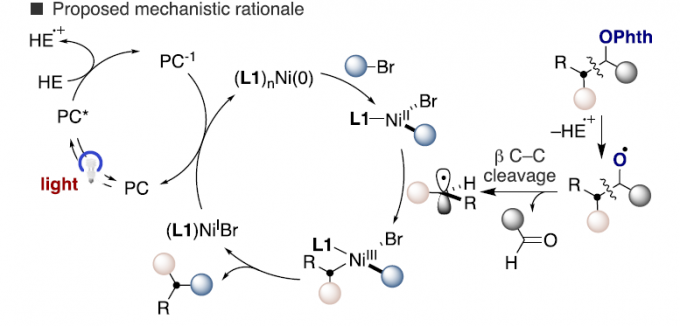
为了进一步了解反应的机理,作者进行了相关的对照实验(Scheme 3)。首先,12于标准条件下反应,获得产物13和14(比例为14:1),表明从原位产生的氧中心自由基中间体II经5-exo-trig或6-endo-trig环化形成产物。其次,1c与2b反应时,生成苯甲醛(83%),从而间接证实了从II型自由基到烷基自由基中间体的β-断裂。同时,使用不同当量的HE,对反应的收率也产生一定的影响。Ni-I与2a反应,可生成72%收率的3a,说明Ni-1可以作为反应中间体发挥催化作用。根据上述结果,作者提出了一种双重催化的机理。首先,通过β-断裂生成烷基自由基中间体以及醛副产物。随后,与烷基自由基中间体与Ni(II)配合物进行氧化加成,形成Ni(III)配合物,经还原消除即可获得目标产物以及(L1)NIBr(通过光催化剂,可实现催化循环的过程,形成(L1)nNi(0)。
总结
西班牙加泰罗尼亚化学研究所Ruben Martin教授课题组报道了一种双重催化策略,实现脂族醇衍生物与芳基(烷基)卤化物偶联反应,从而构建sp2-sp3和sp3-sp3体系,涉及β-键断裂的过程。同时,该反应具有广泛的底物范围,尤其是具有硼酸酯和卤代芳基的底物,为进一步偶联反应提供了多种可能。此外,药物分子以及糖类化合物均作为有效的底物,进一步证明了反应的实用性。
















No comments yet.