本文作者:杉杉
导读
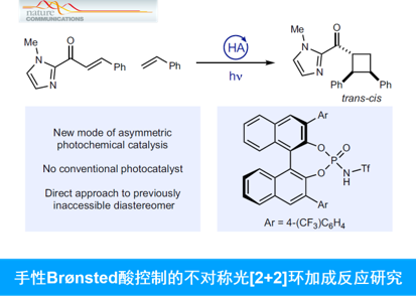
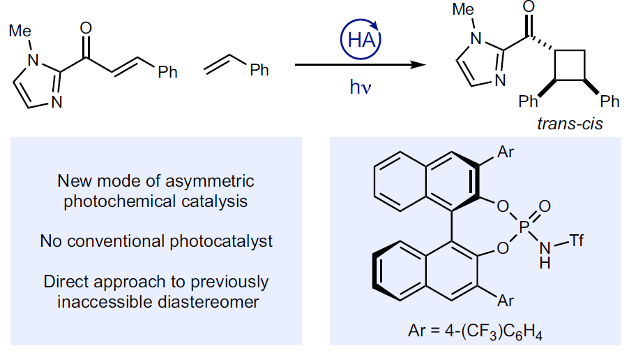
近日,Wisconsin大学的T. P. Yoon与KAIST (Korea Advanced Institute of Science and Technology)的M.-H. Baik团队在Nat. Commun.中发表论文,共同报道一种全新的通过手性Brønsted酸控制的高度对映与非对映选择性的光[2+2]环加成反应方法学。这一全新的对映选择性光[2+2]环加成策略中,形成的环丁烷产物具有trans–cis立体化学,进而与其他对映选择性催化的光[2+2]环加成方法学相关的研究报道形成有力的互补。
Chiral Brønsted acid-controlled intermolecular asymmetric [2+2] photocycloadditions
E. M. Sherbrook, M. J. Genzink, B. Park, I. A. Guzei, M.-H. Baik, T. P. Yoon
Nat. Commun. 2021, ASAP. Doi:10.1038/s41467-021-25878-9.
正文
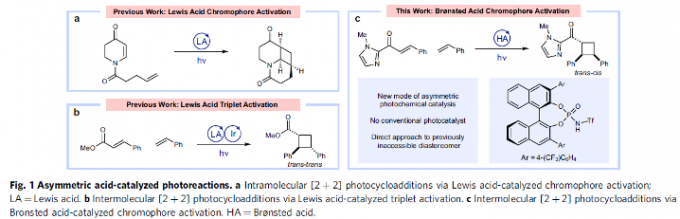
设计高度对映选择性的合成转化策略,在现代合成化学的研究中备受广泛关注。然而,通过光化学策略进行的对映选择性合成设计,则面临诸多挑战[1]-[2](Fig. 1)。受到前期对于Brønsted酸在不对称合成转化策略中的应用[4]-[6]以及近期对于对映选择性[2+2]光环加成反应[7]相关研究的启发,这里,T. P. Yoon与M.-H. Baik团队共同报道一种全新的通过 BINOL衍生的手性磷酰胺Brønsted酸促进的对映与非对映选择性光[2+2]环加成反应方法学 (Fig. 1)。同时,通过光谱与计算化学的相关研究表明,这一全新的催化环加成过程涉及发色团活化原理 (principle of chromophore activation )。
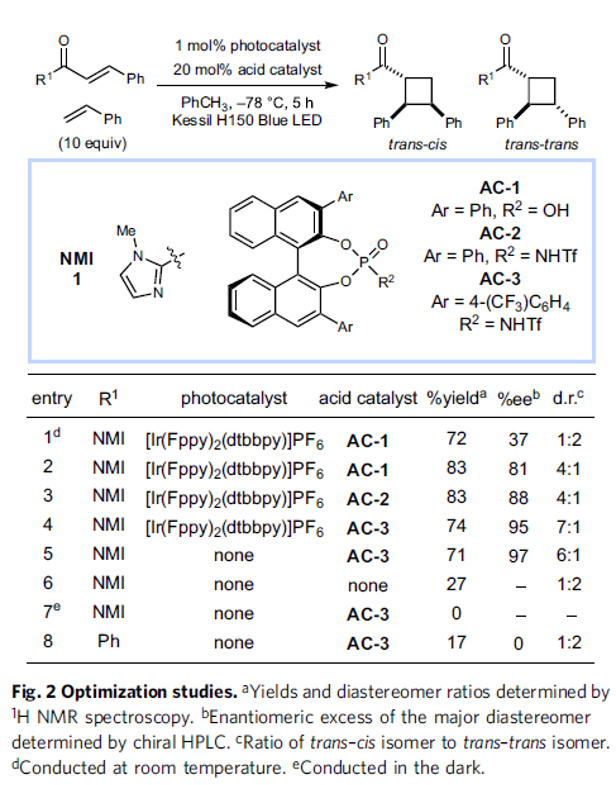
首先,作者采用苯乙烯与烯酮衍生物1作为模型底物,进行相关反应条件的优化筛选 (Fig. 2)。确定最佳的反应条件为:采用[Ir(Fppy)2(dtbbpy)]PF6作为光催化剂,AC-3作为手性Brønsted酸催化剂,通过Kessil H150 Blue LED辐射,甲苯作为反应溶剂,反应温度为-78oC,最终获得74%收率的环加成产物 (7:1d.r.,95% ee)。
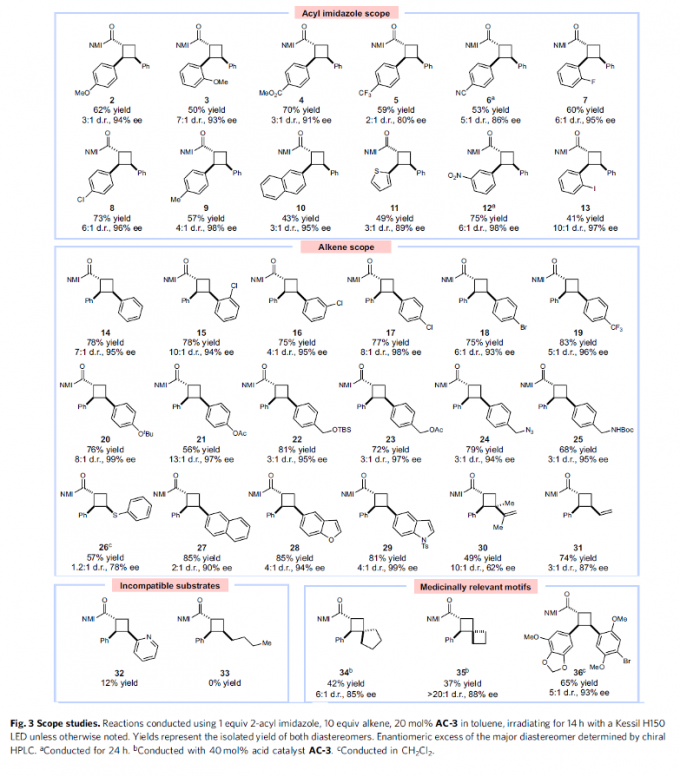
在上述的最佳反应条件下,作者首先对各类α,β-不饱和羰基底物的应用范围进行考察 (Fig. 3)。研究表明,一系列具有供电子与吸电子基团取代的β-芳基α,β-不饱和羰基底物,均能够较好地与上述的标准反应条件兼容,并以良好的反应收率与对映以及非对映选择性,获得相应的手性产物2-9。并且,作者发现,对于萘基、噻吩基取代的底物,同样能够顺利地完成上述的环加成过程,并获得相应的手性产物10与11。同时,这一全新的对映选择性环加成策略对于硝基芳烃 (12)以及芳基碘 (13)底物,同样能够有效地兼容。
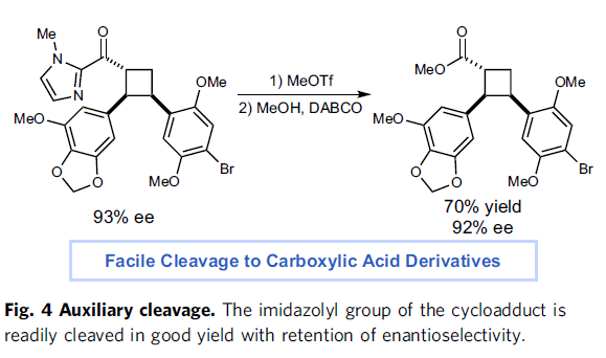
之后,该小组进一步对各类烯基底物的应用范围进行深入研究。作者发现,苯环中有不同供电子与吸电子基团取代的苯乙烯底物,均能够顺利地完成上述的不对称环加成过程,并获得相应的手性产物14–25。同时,上述的标准反应条件对于杂芳基取代的芳乙烯、取代以及未取代的二烯底物,同样能够有效地兼容 (28–31)。 然而,研究发现,能够与手性催化剂进行配位的芳乙烯底物,通常表现出较低的反应活性 (32)。同时,上述的标准反应体系,对于脂肪族环外烯基底物 (34–35),同样能够获得中等收率与良好对映选择性的环加成产物。之后,作者进一步发现,上述的标准反应条件对于高度官能团化的芳基乙烯与α,β-不饱和羰基底物,同样能够高度的对映选择性地获得相应的目标产物36,并能够通过咪唑基团的去除,进一步转化为其他类型的手性砌块 (Fig. 4)。
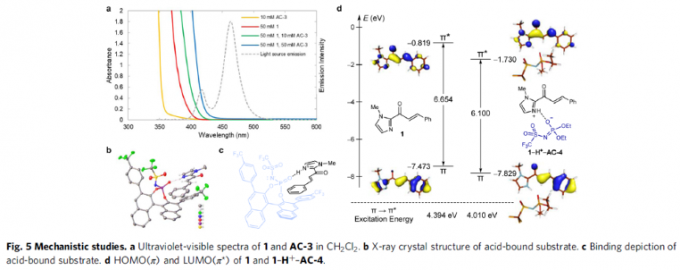
接下来,作者通过UV-Vis光谱 (Fig. 5a)证实,Brønsted酸在环加成反应过程中,并非作为常规的三线态光敏化剂。同时,作者进一步通过NMR滴定实验 (NMR titration experiment),计算出相应的结合常数Ka = 7.5×106 (Supplementary Fig. 5)。之后,作者进一步分离出相应的底物-酸配合物 (substrate-acid complex),并通过X-射线晶体学分析,确定其结构 (Fig. 5b-c),进而进一步阐明上述环加成过程中,相关对映选择性的控制因素。
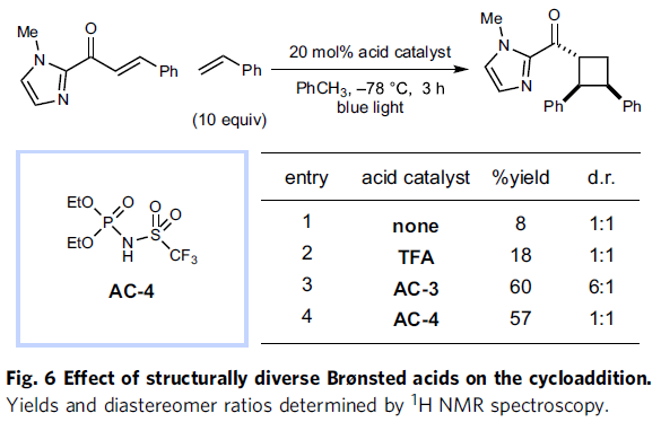
基于上述的实验研究,作者提出通过底物-酸配合物中对于相关底物的活化,存在两种可能的活化模式,即生色团活化机理 (chromophore activation mechanism)与电子供体-受体机理。最终,作者通过对各类酸催化剂促进的光环加成过程中反应收率的相关研究 (Fig. 6)进一步证实,反应过程中涉及生色团活化机理。之后,作者通过DFT与TDDFT (time-dependent DFT)计算,对这一机理的起源进行深入研究 (Fig. 5d)。
总结
T. P. Yoon与M.-H. Baik研究团队共同设计出一种全新的通过手性Brønsted酸控制的具有高度对映与非对映选择性的光[2+2]环加成反应方法学。这一全新的环加成策略具有高度的对映选择性控制、广泛的底物应用范围以及良好的官能团兼容性等优势。
参考文献
- [1] (a) H. A. Rau, Chem. Rev. 1983, 83, 535. doi: 10.1021/cr00057a003. (b) Y. Inoue, Chem. Rev. 1992, 92,741. doi: 10.1021/cr00013a001.
- [2] (a) R. Brimioulle, T. Bach, Science 2013, 342, 840. doi: 10.1126/science.1244809. (b) C. Brenninger, J. D. Jolliffe, T. Bach, Angew. Chem. Int. Ed. 2018, 57, 14338. doi: 10.1002/anie.201804006.
- [3] (a) T. R. Blum, Z. D. Miller, D. M. Bates, I. A. Guzei, T. P. Yoon, Science 2016, 354, 1391. doi:10.1126/science.aai8228. (b) Z. D. Miller, B. J. Lee, T. P. E. Yoon, Angew. Chem. Int. Ed. 2017, 56, 11891. doi: 10.1002/anie.201706975.
- [4] (a) A. Erkkilä, , I. Majander, & P. M. Pihko, Chem. Rev. 2007, 107, 5416. doi: 10.1021/cr068388p. (b) S. Mukherjee, J. W. Yang, S. Hoffmann, B. List, Chem. Rev. 2007, 107, 5471. doi: 10.1021/cr0684016
- [5] R. Takagi, C. Tabuchi, Org. Biomol. Chem. 2020, 18, 9261. doi: 10.1039/D0OB02054K.
- [6] N. Vallavoju, S. Selvakumar, S. Jockusch, M. P. Sibi, J. Sivaguru, Angew. Chem. Int. Ed. 2014, 53, 5604. doi:10.1002/anie.201310940.
- [7] F. M. Hörmann, T. S. Chung, E. Rodriguez, M. Jakob, Angew. Chem. Int. Ed. 2018, 57, 827. doi:10.1002/anie.201710441.
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载




















No comments yet.