课题的提出
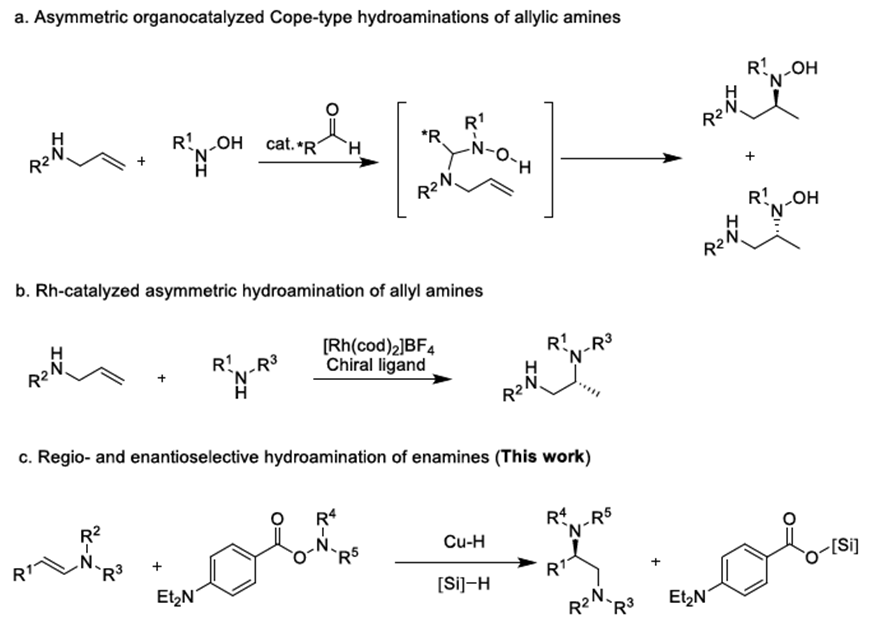
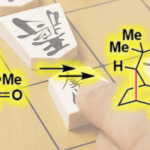
氢胺化反应是一类形式上将N-H键加成到烯烃或炔烃的碳碳不饱和键上,直接形成C-N键的反应。通过氢胺化反应能迅速得到烷基胺或烯胺产物,所以该反应受到研究团体的广泛关注。手性1,2-二胺结构广泛存在于天然产物、具有活性的化合物、催化剂和配体中。尽管1,2-二胺化合物的合成已经取得了不错的进展,但直接合成手性1,2-二胺化合物仍然面临巨大挑战[1]。氢胺化反应似乎是化解该困境的一个突破口。据文献调研,到目前为止,关于氢胺化反应合成手性1,2-二胺化合物的报道只有手性醛催化烯丙基胺的不对称氢胺化反应[2]和手性Rh催化剂催化烯丙基胺的不对称氢胺化反应这两例报道[3](Scheme 1)。
Scheme 1. 不对称氢胺化反应
基于上述背景研究,瑞典隆德大学Peter Somfai课题组报道了Cu催化烯胺的不对称氢胺化反应,能以良好的收率和较高的对映选择性得到手性1,2-二胺化合物。相关研究成果发表于
Regio- and Enantioselective Formal Hydroamination of Enamines for the Synthesis of 1,2-Diamines
Yu,L.; Somfai, P.* Angew. Chem. Int. Ed. 2019, early view DOI: 10.1002/anie.201902642
论文作者介绍:
研究者:Peter Somfai
研究者经历
- 1960年出生于Göteborg, Sweden,并在Chalmers Institute of Technology获得化学硕士学位和有机化学博士学位;
- 1999年,Royal Institute of Technology(KTH)有机化学教授;
- 2001年,Royal Institute of Technology(KTH)化学系主任;
- 2005年,Royal Institute of Technology(KTH)化学科学与工程学院院长;
- 2007年,Institute of Technology, University of Tartu高级研究员;
- 2010年,Royal Swedish Academy of Sciences成员;
- 2012年,Royal Swedish Academy of Sciences有机化学教授;
- 2015年,Royal Physiografiphic Society of Lund成员。
研究内容:开发有机合成的新方法以及天然产物的全合成。
论文概要
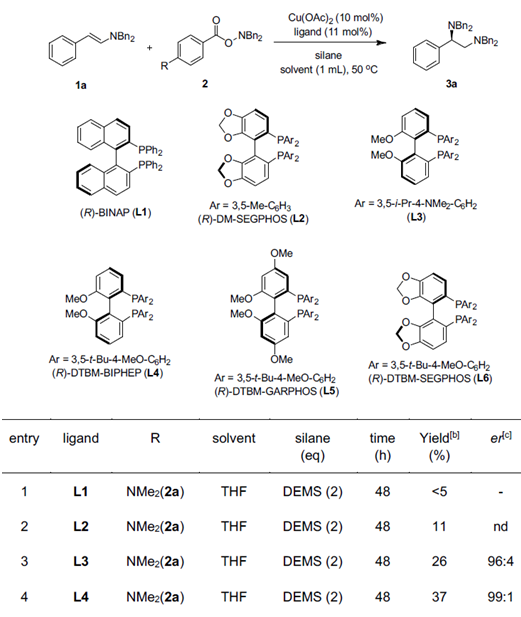
以烯胺1a和R= NMe2羟胺2a作为模板底物,作者对底物取代基、催化剂、氢源等反应条件进行反复筛选,确定最佳条件为(Table 1):烯胺1a和R= NEt2羟胺为最优底物,10 mol% Cu(OAc)2和11 mol% (R)-BINAP(L6)为最优催化剂,1.1 equiv(EtO)2MeSiH(DMMS)为最优氢源,THF为最优溶剂,在50 ℃条件下反应48小时,能以69%的收率和94%的对映选择性得到目标产物。
Table 1.氢胺化反应的条件优化
在最优反应条件下,作者考察了烯胺和O-酰基羟胺的底物范围。各种N-取代、苯基取代、杂环取代的烯胺、吗啉、4-哌啶酮、哌嗪以及3-乙基氧代丙酸酯衍生的烯胺均能很好的适应反应条件,可以中等至较好的收率和较高的对映选择性得到相应产物。但N-Boc、N-Ts保护的烯胺、烷基取代的烯胺以及9-乙烯基咔唑衍生的烯胺的耐受性不太好,不能或只能以极低的收率得到相应产物。同时,各种苄基取代、杂环取代、1-嘧啶基哌嗪取代以及二烷基取代的羟胺也能很好的适应反应条件,能以良好的收率和良好至优秀的对映选择性得到相应产物。
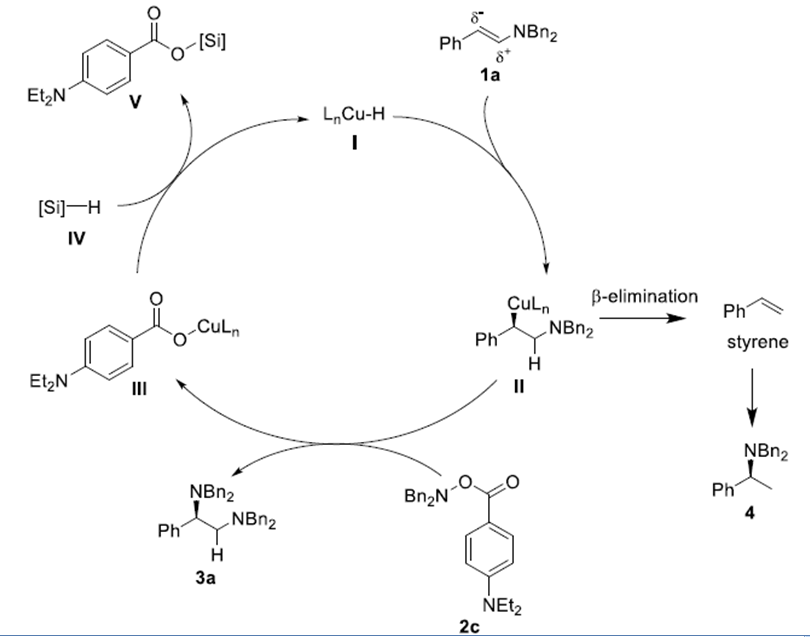
基于之前报道的Cu催化烯烃的不对称氢胺化反应的机理研究,作者推测该反应的机理:烯胺与原位生成的Cu(I)-H反应,生成烷基铜中间体II。然后,II与羟胺2c发生氧化反应,生成不对称1,2-二胺产物3a和苯甲酸铜III。III与硅烷IV发生金属转移反应,III又会重新转化为I。少量的II会发生β-消除反应,生成的苯乙烯会进一步发生氢胺化反应生成化合物4。
Scheme 2. 反应机理解析
论文总结评价
瑞典隆德大学Peter Somfai课题组报道了Cu催化烯胺的不对称氢胺化反应,能以良好的收率和较高的对映选择性直接得到手性1,2-二胺化合物。考虑到Cu催化体系在不对称氢胺化反应中表现出的优异的催化活性和对映选择性,将其引入不对称C-N键合成领域,必将给C-N键合成这一领域注入新的活力和广阔的契机。但开发新的有效的直接合成不对称1,2-二胺化合物的方法仍然面临巨大挑战。
参考文献:
- Shao, X.; Li, K.; Malcolmson, S. J. Am. Chem. Soc.2018, 140, 7083.DOI: 10.1021/jacs.8b04750
- Miki, Y.; Hirano, K.; Satoh, T.; Miura, M. Angew. Chem. Int. Ed.2013, 52, 10830.DOI:10.1002/anie.201304365
- Zhu, S.;Niljianskul, N.; Buchwald, S. L. J. Am. Chem. Soc. 2013, 135,15746. DOI: 10.1021/ja4092819
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!



















No comments yet.