本文作者:杉杉
导读
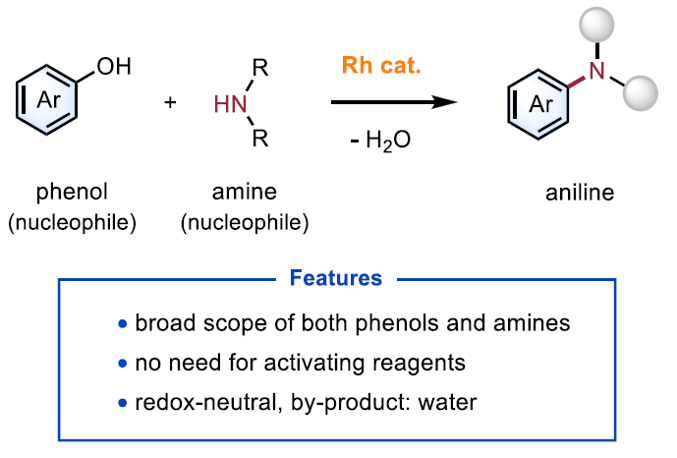
近日,西湖大学的石航课题组在J. Am. Chem. Soc.中发表论文,报道一种通过铑催化剂参与的酚与胺之间的胺化反应方法学,进而顺利完成一系列苯胺衍生物的构建。其中,作者通过选择具有亲芳环性的 (arenophilic)铑催化剂,并通过π-配位促进苯酚底物的酮-烯醇互变异构化过程,进而与一系列胺分子进行后续的脱水缩合过程。同时,作者进一步发现,在这一全新的氧化还原中性催化体系中,各类具有不同电子性质的酚类底物与一系列一级胺以及二级胺底物,均能够有效地完成上述的交叉偶联过程。此外,通过对一系列复杂生物活性分子的后期官能团化研究,该小组进一步证实,这一全新的胺化策略具有潜在的合成应用价值。
Catalytic Amination of Phenols with Amines
K. Chen, Q. Kang, Y. Li, W. Wu, H. Zhu, H. Shi, J. Am. Chem. Soc. 2022, ASAP doi:10.1021/jacs.1c12622.
正文
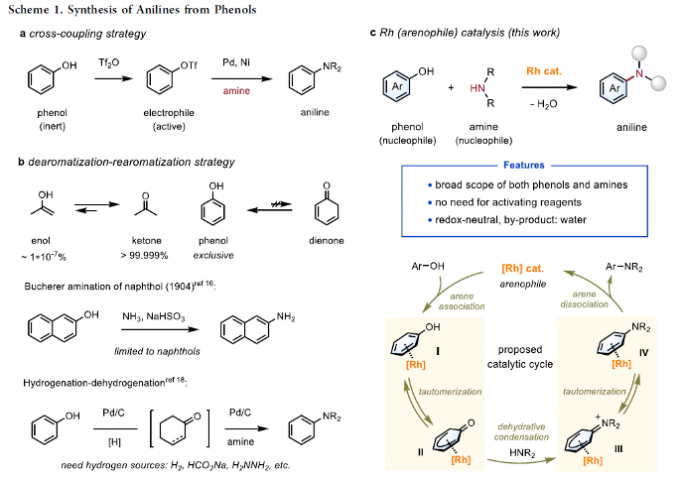
苯胺骨架广泛存在于一系列功能材料、药物、农药化学品以及天然产物分子中。目前,有机合成化学家已经成功设计出诸多构建苯胺分子的相关合成转化策略[1]-[3]。然而,对于采用过渡金属催化的酚类化合物胺化反应方法学的相关研究,至今仍面临诸多的挑战 (Scheme 1) [4]。
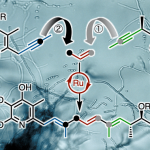
受到前期对于羰基-胺缩合策略在有机催化、还原胺化以及Mannich反应中的应用[5]与经典的Bucherer胺化反应方法学[6]中相关的酚类化合物互变异构化过程[7]以及本课题组前期对于对金属-芳烃π-配位配合物相关研究[8]-[9]的启发,本文中,西湖大学的石航课题组采用氧化还原中性铑催化体系,成功开发出一种全新的酚与胺分子之间的胺化反应方法学 (Scheme 1b-c)。同时,作者提出一种合理的反应机理。首先,通过Rh(III)中心与苯酚之间的π-配位过程,形成相应的配合物I,再通过配合物I的去质子化过程,形成η5-配合物II。之后,通过配合物II中羰基与胺之间的缩合过程,形成亚胺正离子中间体III。接下来,通过亚胺正离子中间体III的互变异构以及去配位步骤,最终获得预期的苯胺产物。
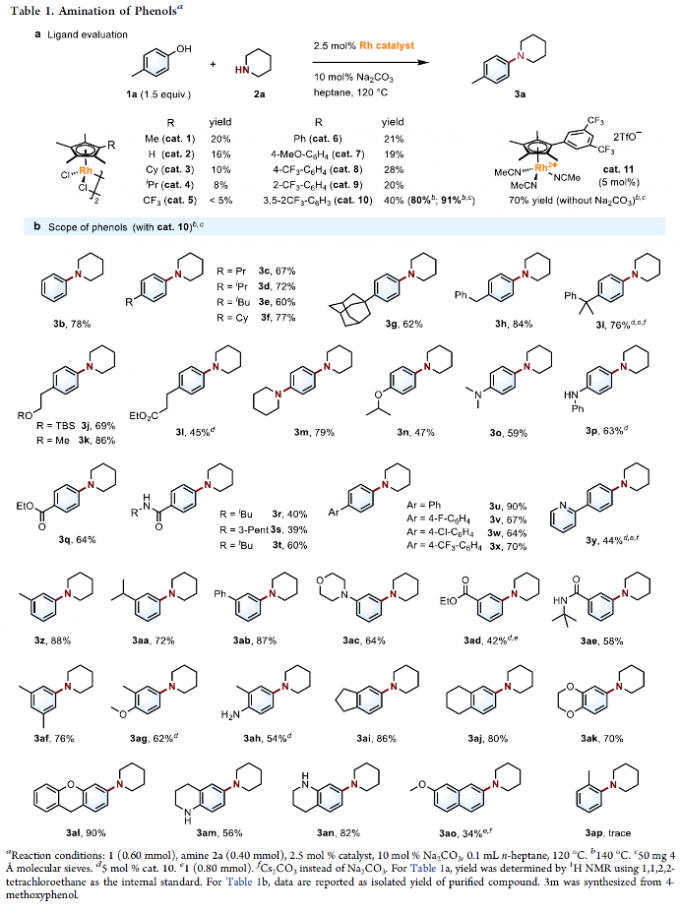
首先,作者采用4-甲基苯酚1a与哌啶2d作为模型底物,进行相关胺化反应条件的优化筛选 (Table 1a)。进而确定最佳的反应条件为:采用cat. 10作为催化剂,Na2CO3作为碱,加入4Å分子筛,正庚烷作为反应溶剂,反应温度为140 oC,最终获得91%收率的胺化产物3a。
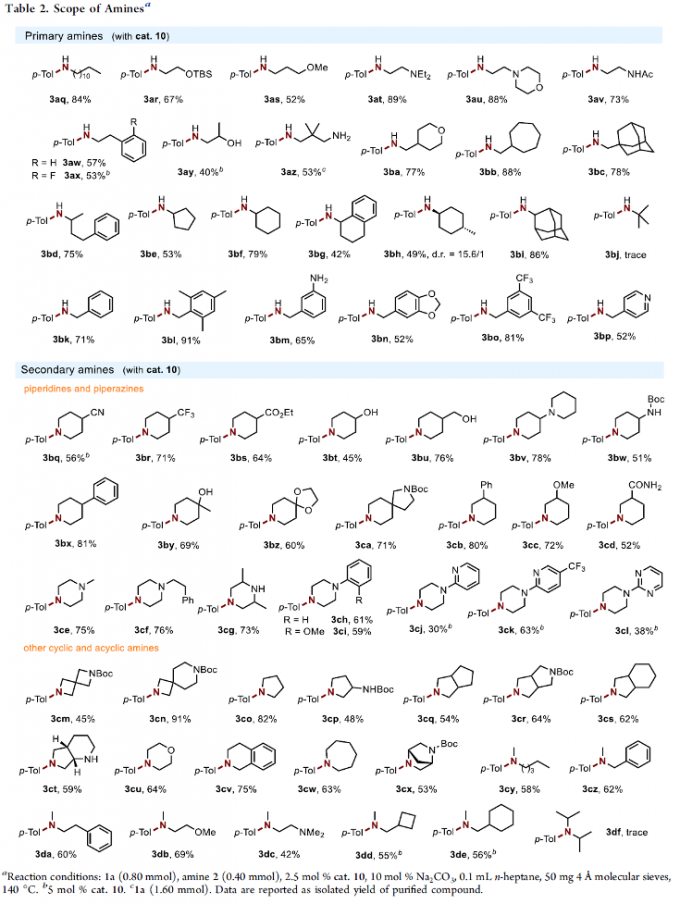
在上述的最佳反应条件下,作者首先对一系列苯酚底物的应用范围进行考察(Table 1b)。研究表明,苯环对位中具有一系列供电子、吸电子与电中性基团以及芳基取代的苯酚底物,均能够较好地与上述的标准反应条件兼容,并获得相应的胺化产物3b–3y (39-90% 收率)。之后,作者发现,上述的标准反应体系对于苯环间位中的不同取代基团,同样能够良好地兼容,并获得相应的偶联产物3z–3ae (42-88% 收率)。同时,作者进一步发现,多取代酚以及稠环酚底物同样能够有效地参与上述的胺化过程。接下来,该小组观察到,上述的标准反应条件对于酚羟基基团的立体环境较为敏感,在应用于2-甲基苯酚底物时,则仅获得痕量的胺化产物3ap。
之后,作者进一步对各类胺底物的应用范围进行考察 (Table 2)。研究表明,一系列具有有直链 (3aq–3ax)、β-支链 (3ay–3bc)或α-支链 (3bd–3bi)的一级胺底物,均能够与上述的标准反应条件良好地兼容。同时,作者发现,一系列苄胺衍生物,同样能够顺利地参与上述的胺化过程,并获得相应的取代苯胺产物3bk–3bp (52-97% 收率)。同时,作者发现,上述的标准反应体系同样能够有效地应用于一系列具有链状与环状结构的二级胺底物,并表现出良好的官能团兼容性。然而,由于立体位阻的存在,叔丁胺 (3bj)与二异丙胺(3df)则无法顺利进行上述的N-芳基化过程。
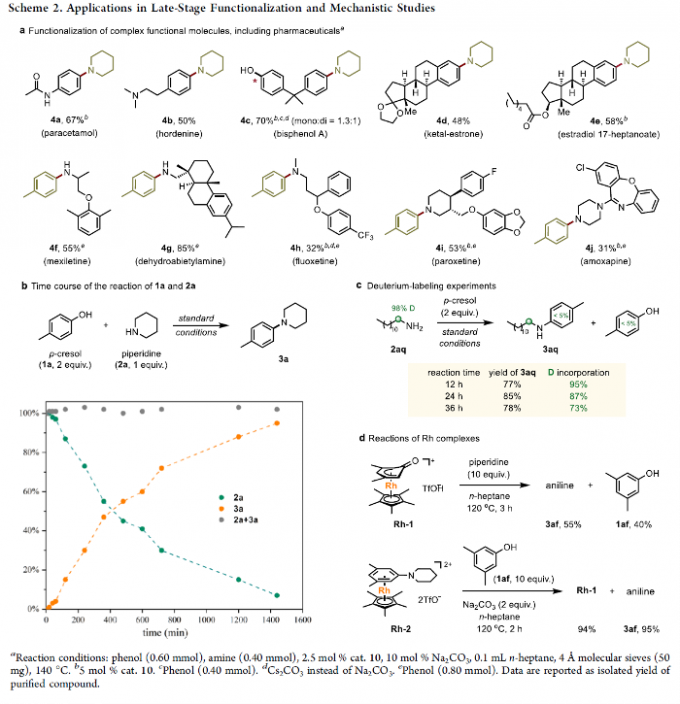
接下来,作者将这一全新的胺化策略应用于各类生物活性分子的后期官能团化研究 (Scheme 2a),进而表明这一全新的胺化策略具有良好的合成应用价值。同时,作者对上述胺化过程的反应机理进行更为深入的研究(Schemes 2b-2d)。首先,该小组在上述的标准反应条件下,对1a与2a之间的催化胺化反应过程进行监控,实验观察到,2a的含量逐渐减少,同时产物3a的含量逐渐增加,然而,反应过程中并未检测出亚胺、环己酮或环己烯-1-酮中间体的形成 (Scheme 2b)。之后,该小组在1a与α–氘代十二烷基胺2aq之间的胺化反应中发现,相应胺化产物3aq中的氘掺入量为95%,并且,在反应时间超出12 h之后,氘掺入量无显著降低。然而,在反应进行24-36 h之后,则观察到氘掺入量出现显著降低 (Scheme 2c)。值得注意的是,反应过程中,未检测到芳环的H/D交换,进而能够排除氢转移机理。之后,作者进一步发现,在选择Rh-1与2a进行反应时,能够获得55%收率的苯胺产物3af以及40%收率的3,5-二甲基苯酚产物1af。而选择Rh-2与1af反应时, 则获得近乎定量的Rh-1配合物与相应的苯胺产物3af (Scheme 2d)。通过上述观察,能够进一步支持作者最初提出的π–配位–活化机理 (Scheme 1c)。
总结
西湖大学的石航课题组成功设计出一种通过铑催化剂促进的酚与胺类化合物之间的胺化反应方法学,进而顺利完成一系列苯胺衍生物的构建。这一全新的胺化策略具有广泛的底物范围以及良好的官能团兼容性等优势。
参考文献
[1] (a) R. Dorel, C. P. Grugel, A. M. Haydl, Angew. Chem. Int. Ed. 2019, 58, 17118. doi: 10.1002/anie.201904795.(b) I. P. Beletskaya, V. A. Cheprakov, Coord. Chem. Rev. 2004, 248, 2337. doi: 10.1016/j.ccr.2004.09.014.
(c) M. Marin, R. J. Rama, M. C. Nicasio, Chem. Rec. 2016, 16, 1819. doi: 10.1002/tcr.201500305.
[2] J. P. Wolfe, S. L. Buchwald, J. Org. Chem. 1997, 62, 1264. doi: 10.1021/jo961915s. [3] N. Iranpoor, F. Panahi, Adv. Synth. Catal. 2014, 356, 3067. doi: 10.1002/adsc.201400460. [4] (a) C. Di Bugno, M. Pasquali, P. Leoni, P. Sabatino, D. Braga, Inorg. Chem.1989, 28, 1390. doi: 10.1021/ic00306a034.(b) Z. Qiu, C. Li, Chem. Rev. 2020, 120, 10454. doi: 10.1021/acs.chemrev.0c00088.
(c) Z. Chen, H. Zeng, S. A. Girard, F. Wang, N. Chen, C. Li, Angew. Chem. Int. Ed. 2015, 54, 14487. doi: 10.1002/anie.201506751.(d) X. C hen, Z. Yang, X. Chen, W. Liang, Z. Zhu, F. Xie, Y. Li, J. Org. Chem. 2020, 85, 508. doi: 10.1021/acs.joc.9b02558.
(e) T. Ichitsuka, I. Takahashi, N. Koumura, K. Sato, S. Kobayashi, Angew. Chem. Int. Ed. 2020, 59, 15891. doi: 10.1002/anie.202005109.
(f) K. V. N. Esguerra, W. Xu, J. P. Lumb, Chem. 2017, 2, 533. doi: 10.1016/j.chempr.2017.03.003.
(g) Z. Qiu, H. Zeng, C. Li, Acc. Chem. Res. 2020, 53, 2395. doi: 10.1021/acs.accounts.0c00479.
[4] (a) B. List, R. A. Lerner, C. F. Barbas III, J. Am. Chem. Soc. 2000, 122, 2395. doi: 10.1021/ja994280y.(b) D. W. C. MacMillan, Nature 2008, 455, 304. doi: 10.1038/nature07367.
(c) O. I. Afanasyev, E. Kuchuk, D. L. Usanov, D. Chusov, Chem. Rev. 2019, 119, 11857. doi: 10.1021/acs.chemrev.9b00383.
[6] H. T. Bucherer, J. Prakt. Chem. 1904, 69, 49. doi: 10.1002/prac.19040690105. [7] B. Ośmiałowski, E. D. Raczyńska, T. M. Krygowski, J. Org. Chem. 2006, 71, 3727. doi: 10.1021/jo052615q. [8] L. J. Williams, Y. Bhonoah, L. A. Wilkinson, J. W. Walton, Chem. Eur. J. 2021, 27, 3650. doi: 10.1002/chem.202004621. [9] A. Igau, Coord. Chem. Rev. 2017, 344, 299. doi: 10.1016/j.ccr.2017.03.001.本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载



















No comments yet.