2017年、北卡罗来纳大学教堂山分校・David Nicewicz课题组、利用可见光还原催化剂、成功开发出了对富电子芳香环底物的芳香族亲核取代反应。
“Cation Radical Accelerated Nucleophilic Aromatic Substitution via Organic Photoredox Catalysis”
Tay, N. E. S.; Nicewicz, D. A.* J. Am. Chem. Soc. 2017, 139, 16100–16104. DOI: 10.1021/jacs.7b10076
需要解决的课题
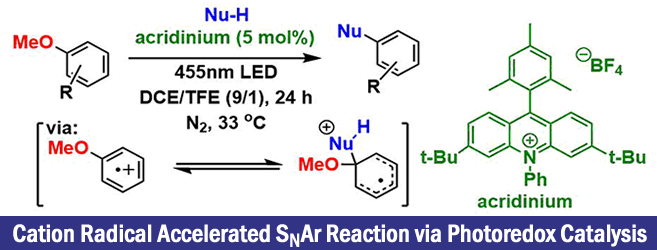
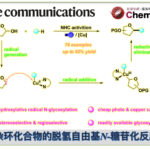
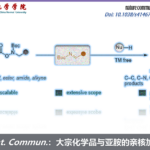
芳香族亲核取代反应(SNAr)直接对苯环进行修饰的一种方法、但是由于中间体Meisenheimer复合体比较稳定,因此邻位或者对位有强吸电子取代常常是必要条件。因为这个限制条件,也限制了其底物的适用范围。
Nicewicz等人,设计了一条亲核试剂对自由基阳离子的加成 – 离去的反应设想,成功打破了通常SNAr反应对电子效应这块的严苛的要求。
具体手法
Nicewicz及其同事的研究兴趣在由吖啶型可见光氧化还原过程产生的芳烃自由基阳离子和亲核试剂的反应、并且应用在了C-H胺基化[1]、C-H氰化[2]反应中。对于作为C-H胺基化反应底物的茴香醚、计算结果表明,自由基阳离子的电荷密度不仅在邻位和对位碳上比较大,而且在位于ipso上的碳也同样很大。
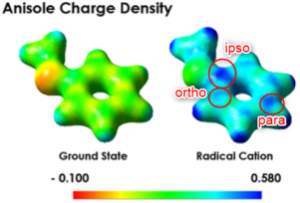
引用自论文
因为对自由基阳离子的亲核攻击是可逆的、一般来说胺基化・氰基化的场合,是经过亲核进攻→不可逆的氧化→质子离去的过程达成C-H官能团化。在这里,作者在反应条件中没有加入氧化剂,因此发生了亲核剂进攻在ipso位,并且形成了Meisenheimer中间体,然后伴随着离去甲醇实现了SNAr反应(标题图条件)。
另外,相对于以前的需要用到镍催化剂,强酸强碱的条件来说,这一次的新方法不需要使用过渡金属,能够在温和条件下实现也是其一大亮点。
主张的有效性验证
①反应条件
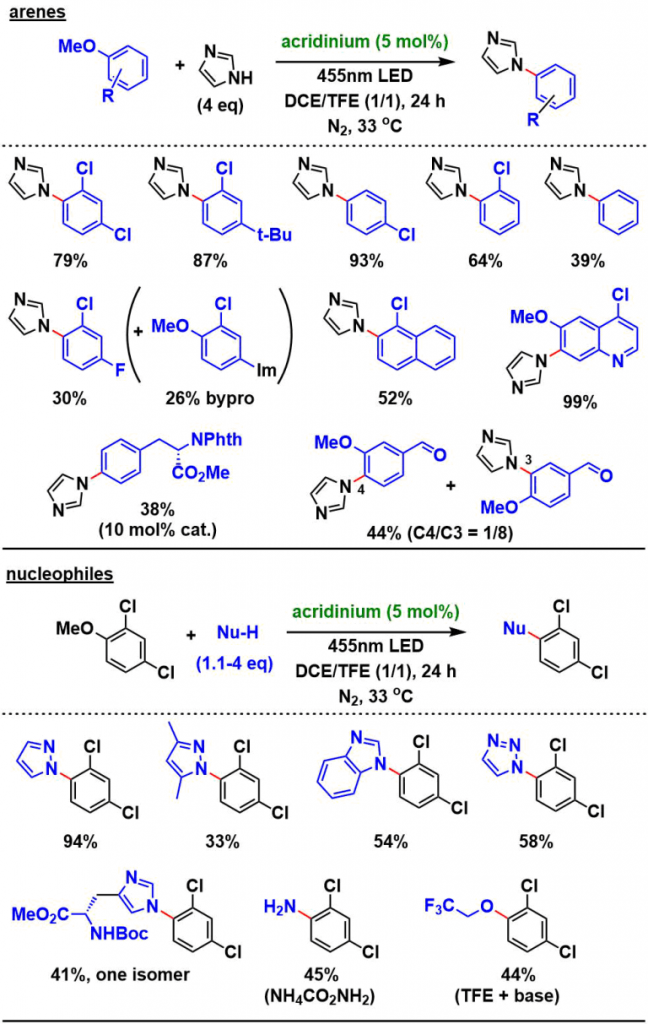
就底物来说,作者选择了咪唑,取代苯的2,4-二氯茴香醚、并且也筛选了可见光氧化还原催化剂,溶剂,气体环境。作者使用了以前的胺基化,氰基化研究中用到的吖啶催化剂,在氮气保护下,DCE/TFE(9/1)的混合溶剂的组合下,得到了高产率的目标产物。在无催化剂,或者无光照下反应无法进行,在氧气或者空气环境下产率降低。
②底物拓展
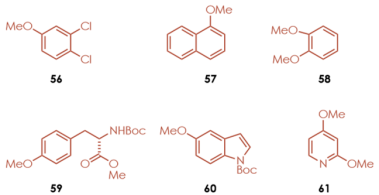
芳烃侧:茴香醚和卤素取代的苯甲醚是可转化的,但在氟取代产物的情况下,也可能发生脱氟型SNAr反应进行的副产物。但是,该脱氟反应在无催化剂或者无光照条件下也无法进行,从这点可以看出,反应通过光氧化还原催化剂加速。酪氨酸衍生物的甲基醚部分也可以应用于该反应的底物。
亲核剂侧:作者主要尝试了含氮杂环类亲核试剂、咪唑,吡唑,苯并咪唑,三唑及其取代产物均适用。有取代基保护的组氨酸也可用作亲核试剂。另外也实现了氨基甲酸铵的胺基化,碱性存在下与TFE溶剂反应进行的三氟乙基醚化等反应。
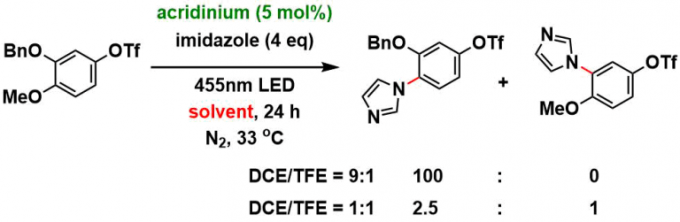
对于含有多个反应点的底物:对于具有多个氮的亲核试剂,反应倾向于在空间位阻小的N上进行。反应不仅可以发生在甲基醚位点,而且可以转化苄基醚位点。在具有两个可取代位点的底物,对于区域选择性来说,具有较大的底物依赖性。同时如下图所示的位置选择性中,也体现了TFE溶剂效应。
③关于反应机理
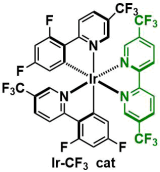
在使用标题图中所示的吖啶类可见光氧化还原催化剂(+2.15 V vs SCE)、咪唑(Ep/2 = +1.15V vs SCE)与2,4-二氯茴香醚(Ep/2 = +2.04V vs SCE)都有可能被氧化、而下图中的Ir-催化剂(+1.68 V vs SCE)却不能氧化2, 4-2,4-二氯茴香醚。这一次作者使用前者实现了SNAr反应、而使用后者的话反应不发生。因此,茴香醚氧化产生的自由基阳离子被认为对反应的进行是至关重要的。
Comment
- 虽说这次的反应并不是直接的C-H活化,看似并不是特别火热的课题,但是对于含有多个反应位点,如甲醚,苄醚共存的底物来说,对于位置选择性,如果能通过反应试剂,反应条件的控制达成的话会更加有意思。
- 在Supporting Infomation作者列举出了几个不能进行反应的底物,从这些底物中可以推测,适当程度的吸电子取代基可能有助于反应的进行。
- 选择性有可能可以通过稳定和去稳定自由基阳离子的添加剂来控制。为此,我们需要了解阳离子的性质及其寿命的控制方法[3]。
参考文献
- Romero, N. A.; Margrey, K. A.; Tay, N. E.; Nicewicz, D. A. Science 2015, 349, 1326. DOI: 10.1126/science.aac9895
- McManus,J. B.; Nicewicz, D. A. J. Am. Chem. Soc. 2017, 139, 2880. DOI: 10.1021/jacs.6b12708
- Eberson, L.; Hartshorn, M. P.; Persson, O.; Radner, F. Chem. Commun. 1996, 2105. doi:10.1039/CC9960002105
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!





















No comments yet.