概要
Chen-Mapp重排 (Chen-Mapp rearrangement)又称为[3,3]-phosphorimidate重排或[3,3]-氮杂-磷杂-氧杂-Cope重排 ([3,3]-aza-phospha-oxa-Cope rearrangement)[1],是allylic phosphorimidate或propargylic phosphorimidate (通常由烯丙醇或炔丙醇与有机膦或亚磷酸酯及有机叠氮化合物原位反应生成[2]-[3])在加热[1]或过渡金属钯催化[4]-[7]条件下进行的分子内[3,3]-σ-重排过程,生成phosphoramidate的反应。该反应在2004年由美国Michigan大学化学与医药化学系 (Departments of Chemistry and Medicinal Chemistry, University of Michigan)的B. Chen与A. K. Mapp首次报道[1]。
2004年,R. A. Batey采用钯催化剂参与该重排,使反应可以在较为温和的条件下进行,并获得良好产率[5]。
2004年,R. A. Batey研究组采用手性N, N′-二甲基环己二胺辅基,成功实现反应的非对映选择性控制[6]。
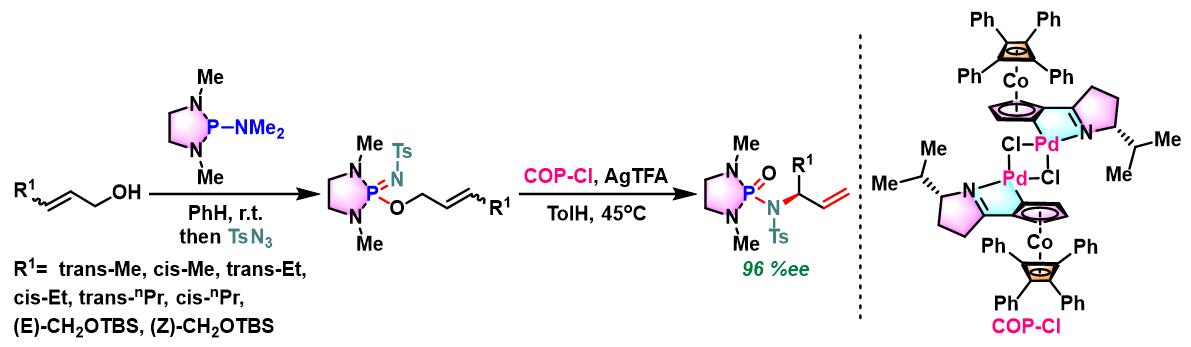
同时,R. A. Batey采用手性催化剂COP(chiral cobalt oxazoline palladacycles)-Cl,成功实现N-保护型烯丙胺的对映选择性合成[6]。
2010年,A. K. Mapp将底物扩展至propargylic phosphorimidate,成功完成了联烯基酰胺 (allenamide)的合成[7]。
目前,该反应广泛应用于各种N-保护型烯丙胺 (N-protected allylic amines)与联烯基酰胺类化合物的合成,而N-保护型烯丙胺、烯丙胺与联烯基酰胺类化合物是有机合成方法学研究及天然产物全合成的关键砌块[8]-[19]。
基本文献
- [1] Chen, A. K. Mapp, J. Am. Chem. Soc. 2004, 126, 5364. doi: 10.1021/ja0490469.
- [2] G. Gololobov, I. N. Zhmurova, L. F. Kasukhin, Tetrahedron 1981, 37, 437. doi: 10.1016/S0040-4020(01)92417-2.
- [3] G. Gololobov, L. F. Kasukhin, Tetrahedron 1992, 48, 1353. doi: 10.1016/S0040-4020(01)92229-X.
- [4] Chen, A. K. Mapp, J. Am. Chem. Soc.2005, 127, 6712. doi: 10.1021/ja050759g.
- [5] E. Lee, R. A. Batey, Angew. Chem. Int. Ed. 2004, 43, 1865. doi: 10.1002/anie.200353284.
- [6] E. Lee, R. A. Batey, J. Am. Chem. Soc. 2005, 127, 14887. doi: 10.1021/ja054161k.
- [7] M. Danowitz, C. E. Taylor, T. M. Shrikian, A. K. Mapp, Org. Lett. 2010, 12, 2574. doi: 10.1021/ol1007845.
- [8] Cativiela, M. D. Diaz-de-Villegas, Tetrahedron: Asymmetry 1998, 9, 3517. doi: 10.1016/S0957-4166(98)00391-7.
- [9] Hayashi, A. Yamamoto, Y. Ito, E. Nishioka, H. Miura, K. Yanagi, J. Am. Chem. Soc. 1989, 111, 6301. doi: 10.1021/ja00198a048.
- [10] M. Trost, D. L. Vanvranken, J. Am. Chem. Soc. 1993, 115, 444. doi: 10.1021/ja00055a013.
- [11] Airiau, N. Girard, M. Pizzeti, J. Salvadori, M. Taddei, A. Mann, J. Org. Chem. 2010, 75, 8670. doi: 10.1021/jo101776y.
- [12] Burgess, M. J. Ohlmeyer, J. Org.Chem. 1991, 56, 1027. doi: 10.1021/jo00003a024.
- [13] J. T. Hyland, L. S. Hegedus, J. Org. Chem. 2006, 71, 8658. doi: 10.1021/jo061340r.
- [14] R. Berry, R. P. Hsung, J. E. Antoline, M. E. Petersen, R. Challeppan, J. A. Nielson, J. Org. Chem. 2005, 70, 4038. doi: 10.1021/jo0503411.
- [15] L. Wei, R. P. Hsung, H. Xiong, J. A. Mulder, N. T. Nkansah, Org. Lett. 1999, 1, 2145. doi: 10.1021/ol990345q.
- [16] Hayashi, R. P. Hsung, J. B. Feltenberger, A. G. Lohse, Org. Lett. 2009, 11, 2125. doi: 10.1021/ol900647s.
- [17] Lu, R. Hayashi, R. P. Hsung, K. A. DeKorver, A. G. Lohse, Z. Song, Y. Tang, Org. Biomol. Chem. 2009, 7, 3331. doi: 10.1039/B908205K.
- [18] Ramage, D. Hopton, M. J. Parrott, G. W. Kenner, G. A. Moore, J. Chem. Soc., Perkin Trans. 1 1984, 1357. doi: 10.1039/P19840001357.
- [19] F. Zhao, S. K. Xi, A. T. Song, G. J. Ji, J. Org. Chem. 1984, 49, 4549. doi: 10.1021/jo00197a050.
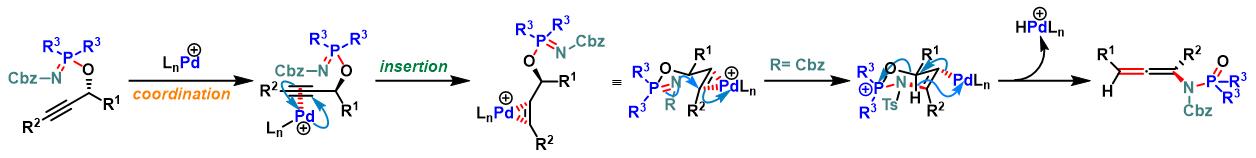
反应机理
Chen-Mapp重排反应的驱动力为P=O双键比P=N双键具有更高的BDE。
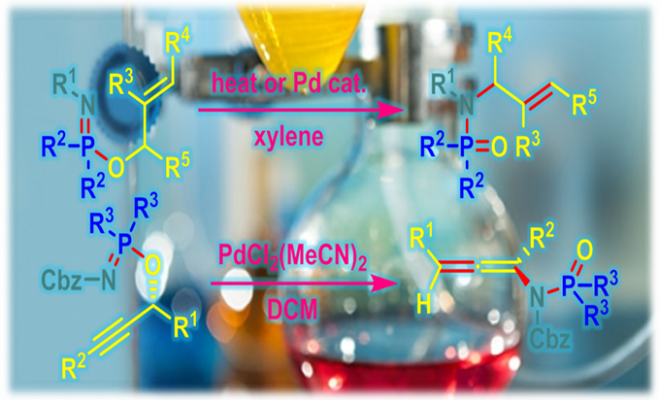
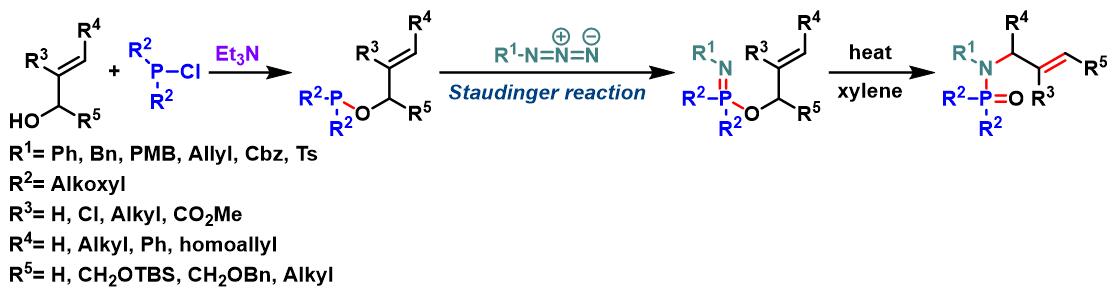
allylic phosphorimidate底物的Chen-Mapp重排[1]-[3]
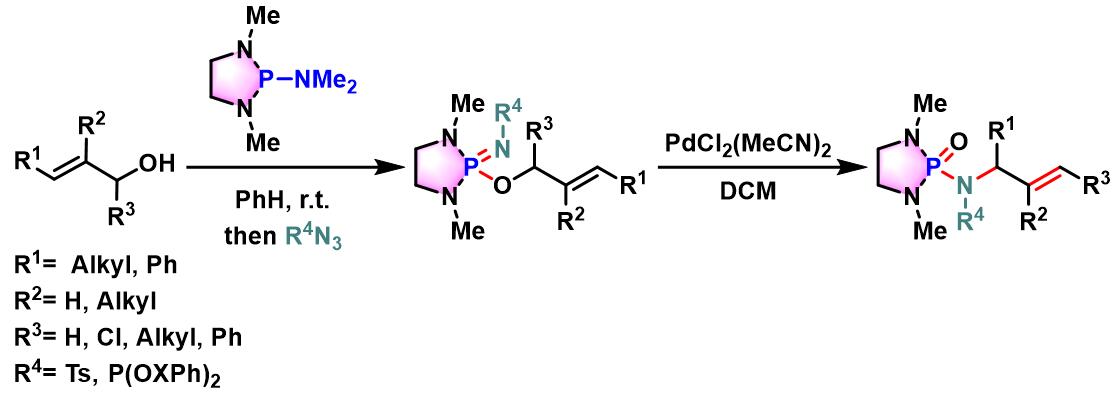
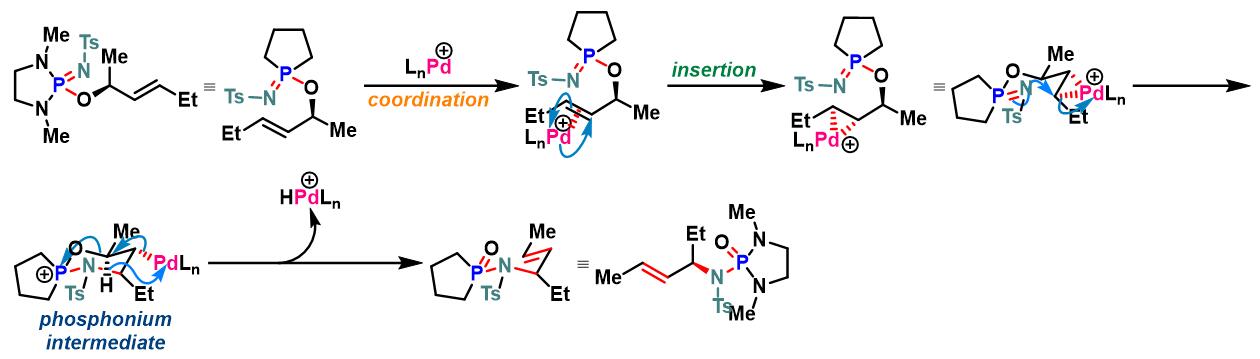
过渡金属催化的allylic phosphorimidate底物的Chen-Mapp重排[4]
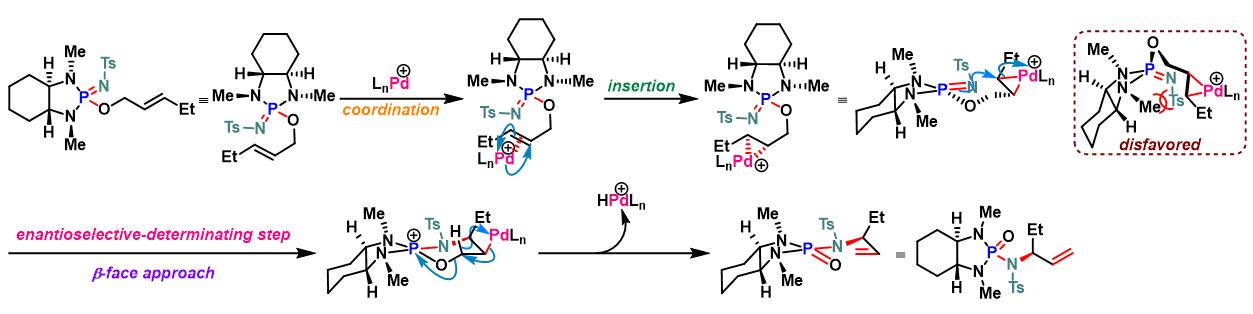
手性辅基参与的Chen-Mapp重排[5]
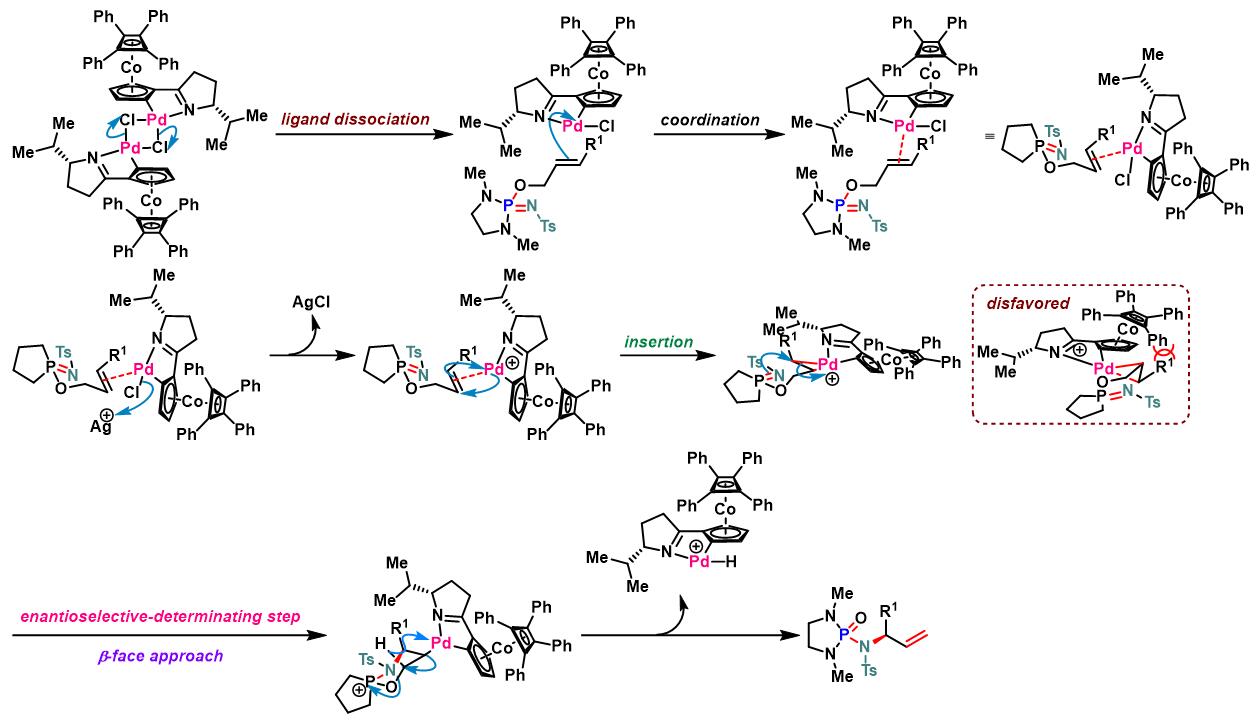
COP-X参与的Chen-Mapp重排[6]-[7]
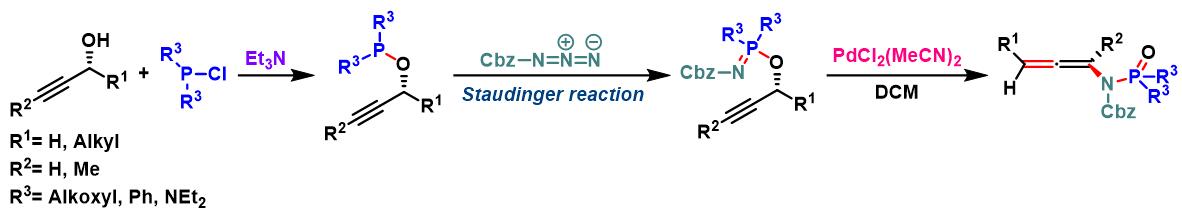
propargylic phosphorimidate底物的Chen-Mapp重排
参考文献
- [1] T. A. Albright, W. J. Freeman, E. E. Schweizer, J. Org. Chem. 1976, 41, 2716. doi: 10.1021/jo00878a013.
- [2] J. Barluenga, F. Palacios, Org. Prep. Proced. Int. 1991, 23, 1. doi: 10.1080/00304949109458286.
- [3] A. Alexakis, S. Mutti, P. Mangeney, J. Org. Chem. 1992, 57, 1224. doi: 10.1021/jo00030a034.
- [4] E. E. Lee, R. A. Batey, Angew. Chem. Int. Ed. Engl. 2004, 43, 1865. doi: 10.1002/anie.200353284.
- [5] E. E. Lee, R. A. Batey, J. Am. Chem. Soc. 2005, 127, 14887. doi: 10.1021/ja054161k.
- [6] D. J. Cassar, H. Roghzai, D. Villemin, P. N. Horton, S. J. Coles, J. C. Richards, Organometallics 2015, 34, 2953. doi: 10.1021/acs.organomet.5b00282.
- [7] J. S. Cannon, L. E. Overman, Acc. Chem. Res. 2016, 49, 2220. doi: 10.1021/acs.accounts.6b00398.
反应实例
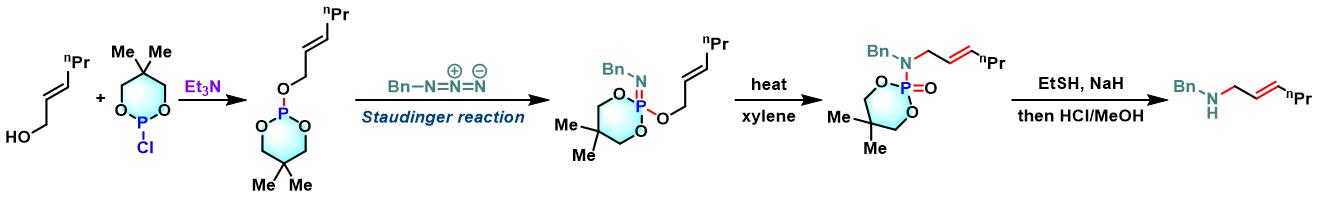
烯丙胺的合成[1] [2]
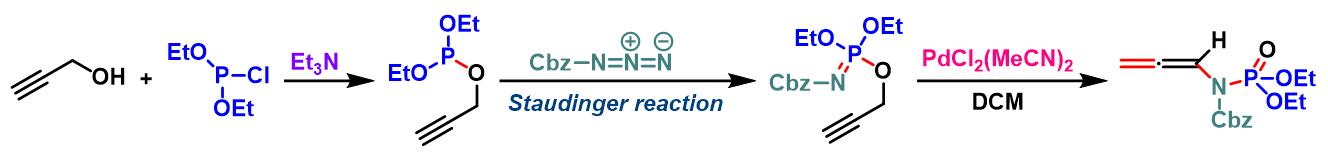
联烯基酰胺类化合物的合成[3]
实验步骤
allylic phosphorimidate底物的Chen-Mapp重排
向冰水浴冷却的乙醚中加入烯丙醇 (1.25 eq.)Et3N (1.25 eq.), 随后加入2-chloro-5,5-dimethyl-1,3,2-dioxaphosphorinane或氯亚磷酸二乙酯的乙醚溶液 (浓度为1M,1.25 eq.)。将上述溶液搅拌20 min,随后采用标准Schlenk技术进行过滤,除去生成的Et3N•HCl沉淀。通过真空除去乙醚,后将残余物溶于适量二甲苯。向上述二甲苯溶液中滴加冰水浴冷却的苄基叠氮的二甲苯溶液 (浓度为2M,1 eq.)。注意:在使用烯丙基叠氮参与本反应时,因其具有挥发性,因此需要过量加入 (通常为3 eq.)。将上述反应混合物缓慢升至室温 (升温时间高于1h),后将上述混合物在80 °C下加热1 h, 随后加入适量二甲苯进行稀释,继续加入回流4 h。4 h后,将上述反应液冷却,采用快速柱色谱直接进行纯化 (正己烷/EtOAc 1:9 v/v作为洗脱剂),获得相应phosphoramidate产物。
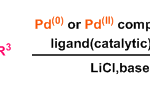
过渡金属催化的Chen-Mapp重排
方法 A. tosyl iminodiazaphospholidines在室温条件下进行的重排
N2气氛下,向火焰干燥过的圆底烧瓶中加入iminodiazaphospholidine (1 eq.) 的CH2Cl2溶液(浓度为0.12 M),随后加入二氯双(乙腈)合钯(II) (0.05 eq.)。将上述反应混合物在N2气氛下进行搅拌,并通过31P-NMR进行监控,直至反应结束。反应结束后,将反应液在真空条件下进行浓缩,随后将其溶于少量二氯甲烷,并通过硅胶柱色谱进行分离纯化 (EtOAc/正己烷 2:1 v/v作为洗脱剂),获得相应重排产物。
方法 B. tosyl iminodiazaphospholidines在加入条件下进行的重排
N2气氛下,向火焰干燥过的圆底烧瓶中装入回流冷凝管,随后加入iminodiazaphospholidine (1 eq.) 的CH2Cl2溶液 (浓度为0.12 M),随后加入二氯双(乙腈)合钯(II) (0.05 eq.)及适量新活化的4Å分子筛。继续维持在N2气氛下,将上述反应混合物45°C下加热搅拌,并通过31P-NMR进行监控,直至反应结束。反应结束后,将反应液冷却至室温,并在真空条件下进行浓缩,随后将其溶于少量二氯甲烷,并通过硅胶柱色谱进行分离纯化 (EtOAc/正己烷 2:1 v/v作为洗脱剂),获得相应重排产物。
方法 C. tosyl iminodiazaphospholidines的不对称重排
N2气氛下,向火焰干燥过的尖底反应瓶 (conical vial)中,加入甲苯 (维持底物浓度为1 M)、iminodiazaphospholidine (1 eq.)、 COP.Cl (0.05 eq)及AgTFA (0. 1 eq.). 将反应瓶密封,并在45°C下加热搅拌,并通过31P-NMR进行监控,直至反应结束。反应结束后,将反应液冷却至室温,并在真空条件下进行浓缩。随后,将其溶于少量二氯甲烷,并通过硅胶柱色谱进行分离纯化 (EtOAc/正己烷 2:1 v/v作为洗脱剂),获得相应重排产物。
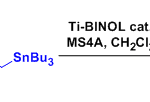
propargylic phosphorimidate底物的Chen-Mapp重排
向冰水浴冷却的乙醚中加入炔丙醇 (1.3 eq.)与Et3N (1.3 eq.), 随后加入氯亚磷酸二乙酯 (1.3 eq.)。将上述溶液搅拌20 min,随后进行过滤,除去生成的Et3N•HCl沉淀。在真空条件下除去乙醚,后将残余物溶于适量二氯甲烷。室温条件下,向上述反应混合物中滴加苄氧羰基叠氮 (1 eq.)。将上述反应混合物继续搅拌2h,真空条件下除去DCM, 将粗产物采用硅胶柱色谱分离纯化(首先用正己烷/EtOAc 1:5v/v洗脱剂, 随后更换正己烷/EtOAc 1:2.5 v/v洗脱剂,进行梯度洗脱),获得相应phosphorimidate。注意:phosphorimidate 放置时易分解,需要立即进行分离纯化。
向phosphorimidate (1.0 eq)的DCM溶液 (浓度为0.1 M)中加入PdCl2(CH3CN)2 (0.03 eq)。将上述混合物在室温下进行搅拌, 并通过TLC进行监控 (正己烷/EtOAc 1:1 v/v作为展开剂),直至反应结束(5-7 h)。反应结束后,在真空条件下除去二氯甲烷,并通过硅胶柱色谱进行分离纯化 (首先用正己烷/EtOAc 1:5v/v洗脱剂, 随后更换正己烷/EtOAc 1:2.5 v/v洗脱剂,进行梯度洗脱),获得相应联烯酰胺重排产物。注意:延长反应时间会出现产物分解与差向异构化。
实验安全须知
无机与有机叠氮化物具有较强的毒性与潜在的爆炸性,需要在通风极其优良的通风橱内小心仔细进行操作。并穿戴SSG防化手套。
参考文献
- [1] B. Chen, A. K. Mapp, J. Am. Chem. Soc. 2004, 126, 5364. doi: 10.1021/ja0490469.
- [2] A. M. Danowitz, C. E. Taylor, T. M. Shrikian, A. K. Mapp, Org. Lett. 2010, 12, 2574. doi: 10.1021/ol1007845.
- [3] A. M. Danowitz, C. E. Taylor, T. M. Shrikian, A. K. Mapp, Org. Lett. 2010, 12, 2574. doi: 10.1021/ol1007845.
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!















No comments yet.