(−)-salinosporamide A的立体选择性全合成最近被报道。使用Aza-Payne重排/加氢胺化反应构建吡咯烷骨架和终盘阶段C-H插入反应是本次全合成的关键。
Salinosporamide A
(−)-Salinosporamide A (1:Marizomib)是在2003年Fenical等人从海洋微生物Salinospora中提取分离出来的,具有强20S蛋白酶体抑制活性的天然产物[1]。另外,具有类似的omuralide (2)也比较有名、而1的蛋白酶体抑制活性要比2强、而且1还是在临床试验中作为多发性骨髓瘤的治疗候选药物(图1A)[2]。
1具有高度官能化的吡咯烷酮骨架(γ-内酰胺环),β-内酯环和环己烯基环等特征结构,并且还具有5个连续的不对称中心, 在化学结构上是一个非常有趣且有合成挑战性的化合物。因此,许多合成化学家开发了许多该化合物的合成路线[2a]。
1的首次全合成是由Corey等人在2004年,也就是该化合物分离提取1年后就被实现了(图1B)[3]。由于其高立体选择性和高总收率,该全合成路线直到现在仍然引起了广泛关注,可以说非常经典的一条路线。特别是从中间产物8立体选择性的合成化合物9的加成反应在之后的1的其他全合成路线的报道中经常被使用。另一方面,吡咯烷骨架的构建阶段(4至6)需要7天,这是一个需要改善的地方。
这次、密歇根州立大学的Borhan教授等人、利用Aza-Payne/加氢胺化反应(12→11)构建吡咯烷骨架、成功实现了立体选择性的(−)-salinosporamide A (1)的全合成(图1C)。另外合成终盘(10)的C-H插入反应是本合成成功的关键。
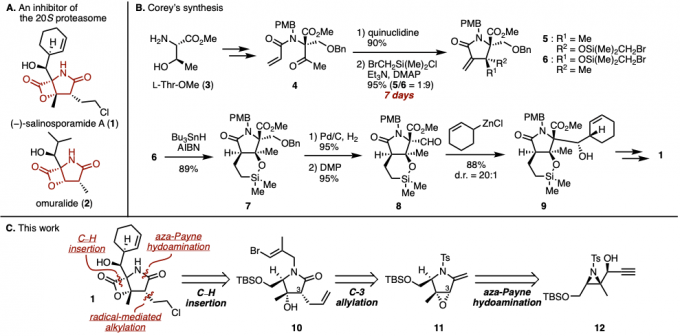
图1. (A)20S蛋白酶体阻害剤 (B)Corey等人的合成法 (C)(−)-Salinosporamide A的逆合成
“Total Synthesis of (−)-Salinosporamide A via a Late Stage C–H Insertion”
Gholami, H.; Kulshrestha, A.; Favor, O. K.; Staples, R. J.; Borhan, B. Angew. Chem., Int. Ed. 2019,58, Early View.
DOI:10.1002/anie.201900340
论文作者介绍

研究者:Babak Borhan
履历:
1988 B.Sc., University of California, Davis
1995 Ph.D., University of California, Davis
1995–1998 Postdoc, Columbia University
1998– Professor, Michigan State University
研究内容:有机光谱学、有机合成化学、生物有机化学
论文概要
(−)-Salinosporamide A (1)含有连续5个手性中心,反应的立体控制是一大难点。
从容易入手的13作为起始原料,先诱导合成14,然后再在手性有机催化剂存在下,合成了具有高对映选择性的不对称氮丙啶15。然后,对15的醛结构进行非对映异构体选择性的与乙炔基溴化镁反应后,在经由12的Aza-Payne/加氢胺化反应得到立体构造不变的含有吡咯烷骨架的中间体11[4]。
继而、对于18的C3位的烯丙基化反应,利用C5位取代基的高位阻进行立体控制,得到了主要产物20。18的醇基的保护基由TBS变为Bn基的话,非对映异构选择性会下降。另外对C5位的C-H插入反应来说,通过阴离子,阳离子或者自由基都无法实现,本次是利用经由乙烯基卡宾才实现了该反应而得到了目标产物23,具体请参考论文。
最后、参考Corey法,通过环己烯基氯化锌的非对映选择性加成反应引入环己烯基环来实现1的合成。
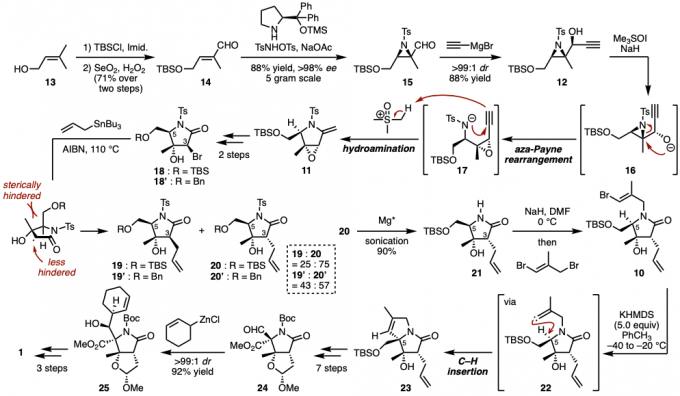
图2. (−)-Salinosporamide A的立体选择合成法
综上所述,作者使用利用Aza-Payne/加氢胺化反应构建吡咯烷骨架、并在合成终盘选择适当的C-H插入反应成功实现了立体选择性的(−)-salinosporamide A (1)的全合成。 该方法有望应用于具有相似骨架的天然产物和衍生物的合成上。
参考文献
- Feling, R. H.; Buchanan, G. O.; Mincer, T. J.; Kauffman, C. A.; Jensen, P. R.; Fenical, W. Angew. Chem., Int. Ed.2003, 42, 355. DOI:10.1002/anie.200390115
- a) Gulder, T. A. M.; Moore, B. S. Angew. Chem., Int. Ed.2010, 49, 9346. DOI: 10.1002/anie.201000728b) Groll, M.; Huber, R.; Potts, B. C. M. J. Am. Chem. Soc. 2006, 128, 5136. DOI:10.1021/ja058320bc) Caubert, V.; Masse, J.; Retailleau, J.; Langlois, N. Tetrahedron Lett. 2007, 48, 381. DOI: 10.1021/ol8016066
- Reddy, L. R.; Saravanan, P.; Corey, E. J. J. Am. Chem. Soc.2004, 126, 6230. DOI:10.1021/ja048613p
- Schomaker, J. M.; Geiser, A. R.; Huang, R.; Borhan, B. J. Am. Chem. Soc.2007, 129, 3794. DOI:10.1021/ja068077w
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!



















No comments yet.