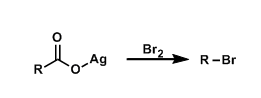
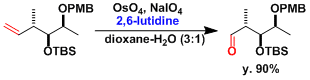- 概要
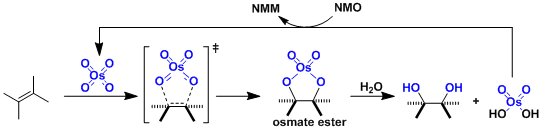
在催化量的四氧化锇和共氧化剂的存在下,烯烃被氧化成邻二醇。通过其他的试剂较难实现的烯烃转化成邻二醇通过此方法能很温和平稳的进行。尽管锇价格相对昂贵,也被频繁使用。
反应常用丙酮/水、或者t-BuOH/水的混合溶剂体系。
作为共氧化剂、处理操作方便的固体试剂N-甲基-N-氧化吗啉(NMO)是最常用的(Upjohn法)。其他的氧化剂如氧化三甲胺(Me3NO)、t-BuOOH(Milas法)、OsCl3-K3Fe(CN)6等也被使用。
用高碘酸钠(NaIO4)做共氧化剂时,生成的二醇会被继续氧化断裂,这样以来、生成相应的羰基化合物(Lemieux-Johnson酸化)。
吡啶等具有配位的胺共存下,能够加速反应。
加入甲磺酰胺(MsNH2)也能起到加速反应的效果(MsNH2能促进中间体锇酸酯的水解)。
与奎宁/奎宁丁衍生的不对称配合物共用时、不对称氧化成二醇也可能(Sharpless Asymmetric Dihydroxylation)。
- 基本文献
・Milas, N. A.; Sussman, S. J. Am. Chem. Soc. 1936, 58,1302. doi:10.1021/ja01298a065
・VanRheenen, V.; Kelly R. C.; Cha, D. Y. Terahedron Lett. 1976, 1973. doi:10.1016/S0040-4039(00)78093-2
・Sharpless, K. B.; Akashi, K. J. Am. Chem. Soc. 1976, 98, 1986. DOI: 10.1021/ja00423a067
・Lemieux-Johnson Oxidation: Pappo, R.; Allen, D. S., Jr.; Lemieux, R. U.; Johnson, W. S. J. Org .Chem. 1956, 21, 478. DOI:10.1021/jo01110a606
<review>
・Cha, J. K.; Kim, N.-S. Chem. Rev. 1995, 95, 1761. DOI: 10.1021/cr00038a003
・Eames, J.; Mitchell, H.; Nelson, A.; O’Brien, P.; Warren, S.; Wyatt, P. J. Chem. Soc. Perkin Trans. 11999, 1095. doi:10.1039/a900277d
・ Francais, A.; Bedel, O.; Haudrechy, A. Tetrahedron 2008, 64, 2495. doi:10.1016/j.tet.2007.11.068
- 反应机理
四氧化锇与烯烃发生[3+2]加成、生成锇酸酯中间体。使催化剂再生,必须通过加水分解饿酸酯。为此,反应通常在含水体系中进行。该加水分解是该催化体系的限速步骤。
- 反应实例
高碘酸钠做共氧化剂时、一锅法是烯烃氧化断裂。2,6-二甲基吡啶添加在体系中可防止副反应。[1]
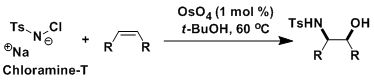
氯胺-T等共存下、可以发生醇胺化。[2]
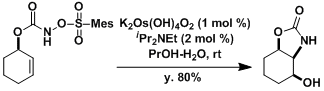
用磺酰氧胺基甲酸酯给分子内引入胺基的例子。[3]
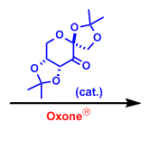
分子中含醇羟基的底物,能发生氧化环化反应。[4]
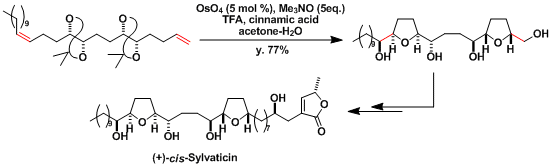
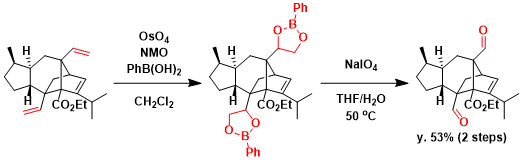
苯硼酸存在下反应进行时,反应性有明显的改善,同时、二醇以苯硼酸酯的形式易于分离[5]。以下是用该条件合成Sordarin的实例。[6]
- 实验步骤
- 实验技巧
环己烯的二醇化[7]
※四氧化锇微型胶囊、不挥发,通过过滤可回收再利用。非常便于操作处理。该试剂和光純薬工業有市售。[8]
※通常的四氧化锇试剂具有挥发性,毒性较大,反应需在通风橱中进行。
- 参考文献
[2] Sharpless, K. B.; Chong, A. O.; O’Shima, K. J. Org. Chem. 1976, 41, 177. DOI:10.1021/jo00863a052
[3] Donohoe, T. J.; Chughtai, M. J.; Klauber, D. J.; Griffin, D.; Campbell, A. D. J. Am. Chem. Soc.2006, 128, 2514. DOI: 10.1021/ja057389g
[4] (a) Donohoe, T. J.; Harris, R. M.; Burrows, J.; Parker, J. J. Am. Chem. Soc. 2006, 128, 13704. DOI:10.1021/ja0660148 (b) Donohoe, T. J.; Wheelhouse, K. M. P.; Lindsay-Scott, P. J.; Churchill, G. H.; Connolly, M. J.; Butterworth, S.; Glossop, P. A. Chem. Asian. J. 2009, 4, 1237. DOI:10.1002/asia.200900168
[5] Iwasawa, N.; Kato, T.; Narasaka, K. Chem. Lett. 1988, 1721. doi:10.1246/cl.1988.1721
[6] Chiba, S.; Kitamura, M.; Narasaka, K. J. Am. Chem. Soc. 2006, 128, 6931. DOI:10.1021/ja060408h
[7] VanRheenen, V.; Kelly R. C.; Cha, D. Y. Terahedron Lett. 1976, 1973. doi:10.1016/S0040-4039(00)78093-2
[8] (a) Nagayama, S.; Endo, M.; Kobayashi, S. J. Org. Chem. 1998, 63, 6094. DOI: 10.1021/jo981127y(b) Kobayashi, S.; Endo, M.; Nagayama, S. J. Am. Chem. Soc. 1999, 121, 11229. DOI:10.1021/ja993099m