本文作者:杉杉
导读
C-H键的定点选择性官能团化作为合成与修饰复杂分子结构的高效途径,为了实现这个目标,必须制定特定的策略来活化远离官能团的C-H键。在这种情况下,由于相邻碳原子之间缺乏电子或空间的差异,从而导致相邻碳原子上远程C-H键的选择性活化变得更加地困难。近日,美国Scripps研究所余金权教授团队在自然化学(Nature Chemistry)杂志上发表论文,报告了一种新型催化体系,利用远程导向模板和瞬态降冰片烯介体,实现选择性地远程C-H键的活化(以前无法实现)。
Differentiation and Functionalization of Remote C-H Bonds in Adjacent Positions
Hang Shi, Yi Lu, Jiang Weng, Katherine L. Bay, Xiangyang Chen, Keita Tanaka,PrithaVerma, Kendall N. Houk and Jin-Quan Yu
Nat. Chem. ASAP DOI: 10.1038/s41557-020-0424-5
正文
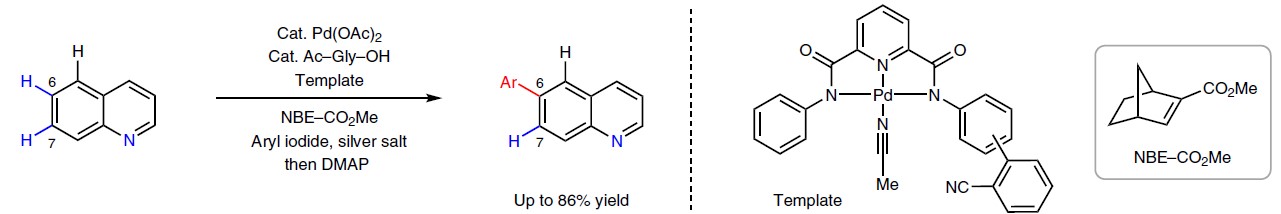
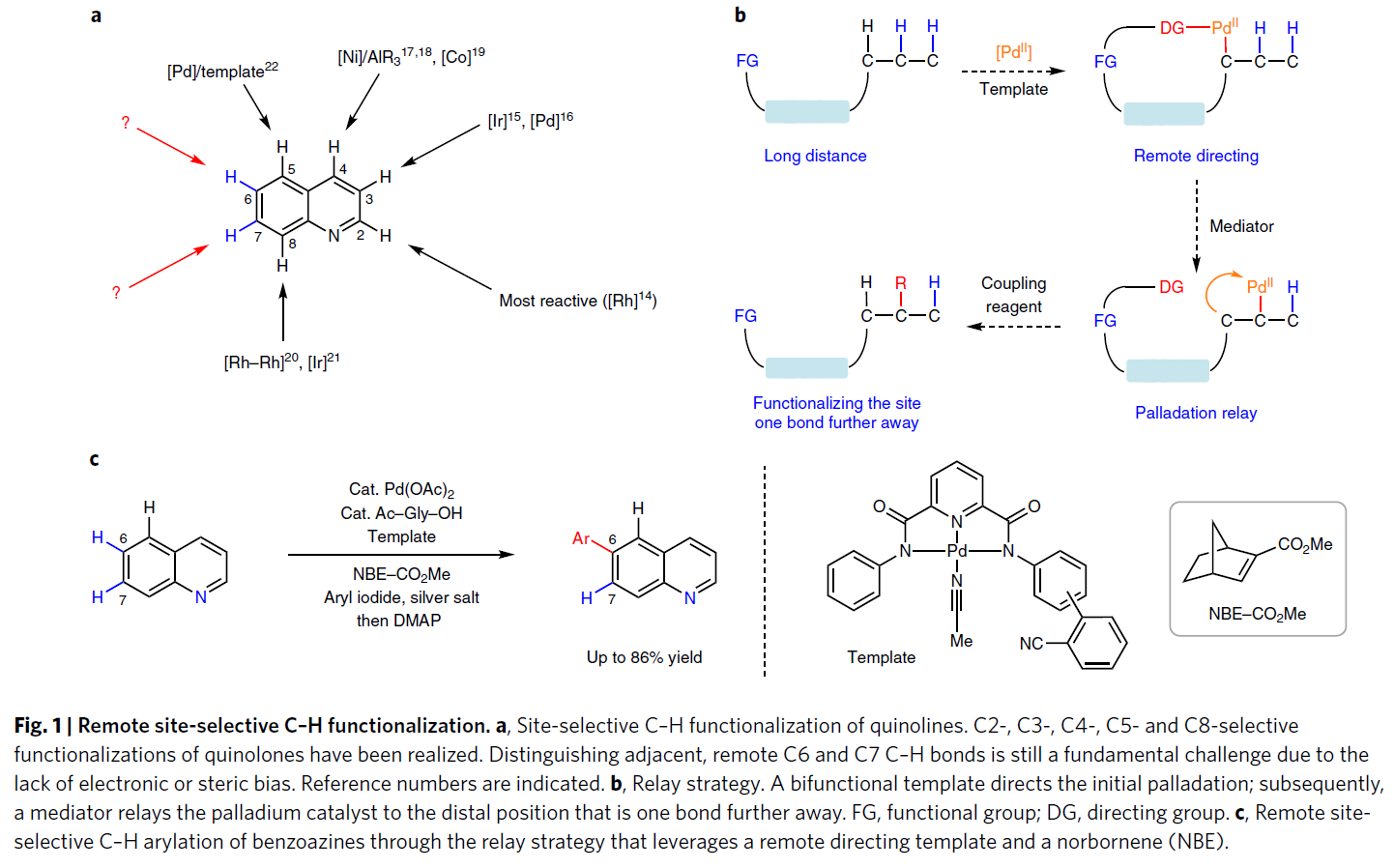
C-H键的定点选择性官能团化作为合成与修饰复杂分子结构的高效途径。远程官能团的C-H键(相距6个以上的键)普遍各类化合物中,而要区分这些电子特性差异不大的C-H键,具有重大的难度。已在天然产物、药物、农药和功能材料中普遍应用的喹啉衍生物,作为此类结构的典型代表,具有多个C-H键并远离螯合的氮原子,从而导致很难通过电子差异加以区分(Fig. 1a)。利用电子和空间偏差,通过螯合辅助,虽然已实现对吖嗪环上C-H键的选择性官能团化,但苯基上的直接C-H活化仅限于C8位置。为了使其余的远程C-H键官能团化,已开发了一种双功能模板,通过与喹啉的氮配位,将钯(Ⅱ)催化剂选择性地引导至远端的C5位置。作者设想,是否可以利用这种远程导向模板来实现其他距离较远C-H键的选择性官能团化。根据(异)喹啉等各类杂环底物计算出的Fukui指数,它们具有类似地缺乏电子特性以及惰性,如果利用导向模板则有可能实现选择性地活化(异)喹啉的远程的C6或C7位置。因此,作者开始研究使用瞬态介质将远程定向效应与单键传递策略相结合的可能性(Fig. 1b)。作者设想模板钯先于远端C5位置结合,再通过降冰片烯将钯转移到C6位置上(Fig. 1c)。该策略不仅可以提区分相邻且具有相似电子和空间特性(如喹啉的C6位置和C7位置)的远程C-H键,同时也可以区分具有电子偏差的远程C-H键(喹啉的C5反应性较高和C6反应性较低)。
为了实现这一目标,远程导向和后续传递步骤的模板设计面临着多种挑战,从而需要精心设计才能解决(腈模板、降冰片烯和配体的分子结构等)。首先,竞争性结合降冰片烯可以防止由弱配位的腈模板引起的C-H钯键断裂。另一方面,形成的大环C-H钯中间体具有高反应活性。其次,降冰片烯传递的金属-C-H活化(高度复杂的多步骤序列),只能使用有限的单齿吡啶和吡啶酮类型的配体。相反,弱配位的腈模板通常需要一组不同的双齿配体用于远程导向。最后,降冰片烯传递中的β-碳消除步骤始终依赖于与最初形成的钯-碳键相邻的邻向基团。但是,远程导向基团距离较远,无法提供必要的空间障碍。
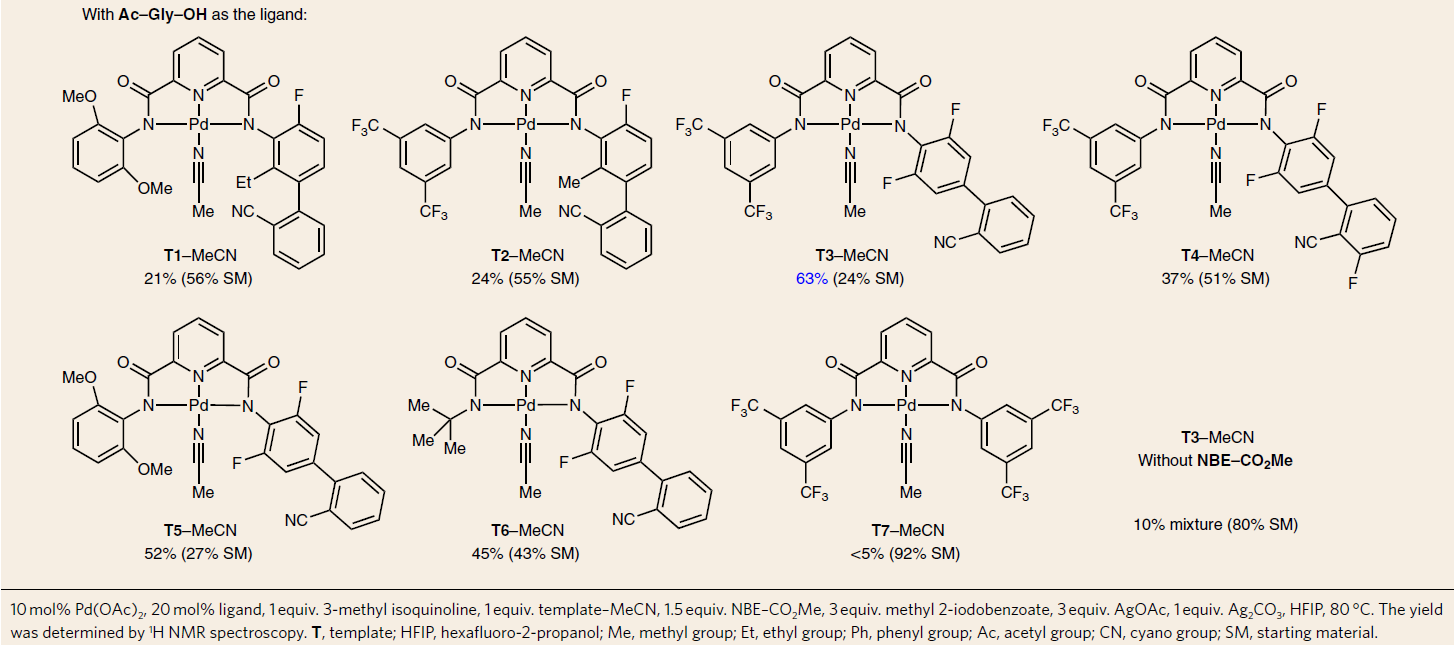
由于喹啉和异喹啉衍生物在药物合成中具有重要的价值,因此,作者选择了3-甲基-异喹啉1a作为模型底物,进行了相关条件的筛选(Table 1)。首先,作者使用之前报道可选择性进行喹啉C5位置的C-H钯化的模板T1,同时考虑到吡啶酮和吡啶型配体对于降冰片烯衍生物实现Pd催化剂传递至关重要,因此作者尝试使用单齿配体(L1,L2,L3,L4)对异喹啉底物进行C6芳基化。然而,由于吡啶酮和吡啶的存在下,弱配位的腈导向基团被阻止结合到Pd(Ⅱ)上,从而导致低的反应性。为了确保腈基导基团的配位,作者决定使用带有弱配位基团的双齿配体(配体L5,L6和L7)。当使用N-乙酰甘氨酸(Ac-Gly-OH,L5)时,可获得所需的C6芳基化的异喹啉产物2a,收率21%。值得注意的是,MPAA配体的羧酸基团被强配位基团(N-杂环)取代(双齿配体L8和L9)时,导致反应性降低(收率<5%),从而说明将导向模板和降冰片烯与特定配体相结合的重要性。因此,作者开始研究各类含腈的模板。首先,使用富电子的CF3(T2)代替苯基上的OCH3(T1)时,可使产率稍微提高到24%。而将引导苯基腈部分从右翼的间位转变为对位(T3)时,收率大幅提高(63%)。这些结果与远程C-H活化中基于距离和几何形状的定点选择性观点相一致。模板的其他结构变化会导致产率降低(T4,T5和T6),同时缺少腈部分(T7)或降冰片烯试剂也会导致所需反应性的损失。
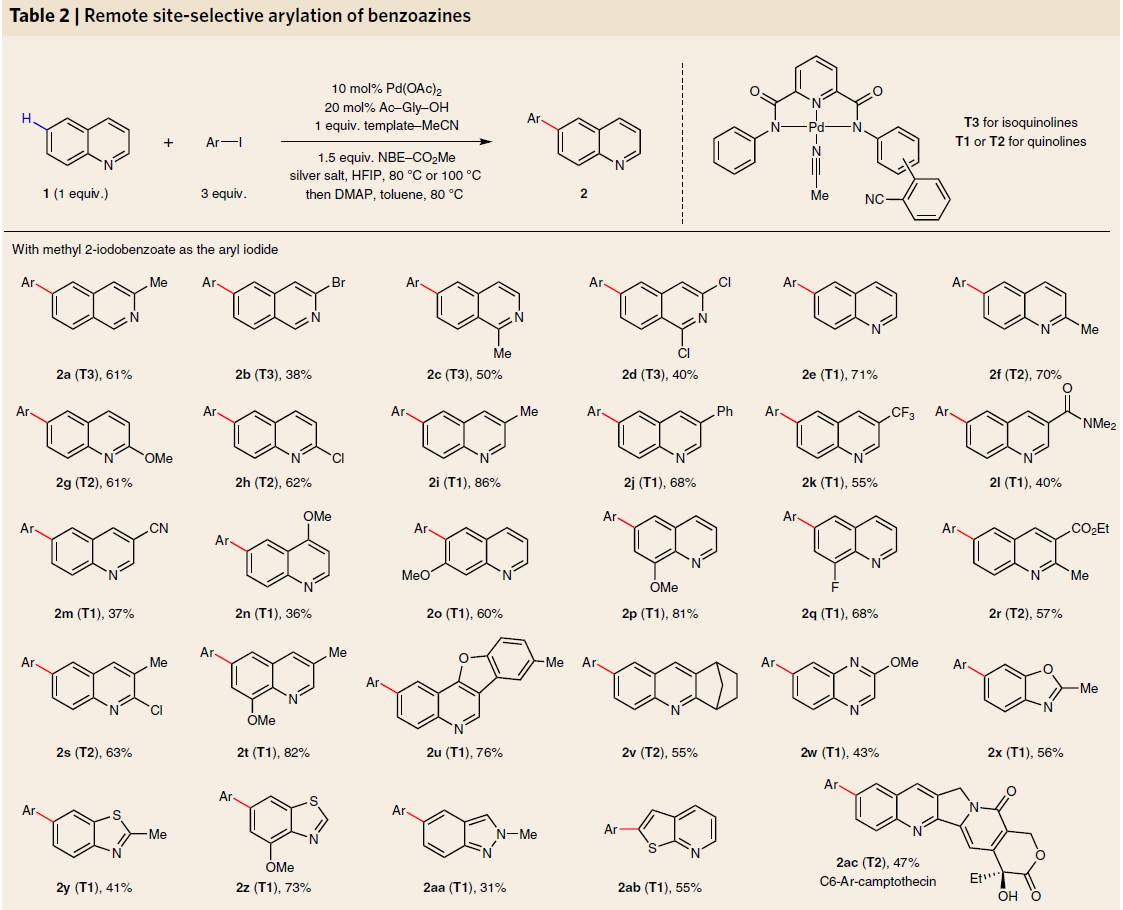
在获得上述最佳反应条件后,作者开始对喹啉底物1进行了扩展(Table 2)。首先,当以不同取代的异喹啉作为底物时,使用模板T3,可获得中等收率的C6芳基化产物2a–2d,其中2b和2d含有卤原子,可为后期修饰提供多种可能。此外,使用模板T1或T2时,可获得多种喹啉衍生物。如使用简单喹啉可获得71%收率的2e,使用在喹啉的C2、C3、C4、C7或C8取代基均可获得相应的产物2f–2q,同时该反应不受电子效应的影响。此外,由于存在配位腈(与模板竞争)和C4取代(阻碍C5 钯化)从而导致2m和2n的收率偏低。双取代的喹啉(2r–2t)、
多环喹啉(2u–2v)均取得较好的结果。同时,也合成大量的苯并嗪衍生物,如喹喔啉(2w)、苯并恶唑(2x)、苯并噻唑(2y–2z)、吲唑(2aa)和噻吩并吡啶(2ab)。最为重要的是,也成功的对抗白血病和抗肿瘤生物碱喜树碱(camptothecin,2ac)进行相关的后期修饰,进而可合成其衍生的拓扑替康(topotecan,治疗结肺癌新药)和伊立替康(irinotecan,治疗结肠癌新药)的药物。
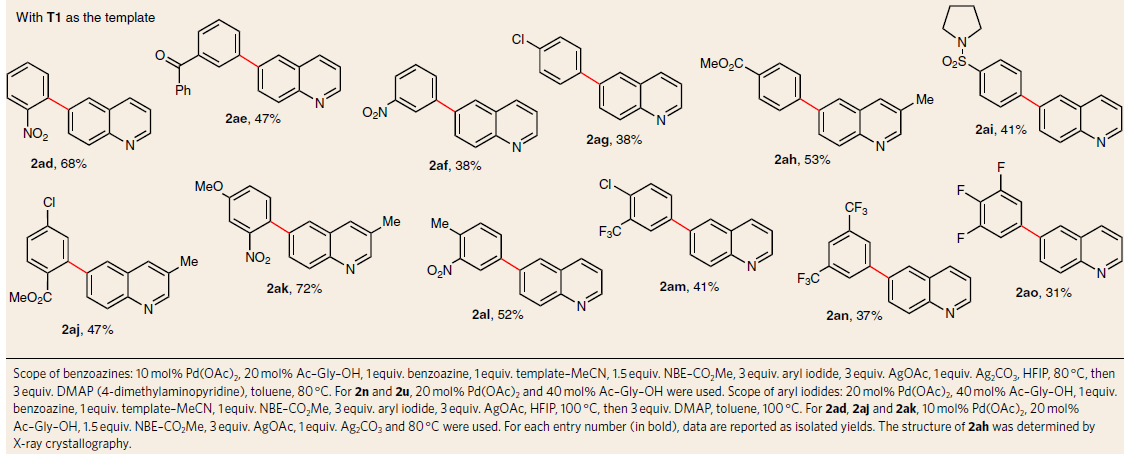
随后,作者以喹啉为底物,对芳基碘化物的范围进行了研究(Table 2)。当使用邻、间和对的单取代芳基碘化物时,均以中等收率获得所需的产物2ad–2ai。此外,二和三取代的芳基碘化物同样以中等至良好的产率得到所需产物2aj–2ao。但富电子的芳基碘化物仅获得低于15%的收率产物,这意味着将芳基碘化物氧化加成到钯环中并不容易,相比之下,这些富电子芳基碘化物的反应性可以通过连接一个吸电子基团来恢复,如2ak可将收率提高至72%。
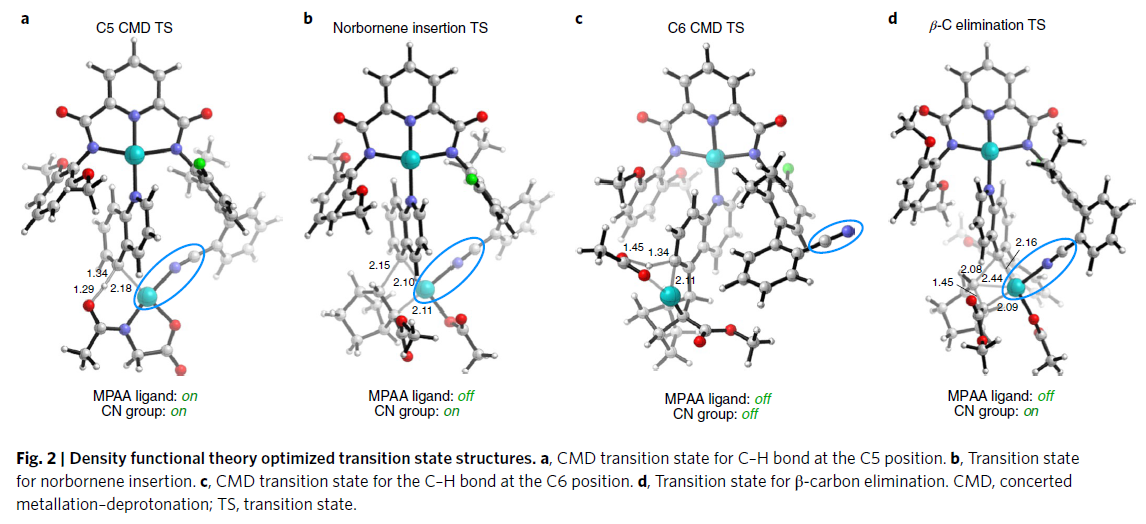
尽管先前已分别显示了腈定向的远程C-H 钯化和降冰片烯从邻位到间位的传递,但这两个过程如何在如此复杂的催化循环中成功的实现仍然令人费解。计算研究提供了复杂C-H功能化机制的详细信息,该机制利用双功能模板与两个Pd金属中心配位。下图分别显示了C5 CMD(协同金属化-去质子化)、降冰片烯插入、C6 CMD和β-碳消除的过渡态结构(Fig. 2)。Pd模板允许腈基引导第二个Pd催化剂到达喹啉的C5位置,但是腈基必须在Pd中心上下移动才能进行催化循环。MPAA配体促进了第一步C5 CMD步骤,通过解离提供空位的配位点,用于降冰片烯插入。这些研究揭示了将腈模板和降冰片烯瞬态介体的结合并用于钯传递的复杂性。
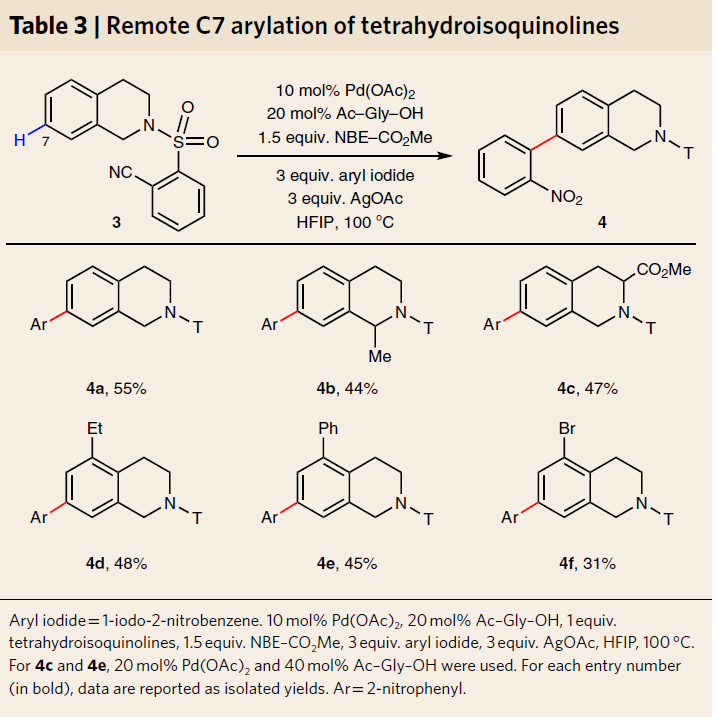
紧接着,为了进一步测试这种策略是否可以广泛用于区分其它远程相邻的C-H键,作者选择带有共价连接的U形芳烃模板作为底物(Table 3)。反应结果表明,可实现四氢异喹啉的C7芳基化反应,底物也具有良好的兼容性,如无取代(4a)、1-甲基(4b)、3-羧酸盐(4c)、5-乙基(4d)、5-苯基(4e)和5-溴(4f)。
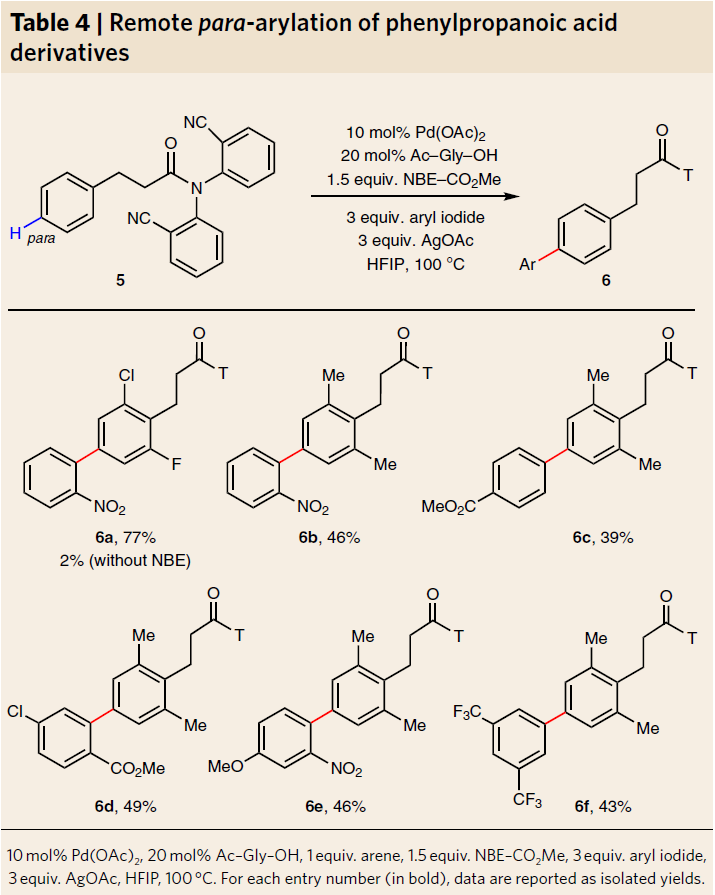
同时,苯基丙酸衍生物5的也可通过上述方法进行芳基化反应(Table 4)。如常规的苯基丙酸衍生物5a和5b,分别可获得联芳基产物6a和6b。此外,含有卤素、吸电子和给电子的芳基碘化物也与体系兼容,获得中等产率的6c–6f。
总结
美国Scripps研究所余金权教授团队报道了,一种新型策略来区分远程C-H键,结合以前的模板化学方法,可实现对远程C-H键的定点活化。如喹啉以及异喹啉衍生物的C6和C7位置的定点C-H活化,同时该方法也对生物碱喜树碱进行了相关的修饰,进一步证明了实用性。此外,远程导向模板、瞬态介质降冰片烯和MPAA配体之间的精巧合作,揭示了C-H活化催化体系的巨大潜力。
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!



















No comments yet.