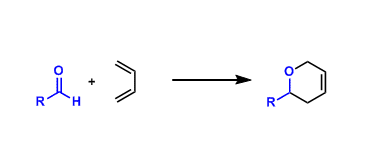
概要
Murai-Chatani-Kakiuchi反应 (Murai-Chatani-Kakiuchi Reaction)是钌催化剂 (Ru3(CO)12, RuH2(CO)(PPh3)3及[Ru(p-cymene)Cl2] 2等)参与的邻位导向C-H键活化/官能团化反应 (ortho-directed C-H bond activation/functionalization reaction) [1]。该反应由日本大阪大学 (大阪大学,Osaka university)的村井真二 (村井 真二,Murai Shinji)、 茶谷直人 (茶谷 直人, Chatani Naoto)及垣内史敏 (垣内 史敏,Kakiuchi Fumishito) 等在1993年首次报道,Murai-Chatani-Kakiuchi为首例通过螯合辅助,即通过导向基促进的芳香酮及杂芳香酮类化合物与烯烃之间的区域选择性芳基C-H键官能团化反应[1]。
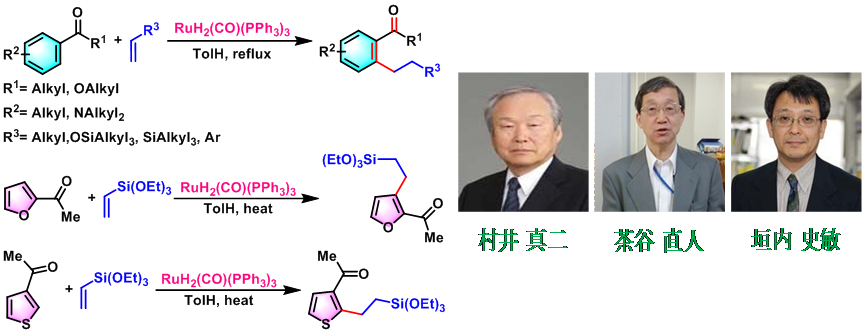 1995年,Murai研究组对芳香酮及烯烃底物的应用范围进行了深入研究[2],并将底物范围扩展至环状共轭烯酮[3]。
1995年,Murai研究组对芳香酮及烯烃底物的应用范围进行了深入研究[2],并将底物范围扩展至环状共轭烯酮[3]。
1996年,Murai采用Ru3(CO)12催化剂,将底物扩展至芳亚胺,并获得优良的产率及区域选择性[4]。
1997年,Murai继续采用Ru3(CO)12催化剂,成功完成了苯环C-H键的羰基化[5]。
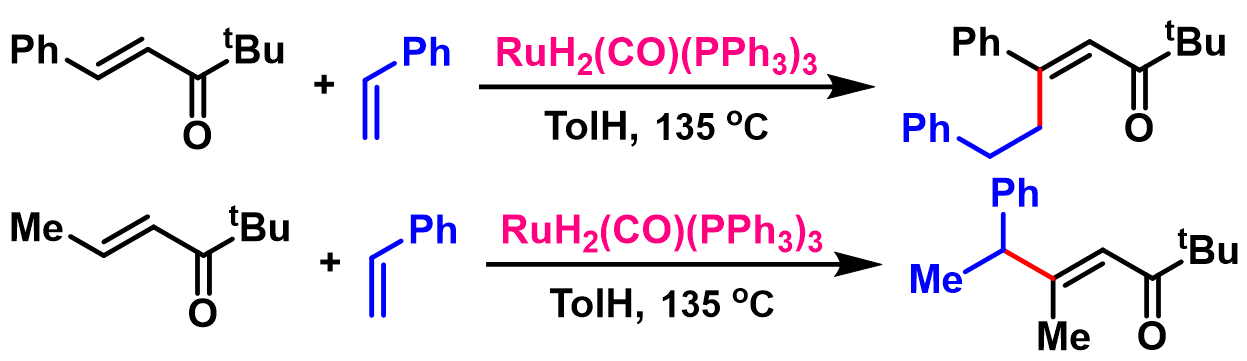
1997年,Murai采用RuH2(CO)(PPh3)3催化剂,成功完成非环共轭烯酮烯基C-H键的官能团化反应,同时对反应机理进行了研究[6]。
随后,Murai研究发现,采用不同的钌催化剂,可以有效地调控芳基底物C-H键烷基化过程的区域选择性,同时还可获得极佳的催化剂专一性[7]。
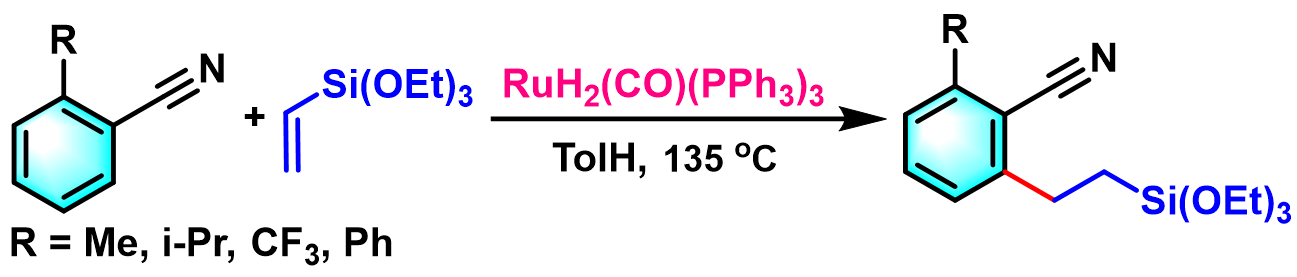
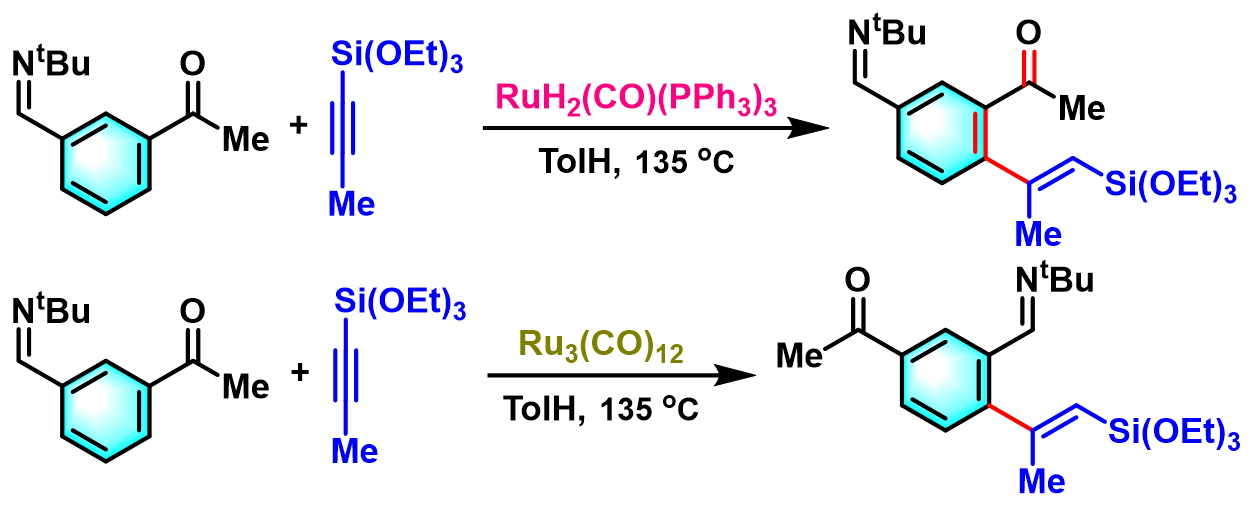
1999年,Murai等发现芳基腈在RuH2(CO)(PPh3)3催化剂存在的条件下,同样可以完成与烯烃的区域选择性芳基C-H键烷基化反应[8], [12]。
同年,Murai研究组进一步完成了芳基酰亚胺酯的C-H键烯基化反应[9], [12]。
2001年,Murai等进一步将反应底物扩展至芳香醛[10]与环状共轭烯醛[10]及芳腙[11], [12],并获得优良的产率与区域选择性[10]。
2002年,Murai完成了钌催化剂促进的炔烃对共轭烯酮C-H键的官能团化反应,成功获得共轭二烯酮,反应具有优良的区域及立体选择性[13]。
2003年,Kakiuchi采用钌催化剂,顺利实现了芳香硼酸酯对芳酮C-H键的官能团化过程,并取得良好的区域选择性[14]。之后,Kakiuchi对底物范围及反应机理进行了深入研究[15]。2007年,Kakiuchi又将其扩展至烯基硼酸酯[16],顺利完成芳酮C-H键的区域选择性烯基化。2010年,Kakiuchi通过进一步研究发现,加入苯乙烯可以有效地控制该反应的区域选择性[17]。
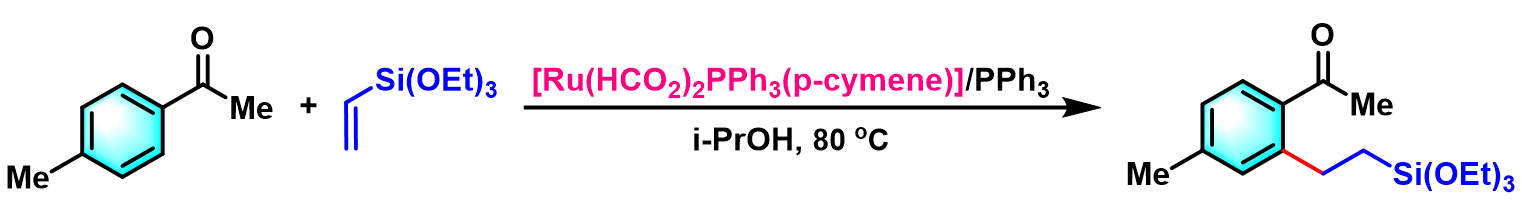
2006年,S. Darses与J. P. Genet采用活性更高的[Ru(p-cymene)Cl2] 2催化剂,使反应产率与区域选择性获得极大提升[18]。
2008-2009年,S. Darses与J. P. Genet采用原位生成的[Ru(p-cymene)Cl2] 2催化剂,成功将[Ru(p-cymene)Cl2]2催化下的底物范围扩展至苯乙烯,同样可获得优良的区域选择性[19]-[20]。
2009年,S. Darses与J. P. Genet将[Ru(p-cymene)Cl2] 2催化的反应条件成功扩展至各类Michael加成受体,同时获得优良的产率及优良的Michael受体β-区域选择性[21]。
2010年,S. Darse通过更廉价的三氯化钌水合物,使芳酮C-H键烷基化的反应条件更加温和。同时,具有更为优良的官能团兼容性及优良的区域选择性[22]。
之后,S. Darse发现采用质子溶剂如异丙醇,可以使反应温度进一步降低,同时可保持优良的产率及区域选择性[23]。
Murai-Chatani-Kakiuch反应具有优良的产率、官能团兼容性与区域选择性及温和的反应条件。目前,该反应已成为sp 2 C-H键官能团化的强有力方法[24]-[27]。
基本文献
- [1] S. Murai, F. Kakiuchi, S. Sekine, Y. Tanaka, A. Kamatani, M.Sonoda, N. Chatani, Nature 1993, 366, 529. doi: 10.1038/366529a0.
- [2] F. Kakiuchi, S. Sekine, Y. Tanaka, A. Kamatani, M. Sonoda, N. Chatani, S. Murai, Bull. Chem. Soc. Jpn. 1995, 68, 62. doi: 10.1246/bcsj.68.62.
- [3] F. Kakiuchi, Y. Tanaka, T. Sato, N. Chatani, S. Murai, Chem. Lett. 1995, 679. doi: 10.1246/cl.1995.679.
- [4] F. Kakiuchi, M. Yamauchi, N. Chatani, S. Murai, Chem. Lett. 1996, 111. doi: 10.1246/cl.1996.111.
- [5] N. Chatani, Y. Ie, F. Kakiuchi, S. Murai, J. Org. Chem. 1997, 62, 2604. doi: 10.1021/jo970131r.
- [6] T. Sato, F. Kakiuchi, N. Chatani, S. Murai, Chem. Lett. 1998, 893. doi: 10.1246/cl.1998.893.
- [7] F. Kakiuchi, T. Sato, T. Tsujimoto, M. Yamauchi, N. Chatani, S. Murai, Chem. Lett. 1998, 27, 1053. doi: 10.1246/cl.1998.1053.
- [8] F. Kakiuchi, M. Sonoda, T. Tsujimoto, N. Chatani, S. Murai, Chem. Lett. 1999, 1083. doi: 10.1246/cl.1999.1083.
- [9] F. Kakiuchi, T. Sato, M. Yamauchi, N. Chatani, S. Murai, Chem. Lett. 1999, 19. doi: 10.1246/cl.1999.19.
- [10] F. Kakiuchi, T. Sato, K. Igi, N. Chatani, S. Murai, Chem. Lett. 2001, 386. doi: 10.1246/cl.2001.386.
- [11] F. Kakiuchi, T. Tsujimoto, M. Sonoda, N. Chatani, S. Murai, Synlett 2001, 948. doi: 10.1055/s-2001-14630.
- [12] F. Kakiuchi, S. Murai, Acc. Chem. Res. 2002, 35, 826. doi: 10.1021/ar960318p.
- [13] F. Kakiuchi, T. Uetsuhara, Y. Tanaka, N. Chatani, S. Murai, J. Mol. Catal. A: Chem. 2002, 182, 511. doi: 10.1016/S1381-1169(01)00500-3.
- [14] F. Kakiuchi, S. Kan, K. Igi, N. Chatani, S. Murai, J. Am. Chem. Soc. 2003, 125, 1698. doi: 10.1021/ja029273f.
- [15] F. Kakiuchi, Y. Matsuura, S. Kan, N. Chatani, J. Am. Chem. Soc. 2005, 127, 5936. doi: 10.1021/ja043334n.
- [16] S. Ueno, N. Chatani, F. Kakiuchi, J. Org. Chem. 2007, 72, 3600. doi: 10.1021/jo070182g.
- [17] S. Hiroshima, D. Matsumura, T. Kochi, F. Kakiuchi, Org. Lett. 2010, 12, 5318. doi: 10.1021/ol102325f.
- [18] R. Martinez, R. Chevalier, S. Darses, J. P. Genet, Angew. Chem. Int. Ed. 2006, 45, 8232. doi: 10.1002/anie.200603786.
- [19] R. Martinez, J. P. Genet, S. Darses, Chem. Commun. 2008, 3855. doi: 10.1039/B806121A.
- [20] R. Martinez, M. O. Simon, R. Chevalier, C. Pautigny, J. P. Genet, S. Darses, J. Am. Chem. Soc. 2009, 131, 7887. doi: 10.1021/ja9017489.
- [21] M. O. Simon, R. Martinez, J. P. Genet, S. Darses, Adv. Synth. Catal. 2009, 351, 153. doi: 10.1002/adsc.200800600.
- [22] M. O. Simon, J. P. Genet, S. Darses, Org. Lett. 2010, 12, 3038. doi: 10.1021/ol101038c.
- [23] M. O. Simon, R. M. J. P. Genet, S. Darses, J. Org. Chem. 2010, 75, 208. doi: 10.1021/jo902264u.
- [24] S. Murai, N. Chatani, F. Kakiuchi, Pure Appl. Chem. 1997, 589. doi: 10.1351/pac199769030589.
- [25] R. Grigg, V. Savic, Tetrahedron Lett. 1997, 38, 5737. doi: 10.1016/S0040-4039(97)01260-4.
- [26] F. Kakiuchi, N. Chatani, Adv. Synth. Catal. 2003, 345, 1077. doi: 10.1002/adsc.200303094.
- [27] P. B. Arockiam, C. Bruneau, P. H. Dixneuf, Chem. Rev. 2012, 112, 5879. doi: 10.1021/cr300153j.
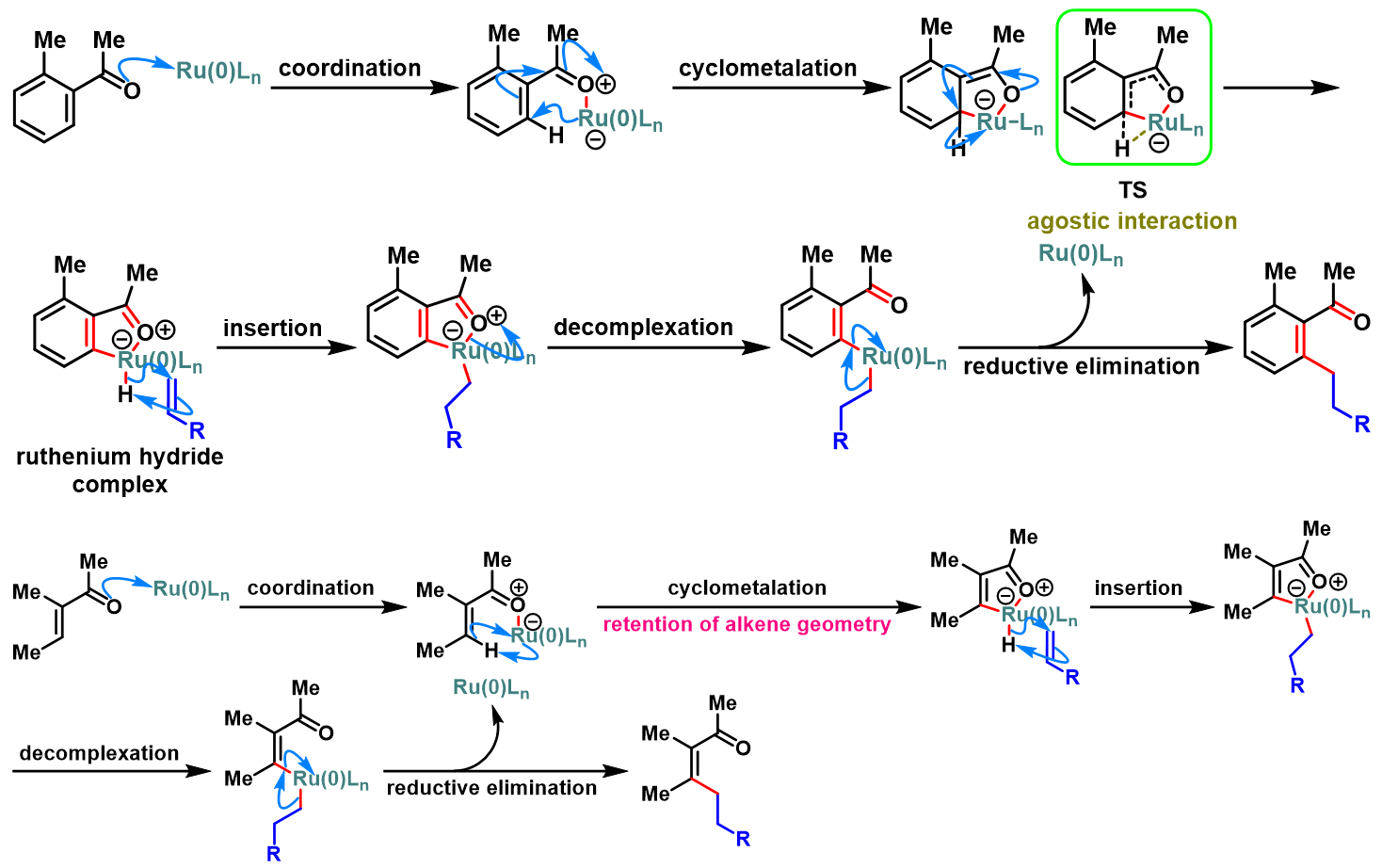
反应机理
- [1] S. Murai, F. Kakiuchi, S. Sekine, Y. Tanaka, A. Kamatani, M. S onoda, N. Chatani, Pure Appl. Chem. 1994, 66, 1527. doi: 10.1351/pac199466071527.
- [2] B. M. Trost, K. Imi, I. W. Davies, J. Am. Chem. Soc. 1995, 117, 5371. doi: 10.1021/ja00124a025.
- [3] T. Matsubara, N. Koga, D. G. Musaev, K. Morokuma, J. Am. Chem. Soc. 1998, 120, 12692. 10.1021/ja9816943.
- [4] T. Matsubara, N. Koga, D. G. Musaev, K. Morokuma, Organometallics 2000, 19, 2318. 10.1021/om0001220.
- [5] F. Kakiuchi, H. Ohtaki, M. Sonoda, N. Chatani, S. Murai, Chem. Lett. 2001, 918. doi: 10.1246/cl.2001.918.
- [6] F. Kakiuchi, T. Kochi, Synthesis 2008, 3013. doi: 10.1055/s-2008-1067256.
- [7] F. Kakiuchi, T. Kochi, E. Mizushima, S. Murai, J. Am. Chem. Soc. 2010, 132, 17741. doi: 10.1021/ja104918f.
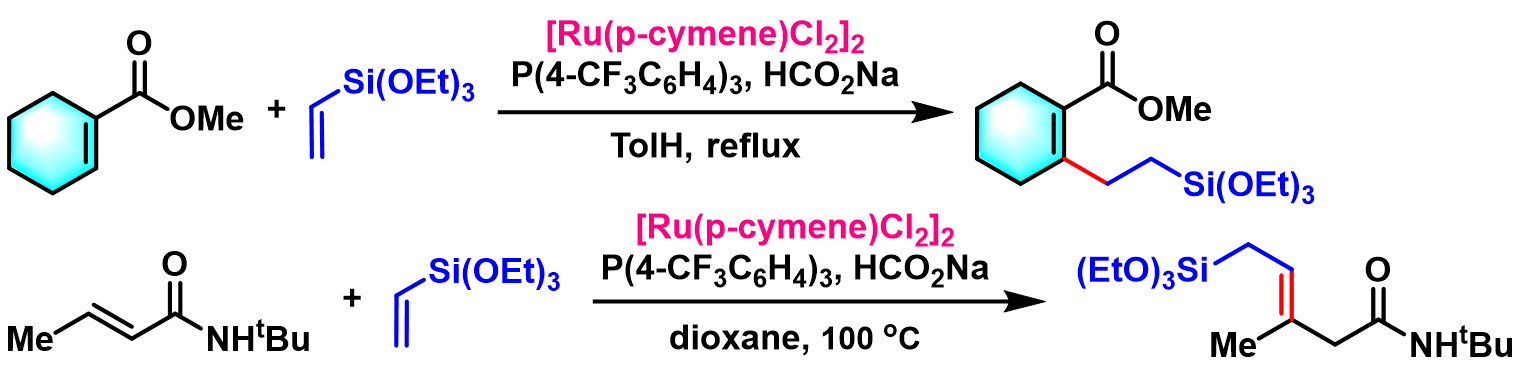
反应实例
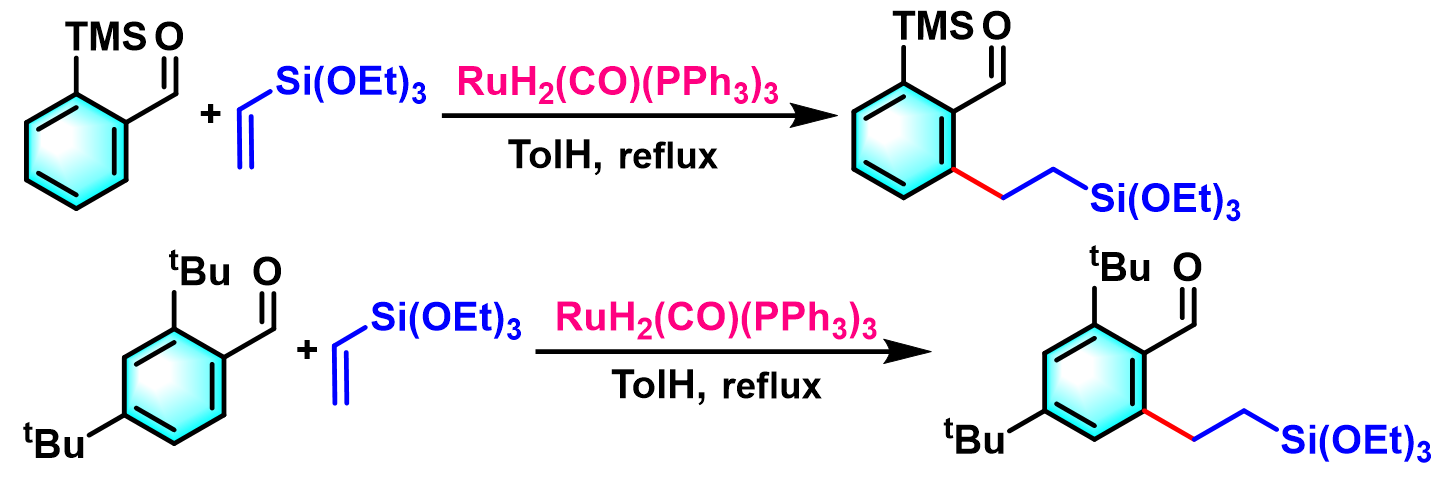
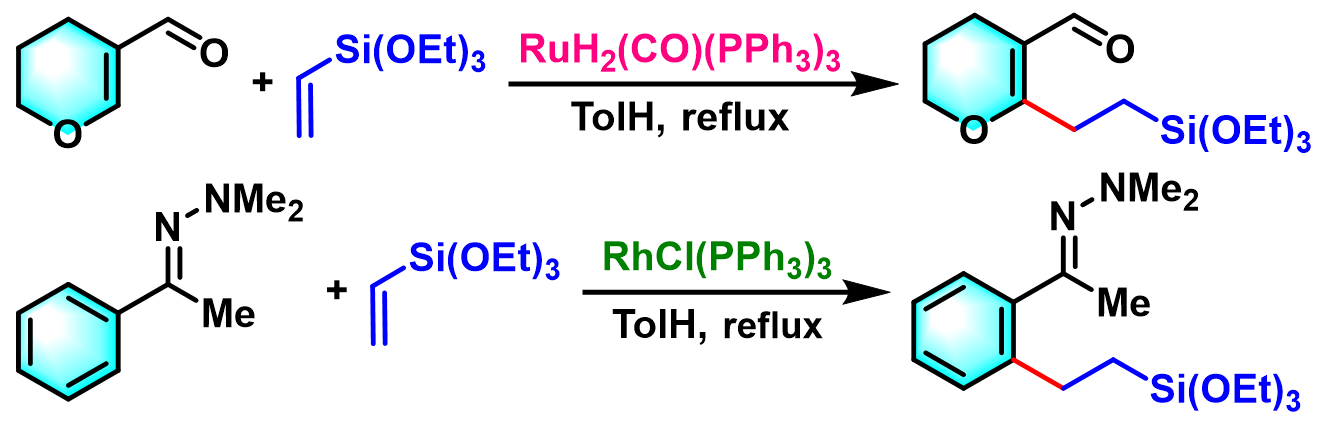
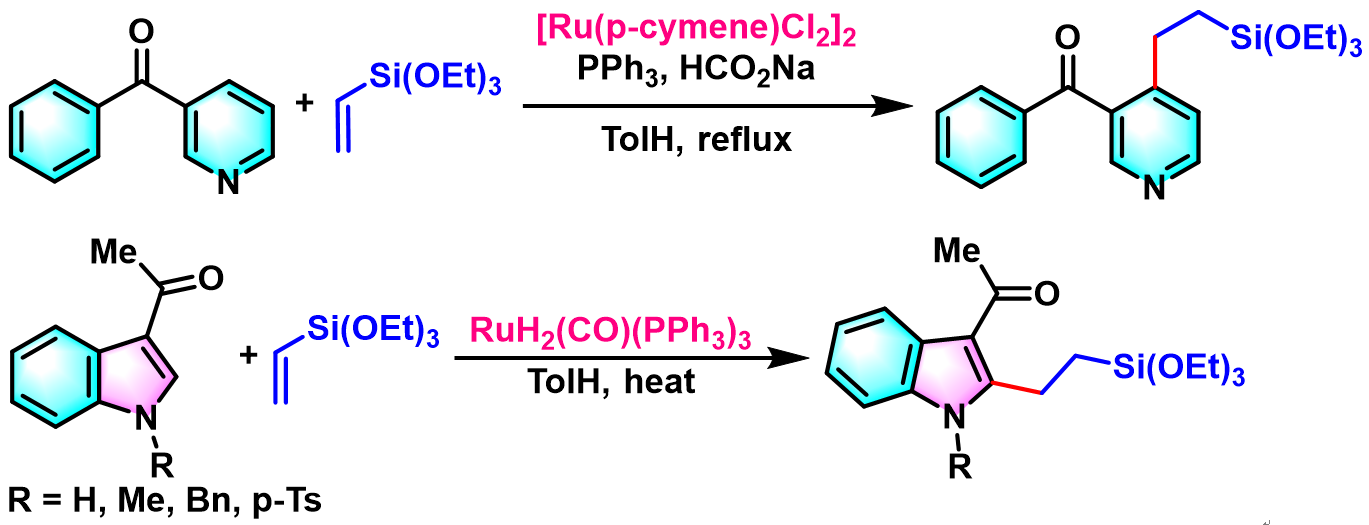
芳酮与亚胺的官能团化[1]
tandem醇氧化/C-H键官能团化[2]
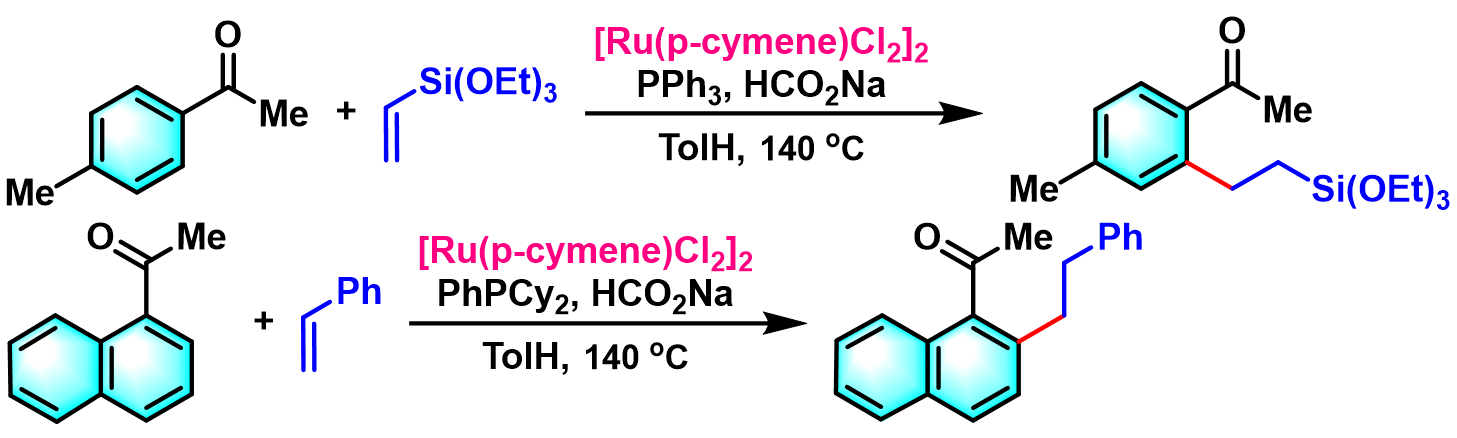
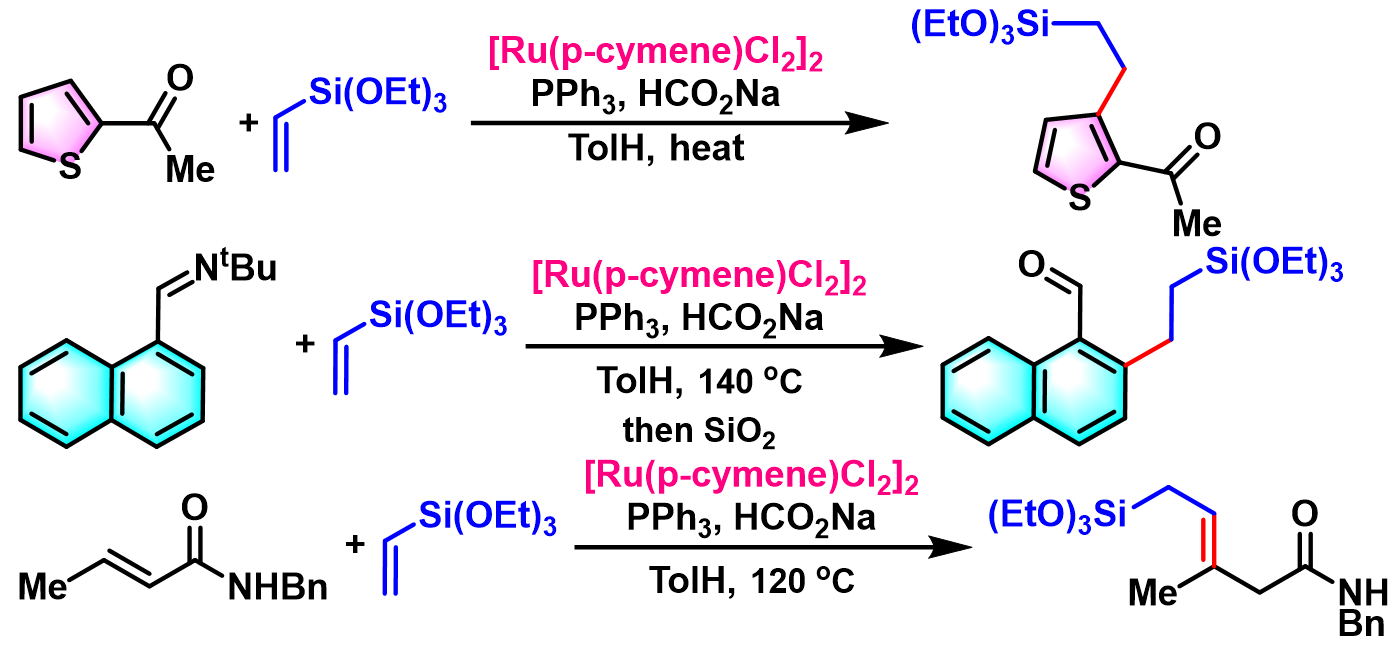
杂芳酮的区域选择性官能团化[3]
芳香酸酯的官能团化[4]
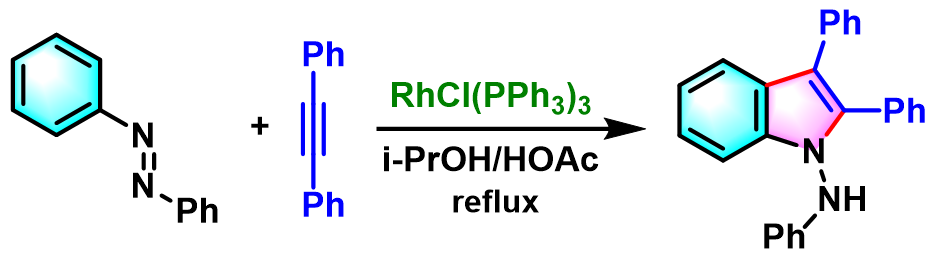
杂环化合物的合成[5]-[7]
实验步骤
氮气气氛下,向圆底烧瓶中加入钌催化剂 (0.02 eq.),随后,加入无水甲苯 (维持底物浓度0.67 M)、芳酮 (1 eq.)及三乙氧基乙烯基硅烷 (1 eq.)。将上述反应混合物在135oC下进行加热 (回流)搅拌,通过GC监控 (十六烷作为内标物),直至反应结束。反应结束后,将反应混合物冷却至室温,并在减压条件下除去溶剂。残余物通过短硅胶柱,加入正己烷洗涤除去十六烷及膦配体如三苯基膦(源自钌催化剂)。随后,加入乙酸乙酯洗脱,将洗脱液合并,减压除去溶剂后,通过Kugelrohr蒸馏的方式进行分离纯化获得相应目标产物。
参考文献
- [1] F. Kakiuchi, T. Sato, T. Tsujimoto, M. Yamauchi, N. Chatani, S. Murai, Chem. Lett. 1998, 27, 1053. doi: 10.1246/cl.1998.1053.
- [2] M. O. Simon, G. Ung, S. Darses, Adv. Synth. Catal. 2011, 353, 1045. doi: 10.1002/adsc.201000884.
- [3] R. Grigg, V. Savic, Tetrahedron Lett. 1997, 38, 5737. doi: 10.1016/S0040-4039(97)01260-4.
- [4] M. Sonoda, F. Kakiuchi, A. Kamatani, N. Chatani, S. Murai, Chem. Lett. 1996, 109. doi: 10.1246/cl.1996.109.
- [5] G. Halbritter, F. Knoch, A. Wolski, H. Kisch, Angew. Chem. Int. Ed. 1994, 33, 1603. doi: 10.1002/anie.199416031.
- [6] U. R. Aulwurm, J. U. Melchinger, H. Kisch, Organometallics 1995, 14, 3385. doi: 10.1021/om00007a045.
- [7] U. Dürr, H. Kisch, Synlett 1997, 1335. doi: 10.1055/s-1997-1035.
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!


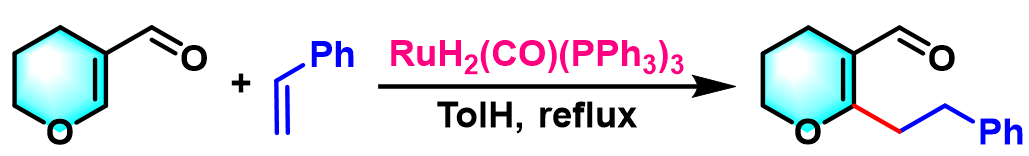
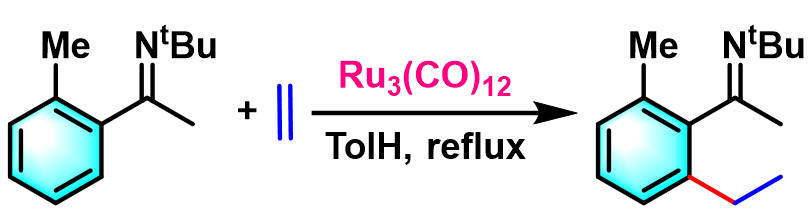
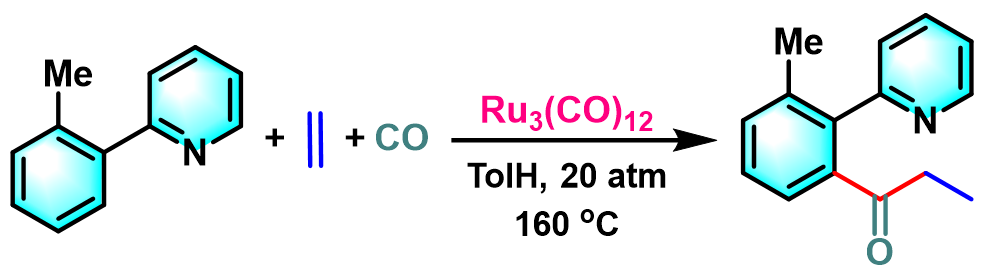

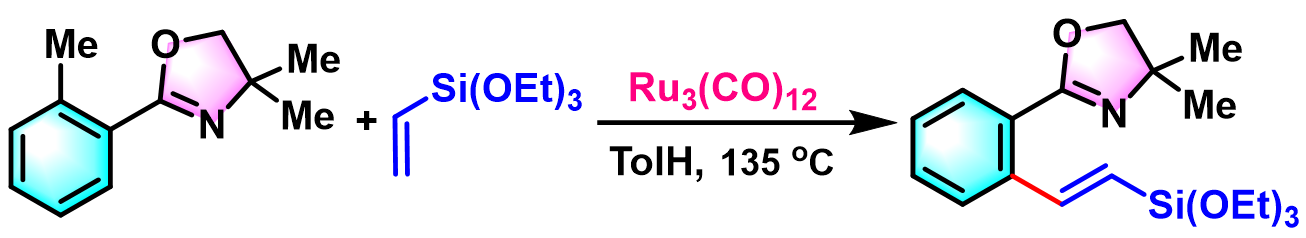



















No comments yet.