本文作者:自由基先生
导读:
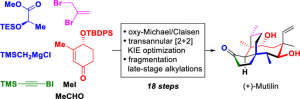
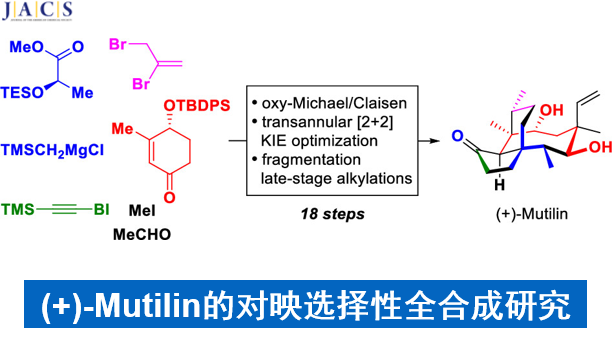
近日,北京大学罗佗平课题组在J. Am.Chem. Soc.中发表论文,报道一种全新的(+)-mutilin对映选择性全合成路线设计。这一全合成路线设计中的关键步骤主要涉及:通过Claisen重排策略构建6,9-双环骨架;通过跨环[2+2]光环加成以及开环反应步骤,完成5-6-8类螺桨烷骨架的构建;通过后期烷基化与还原步骤,最终完成(+)-mutilin的对映选择性全合成。
Total Synthesis of (+)-Mutilin: A Transannular [2+2] Cycloaddition/ Fragmentation Approach, H. Chen, Z. Li, P. Shao, H. Yuan, S. Chen, T. Luo, J. Am. Chem. Soc. 2022, ASAP. doi: 10.1021/jacs.2c06934.
正文:
目前,从头全合成 (de novo total synthesis)策略已经成功应用于pleuromutilin的全合成研究 (Figure 1, 1)[1]–[3]。由于(+)-pleuromutilin及其去酰基衍生物 (+)-mutilin (2)能够相互转化[4],同时,均具有较为独特的5-6-8 元环稠合的多重官能团化碳环骨架,因此备受有机合成化学家的广泛关注 (Figure S1) [3], [5]–[9]。这里,罗佗平研究团队报道一种全新的通过跨环[2+2]光环加成/碎片化策略进行的(+)-mutilin(2)对映选择性全合成路线设计。
首先,作者通过逆合成分析 (Figure 1)表明,这一全合成路线设计中的关键反应步骤主要涉及:烷基化/还原;Claisen重排;跨环[2+2]光环加成/碎片化;oxy-Michael加成/O-保护以及非对映选择性共轭加成/炔基化/异构化。关键的砌块与试剂主要涉及6、联烯酮7、烯酮9、烯基锂8以及TES-EBX 10。
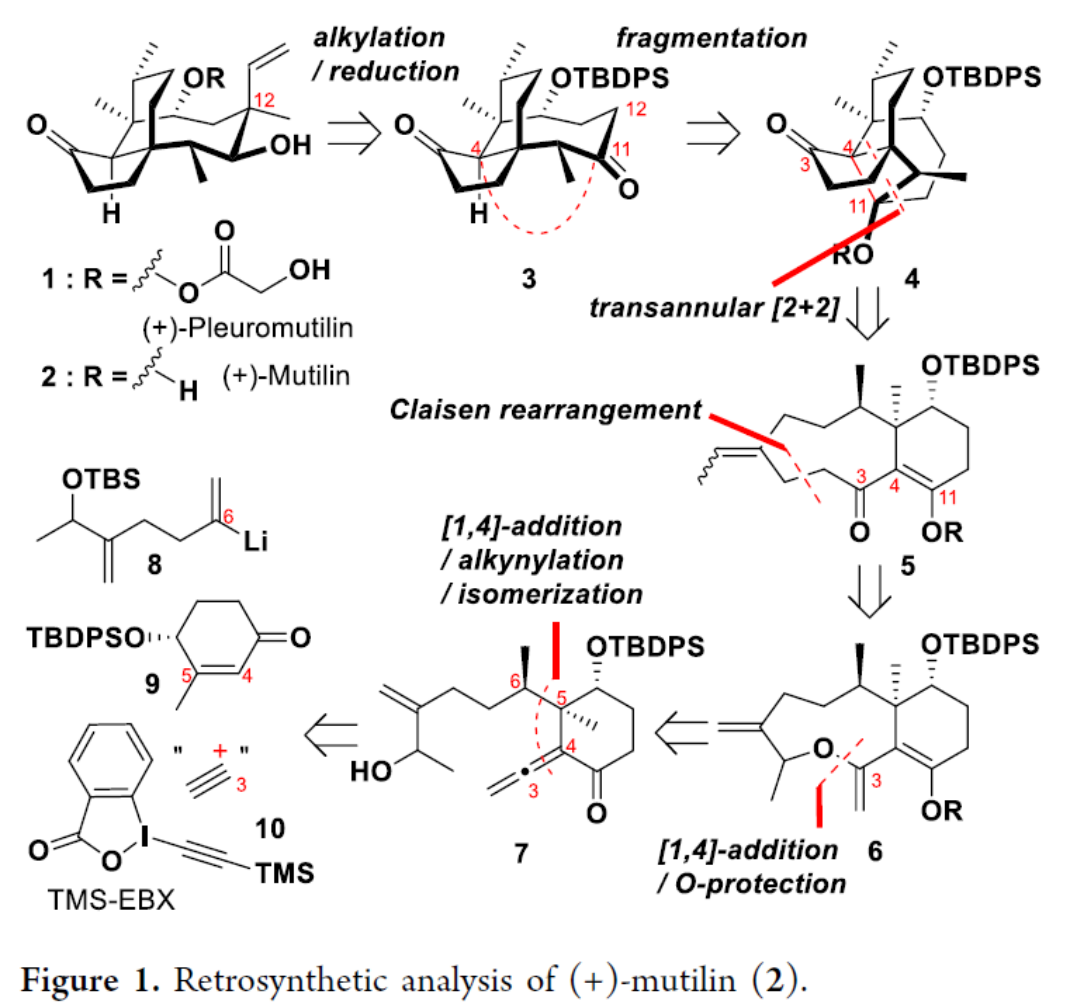
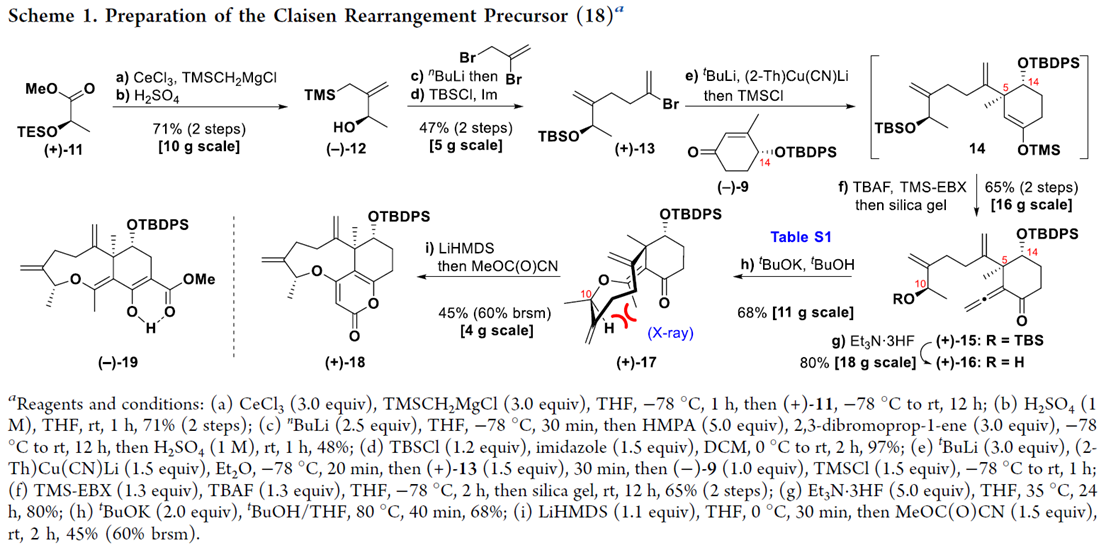
之后,作者首先进行Claisen重排前体18的构建 (Scheme 1)。

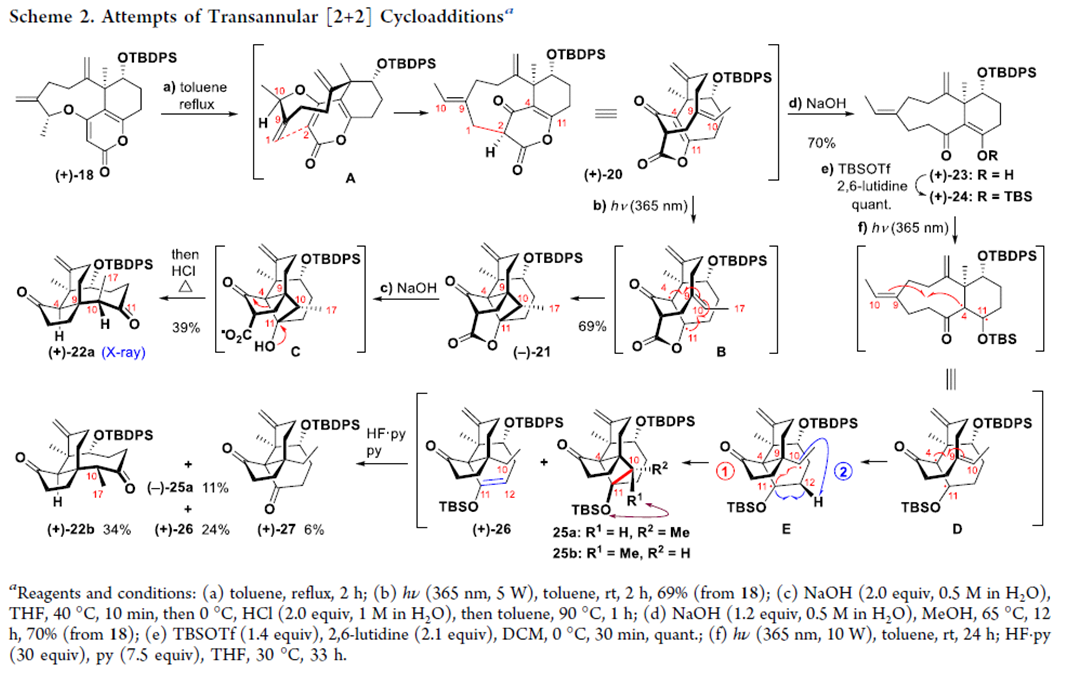
接下来,该小组通过砌块18,对于跨环[2+2]光环加成策略的可行性进行初步尝试。同时对于手性砌块22b形成时的反应机理进行深入研究 (Scheme 2)。

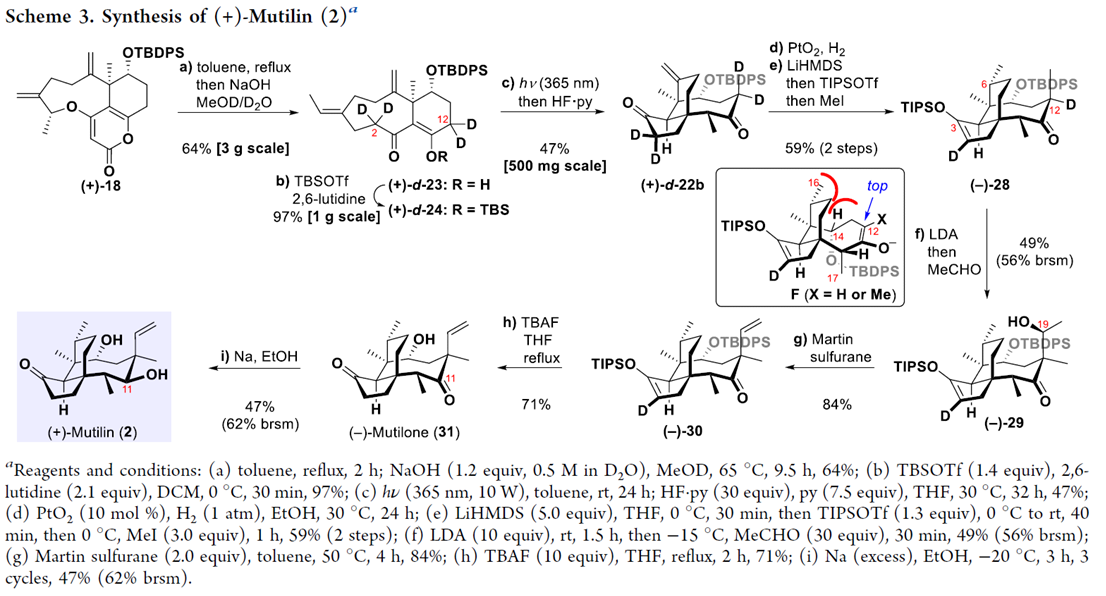
之后,该小组通过砌块18,最终完成(+)-Mutilin (2)的对映选择性全合成 (Scheme 3)。

总结:
北京大学罗佗平课题组成功设计出一种采用(R)-乳酸甲酯与α,β-不饱和酮9作为起始原料,通过18步的线性反应路线,最终完成 (+)-Mutilin (2)的对映选择性全合成。这一全合成路线设计中的关键步骤主要涉及:烷基化/还原;Claisen重排;跨环[2+2]光环加成/碎片化;oxy-Michael加成/O-保护以及非对映选择性共轭加成/炔基化/异构化。
参考文献:
- [1] M. G. Charest, C. D. Lerner, J. D. Brubaker, D. R. Siegel, A. G. Myers, Science, 2005, 308, 395. doi:10.1126/science.1109755.
- [2] N. J. Fazakerley, D. J. Procter, Tetrahedron, 2014, 70, 6911. doi:10.1016/j.tet.2014.05.092.
- [3] E. G. Gibbons, J. Am. Chem. Soc. 1982, 104, 1767. doi:10.1021/ja00370a067.
- [4] F. Kavanagh, A. Hervey, W. J. Robbins, Proc. Natl. Acad. Sci. U. S. A. 1951, 37, 570. doi:10.1073/pnas.37.9.570.
- [5] R. K. Boeckman Jr., D. M. Springer, T. R. Alessi, J. Am. Chem. Soc. 1989, 111, 8284. doi:10.1021/ja00203a043.
- [6] N. J. Fazakerley, M. D. Helm, D. J. Procter, Chem. – Eur. J. 2013, 19, 6718. doi:10.1002/chem.201300968.
- [7] S. K. Murphy, M. Zeng, S. B. Herzon, Science, 2017, 356, 956. doi:10.1126/science.aan0003.
- [8] E. P. Farney, S. S. Feng, F. Schäfers, S. E. Reisman, J. Am. Chem. Soc. 2018, 140, 1267. doi:10.1021/jacs.7b13260.
- [9] N. J. Foy, S. V. Pronin, J. Am. Chem. Soc. 2022, 144, 10174. doi:10.1021/jacs.2c04708.
- [10] D. L. J. Clive, M. Cantin, A. Khodabocus, X. Kong, Y. Tao, Tetrahedron, 1993, 49,7917. doi:10.1016/S0040-4020(01)88016-9
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载




















No comments yet.