本文作者:孙苏赟
第一部分 间接法酯化反应
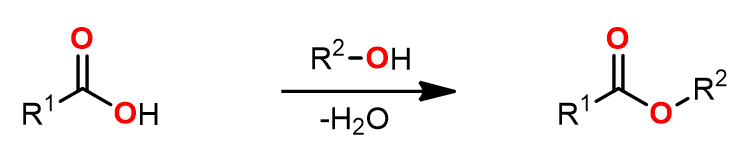
将羧酸的酯化反应中,有两个问题需要克服,一个是将羧酸活化,另一个则是反应中脱水过程的顺利进行。
对于羧酸的活化,一般采用的是利用活化试剂,或者间接的形成一个好的离去基团,例如将羧基转化成酰氯;而后者则是使得反应平衡向生成产物的方向移动。
- 经历酰氯中间体
反应过程的第一步是利用氯化试剂,例如亚硫酰氯或是五氯化磷将羧酸转化成酰氯,但反应的过程中会释放出HCl,如果接下来的反应物对酸敏感,则可以考虑使用草酰氯。虽然酰氯是活泼的酰基化产试剂,但是醇的亲核性却非常弱,通常会使用DMAP类的碱来作为催化剂加快反应:[1]
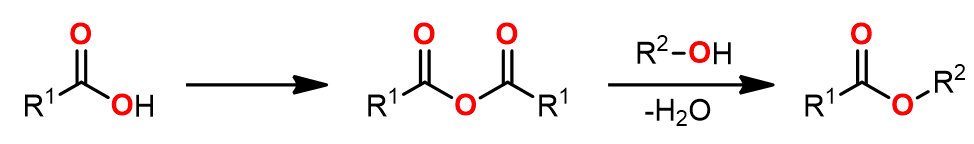
2. 经历酸酐或其他活泼酯中间体
酸酐相对于羧酸是更加活泼的酰基化试剂,因此将羧酸转化成酸酐是常用的一种酯化方法。酸酐的反应活性和酰氯相似,但是生成酸酐的条件要比酰氯温和得多。镧系金属元素的三氟甲磺酸盐可以加快酰基化过程,但是其中的一个缺点是反应中会损失1 equiv.的羧酸物料。
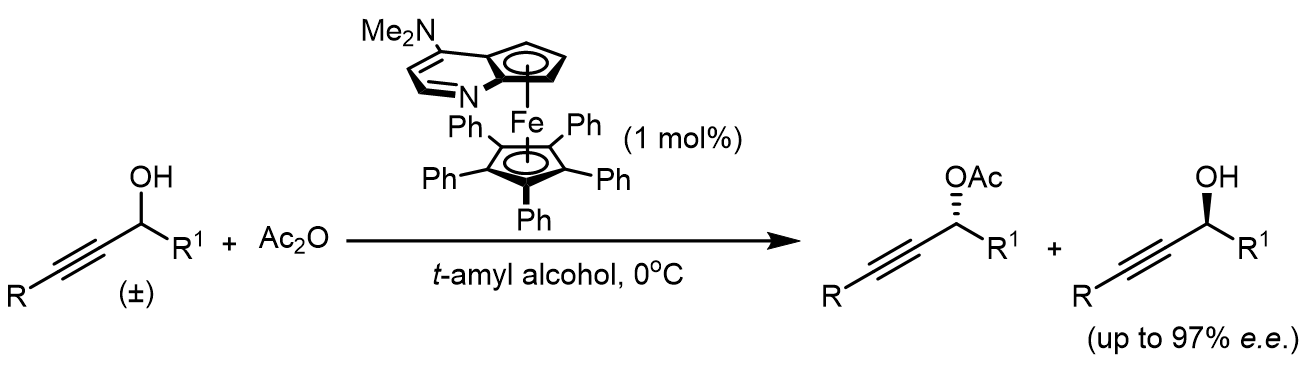
这里是一个手性DMAP类似物的酯化反应进行动力学拆分的例子:[2]
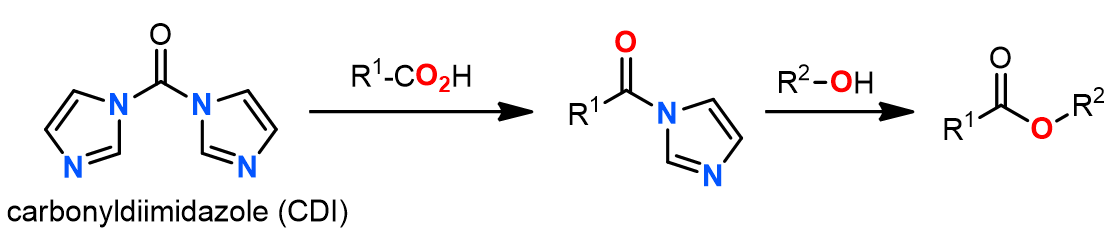
另一种方法是利用N, N ‘-羰基二咪唑:
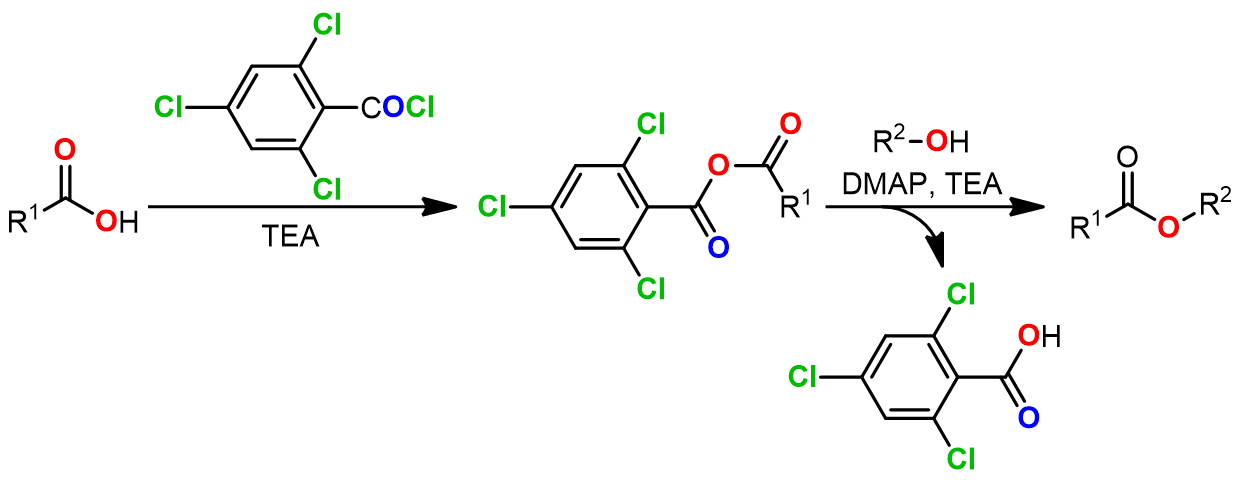
3. Yamaguchi酯化反应
该反应最早是由日本九州大学Yamaguchi课题组在1979年报道的。羧酸和2,4,6-三氯苯甲酰氯(TCBC)作用生成混酐使羧酸得以活化,继而在DMAP的催化下与醇反应生成酯。该反应既可以用于普通酯的生成,也可以用于内酯的生成。对于大环内酯的合成尤为有效,所以在现代天然产物全合成研究中得到非常广泛的应用。
在合成大环内酯时,先与TCBC作用后生混酐后,加入DMAP在高稀释条件下进行