作者:石油醚
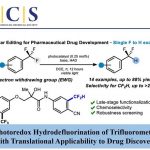
导 读
近日,加州大学圣芭芭拉分校的Yang Hai课题组在双吡咯烷生物碱Loline的生物合成途径中,报道了PLP依赖的Mannich环化酶LolT。他们不仅证明了LolT是催化吡咯里西啶(pyrrolizidine)核心环的关键,而且还发现LolT 能立体选择性的催化合成具有邻位季-三级立构中心的氮杂双环手性α-氨基酸。 此外,他们确定了LolT 的X-ray 晶体结构,并结合点突变、计算机模拟等策略, 解析了LolT催化的分子机制。文章发表于Nature Catalysis上
“A pyridoxal 5′-phosphate-dependent Mannich cyclase
Jinmin Gao, Shaonan Liu, Chen Zhou, Darwin Lara, Yike Zou* & Yang Hai*
Nat. Catal., 2023, ASAP, doi: 10.1038/s41929-023-00963-y”
正文:
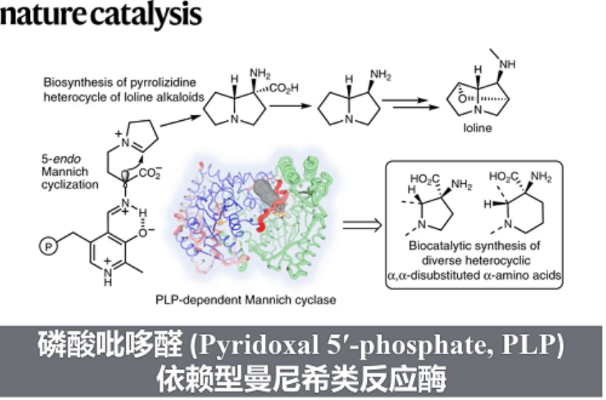
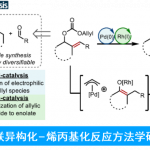
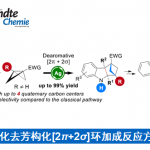
磷酸吡哆醛 (Pyridoxal 5′-phosphate, PLP) 依赖酶可催化多种化学反应,比如转氨、脱羧、外消旋、差向异构、[3 + 2] 环化 、β/γ 消除或置换、羟醛加成 、克莱森缩合 以及 O2 依赖的氧化反应等等。PLP依赖酶之所以能发挥多种催化功能,主要是因为其辅因子PLP可以充当电子阱稳定不同类型的反应活性中间体,从而保证后续的转化持续稳定的进行。相比于传统的化学合成,在化学区域选择和立体选择上,PLP依赖酶有着显著的优势。因此作为生物催化剂,PLP酶在天然产物生物合成以及非天然氨基酸和手性胺药物的不对称合成中发挥重要作用。基于对 PLP 酶学机制的理解,理论上,PLP酶可催化曼尼希类型(Mannich-type)的反应,其催化机制与苏氨酸醛缩酶和丝氨酸羟甲基转移酶这类 Cα-烷基化 PLP酶相似(图 1)。 此外,受生物启发开发的吡哆醛有机催化剂, 可催化不对称Mannich反应以制备 α,β-二氨基酸,也为Mannich酶促反应提供了分子基础。但迄今为止,催化Mannich 反应的PLP依赖酶未曾有过报道。在这里,Yang Hai课题组在双吡咯烷生物碱Loline的生物合成途径中,报道了PLP依赖的Mannich环化酶LolT。他们不仅证明了LolT是催化吡咯里西啶(pyrrolizidine)核心环的关键,而且还发现LolT 能立体选择性的催化合成具有邻位季-三级立构中心的氮杂双环手性α-氨基酸。 此外,他们确定了LolT 的X-ray 晶体结构,并结合点突变、计算机模拟等策略, 解析了LolT催化的分子机制。
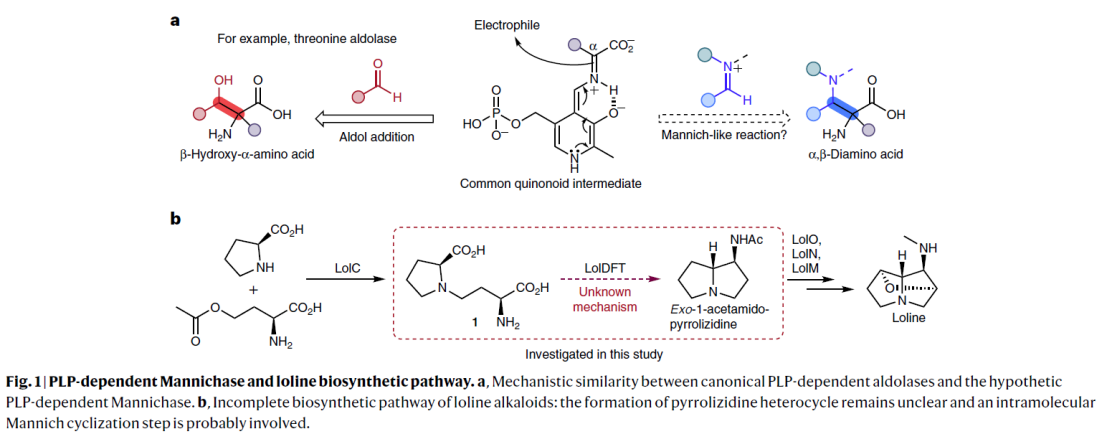
吡咯里西啶(Pyrrolizidine)类生物碱Loline由内生真菌产生,且具有良好的杀虫活性。Loline的生物合成基因簇以及部分生物合成途径已经被报道,但其核心pyrrolizidine环的构筑并未解析。早期研究人员通过体内实验证明最小基因组 (lolDFT) 参与pyrrolizidine环的形成,但具体基因编码的酶功能尚不清楚。Yang Hai课题组结合生物信息学分析以及逆合成分析,初步提出可能的pyrrolizidine杂环生物合成途径:加氧酶 LolF 可以催化氧化脱羧作用,将 1 转化为环亚胺中间体2; 其余两种 PLP 依赖酶(LolT 和 LolD)经脱羧和环化进一步将 2 转化为所需的吡咯里西啶杂环(图2a)。为了验证这一假设并阐明吡咯里西啶环形成的生物合成机制,作者对加氧酶 LolF、PLP 依赖酶LolT 及 LolD进行功能表征。由于LolF经多次尝试未获得可溶性蛋白,决定化学合成其推测的LolF作用产生的可能的亚胺中间体2,来进一步验证PLP 依赖酶LolT 和 LolD的功能。他们通过体外活性实验证明化合物 2 可被LolT转化的平衡混合物转化为分子量相同的单一产物 3。随后利用放大酶促反应成功制备并分离化合物 3,并结合NMR以及X 射线晶体确定化合物3为反式吡咯里西啶 α-季铵盐氨基酸。进一步通过生化实验中证明LolD 可催化化合物3脱羧形成构型保留的产物4 。以上结果表明 LolT 是一种 PLP 依赖酶,可催化类Mannich反应,而 LolD 是一种 PLP 依赖脱羧酶,作用于季 α-氨基酸。
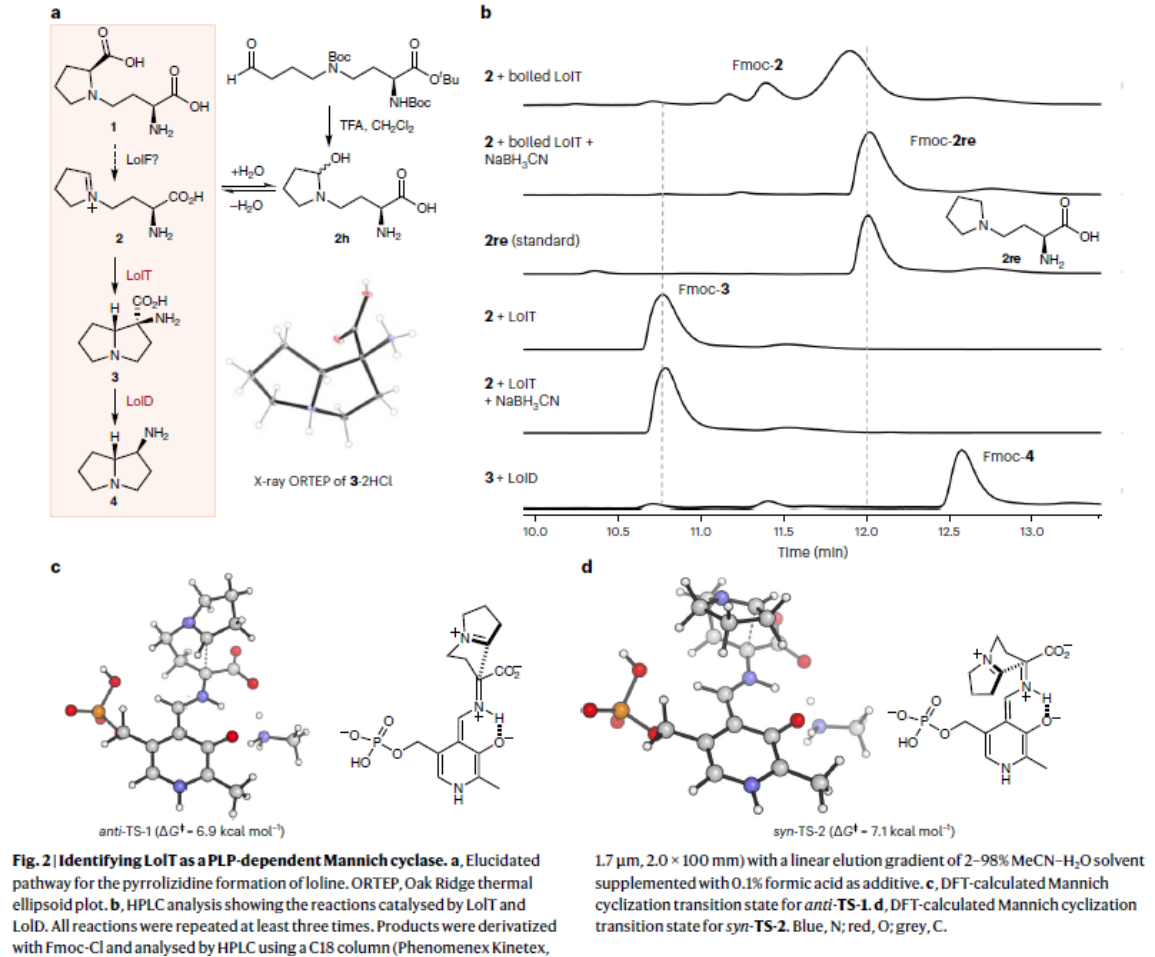
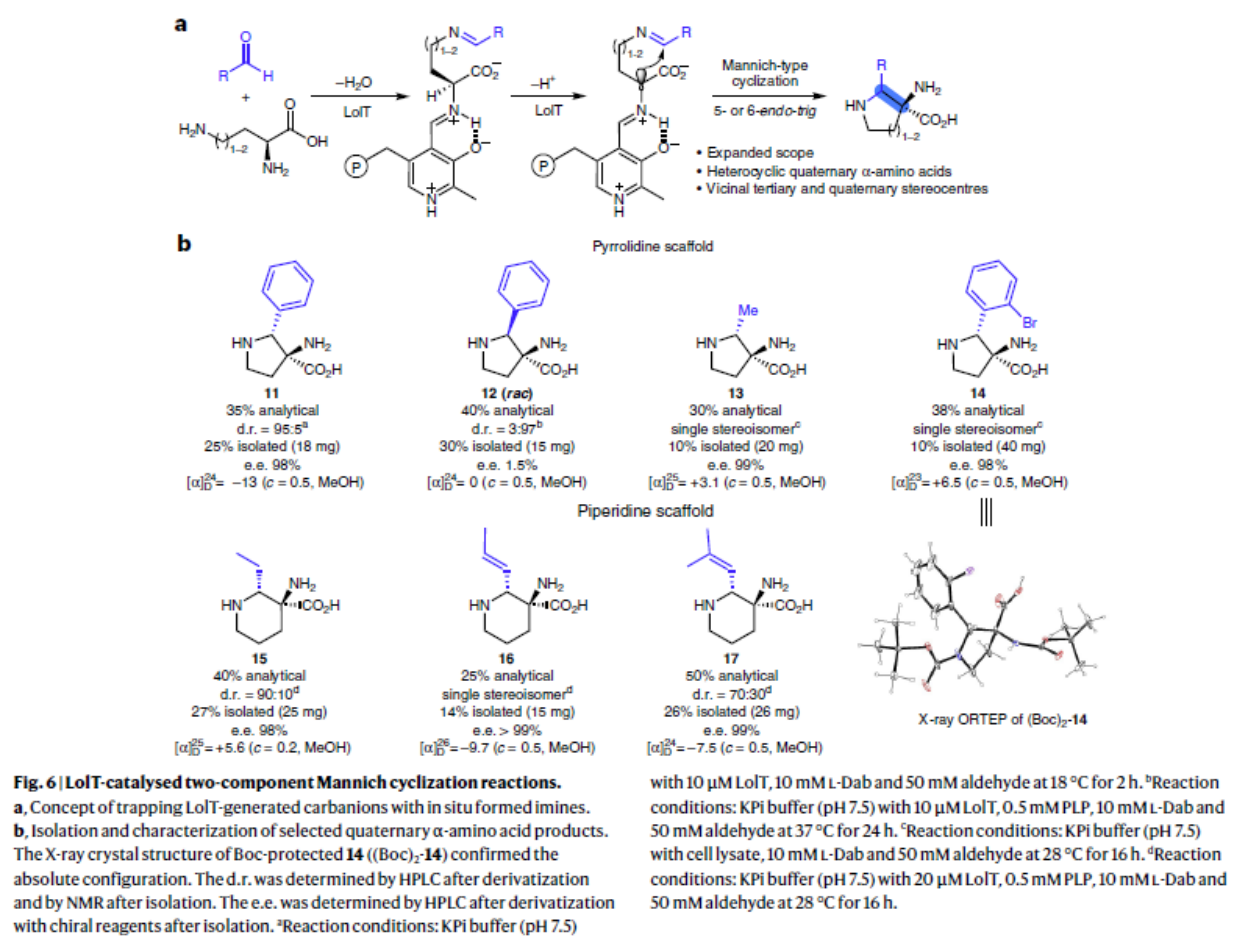
他们利用DFT证明LolT能够立体控制Mannich环化反应,且生成的3 是动力学产物。通过测试LolT 的底物范围,证明LolT不仅可以耐受环从 5 到 7(即 B 环)的不同环亚胺,而且还可以催化 6- 和 7-endo 环化(B 环大小限于 5)。 而每种反应底物,仅观察到一种立体异构产物,表明每个环化都是由 LolT 控制的对映体和非对映体。此外,他们测定LolT动力学参数,提出可能是由于空间效应,进而导致LolT对扩大的 A 环底物的催化效率降低。以上结果均表明LolT是多功能的Mannich环化酶。
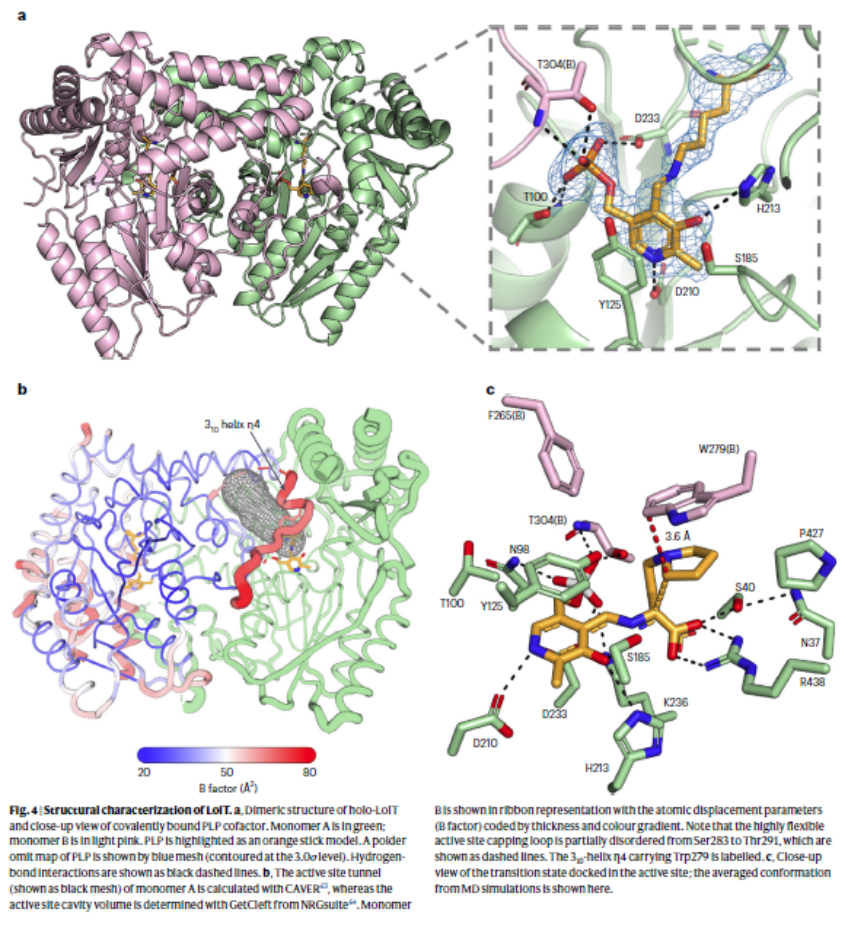
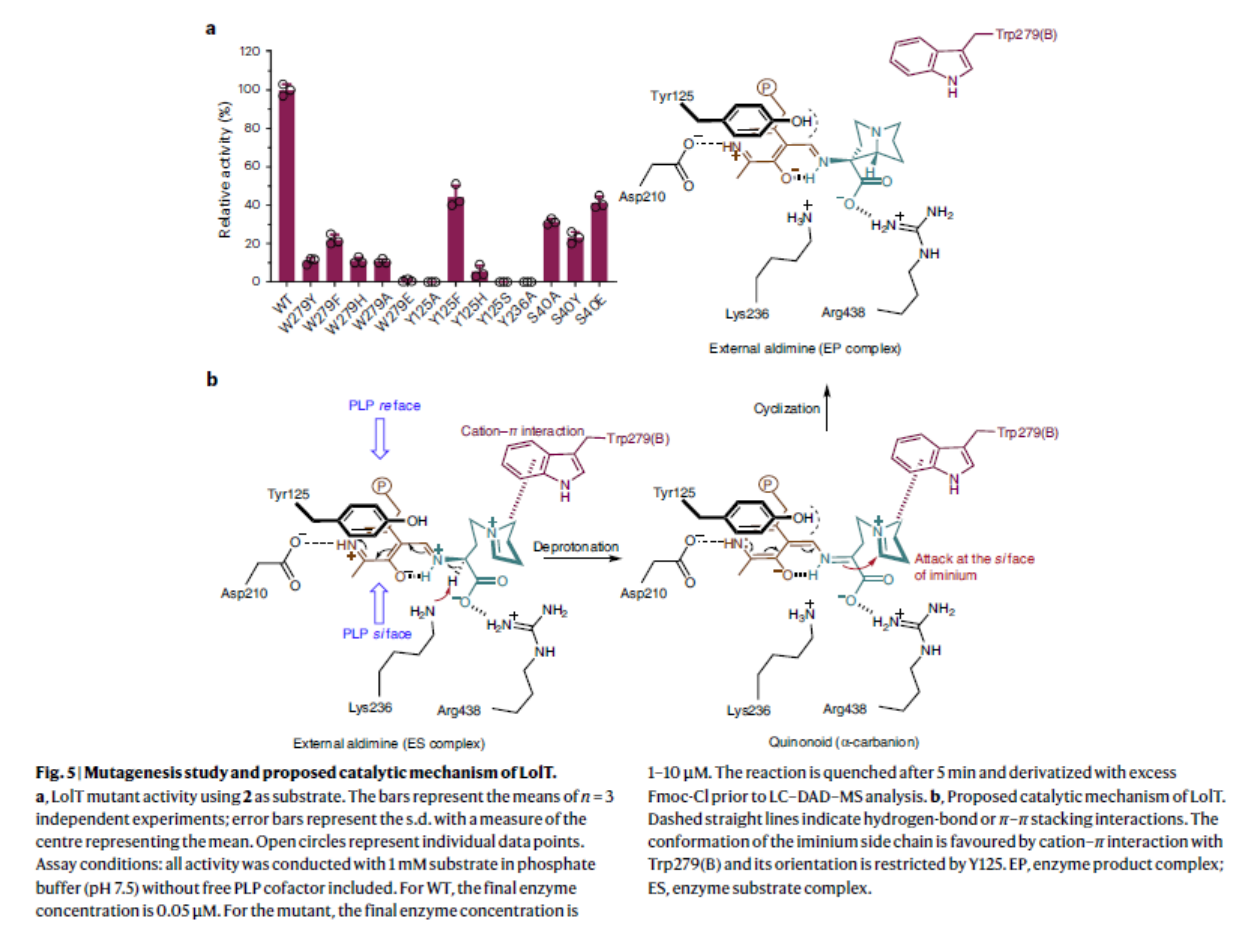
为了进一步在分子水平上阐明LolT的功能,他们解析了LolT的晶体结构。由于未获得 LolT的共晶结构,他们通过分子对接,找出LolT作用的可能关键残基,并结合定点突变实验验证以上活性位点残基的作用(图 5a),提出 LolT 的催化机制(图 5b)。 在形成外部醛亚胺后,Cα–H 的 pKa 降低,位于 PLP 的 si 面的 K236 作为一般碱基,使 L-构型的 α-氨基酸立体特异性去质子化,形成 Cα-碳负离子(醌类中间体), 然后攻击亚胺基团的 si 面,同时在 Cα 处发生构型反转。
最后他们对LolT进行功能拓展。他们推测 LolT 可能会激活底物类似物2,4-二氨基丁酸 (Dab) ,并形成碳负离子,但不能进行后续的Mannich环化反应。他们利用H/D 交换实验证明了这一猜测。此外LolT对于其他的二氨基酸也观察类似现象。因此他们设想如果使用各种醛和二氨基酸通过自发缩合而原位产生亚胺,而生成的亚胺则可以拦截碳负离子进而发生Mannich 环化反应。他们通过体外生化实验证明:LolT 以L-Dab 作为负碳离子供体,可广泛的接受醛类,其中并在亚胺形成后催化相应的 5-endo Mannich 环化,得到吡咯烷季 α-氨基酸(图 6b)。但以 L-鸟氨酸为负碳离子供体时,醛底物范围变窄。而对于L-赖氨酸作为氨基酸供体时,不能发生曼尼希环化反应。以上结果表明他们成功扩展了 LolT 的应用,并以催化正式的双组分Mannich环化反应,获取各种带有邻位三级和四级立体中心基于吡咯烷和哌啶的季 α-氨基酸。
总结
Yang Hai课题组在Loline生物碱的生物合成途径中,鉴定PLP 依赖的Mannich环化酶 LolT,并证明LolT在立体选择性合成多种构象受限的氮杂 (双) 环季 α-氨基酸中的潜能。 此外他们解析LolT晶体结构,结合计算和定点突变阐明 C-C 成键反应性和立体选择性。这一工作展示了天然产物生物合成如何促进生物催化的创新,为进一步开发新的 PLP 依赖的生物催化剂的奠定基础。
致谢
UCSB 的Dr. Jinmin Gao和Dr. Shaonan Liu为共同第一作者,Dr. Yike Zou 和Dr. Yang Hai 为共同通讯作者。该成果得到UCSB的启动基金的支持,并获得ACS GCI 制药圆桌会议的部分研究资助。感谢 R. B. Grossman 和 C. L. Schardl 的有益讨论。感谢UCSB的 BioPACIFIC MIP(NSF 材料创新平台,DMR-1933487)提供部分仪器的使用。感谢 G. Wu 的小分子 X 射线结构测定。感谢 SSRL BL9-2 的光束线工作人员协助收集蛋白质晶体衍射的远程数据。
(非常感谢UCSB 的Dr. Jinmin Gao和Yang Hai教授给我们提供稿件)
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载



















No comments yet.