- 概要
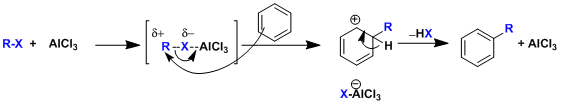
利用路易斯酸催化,在芳香环上进行的亲电烷基化取代反应(SEAr)。
该反应的缺点是经常会生成多取代以及重排的副产物。特别是当R’-X为一级碳卤代的烷烃的时候,由于不能生成稳定的碳正离子,所以经常会同时发生自身瓦格纳-梅尔外因(Wagnar-Meerwein)重排反应。正由于这种局限,所以此反应一般只适用于分子内反应。分子间的反应的话傅-克酰基化更加适用。
- 基本文献
・Friedel, C.; Crafts, J. M. J. Chem. Soc. 1877, 32, 725.
・Friedel, C.; Crafts, J. M. Bull. Soc. Chim. France 1877, 27, 530.
・Calloway, N. O. Chem. Rev. 1935, 17, 327. DOI: 10.1021/cr60058a002
・Price, C. C. Org. React. 1946, 1.
・Olah, G. A. Comprehensive Organic Synthesis 1991, 3, 293.
- 反应机理
傅-克烷基化是以亲电子的芳香族取代反应的形式进行的。一般情况下,富电子的芳香环反应更快。反应后产生的烷基化产物,相对于反应前的芳香环原料来说,电子密度稍微有所增加,所以经常也导致了产物比原料的反应性更高。由于这一点,随之也会生成多取代的烷基化副产物。
另外,对于生成不稳定一级碳正离子中间体的一级碳卤代烷烃来说,瓦格纳-梅尔外因(Wagnar-Meerwein)重排以及β-消除反应也会一并产生,最终经常会生成多个副产物。
- 反应实例
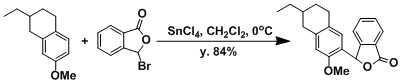
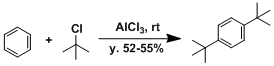
- 实验步骤
- 实验技巧
- 参考文献



















No comments yet.