本文作者:杉杉
导读
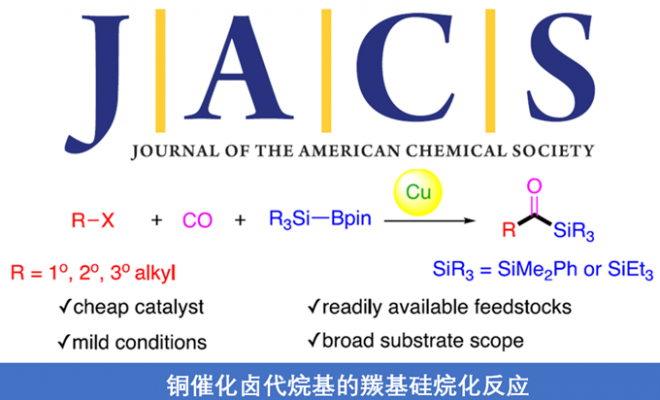
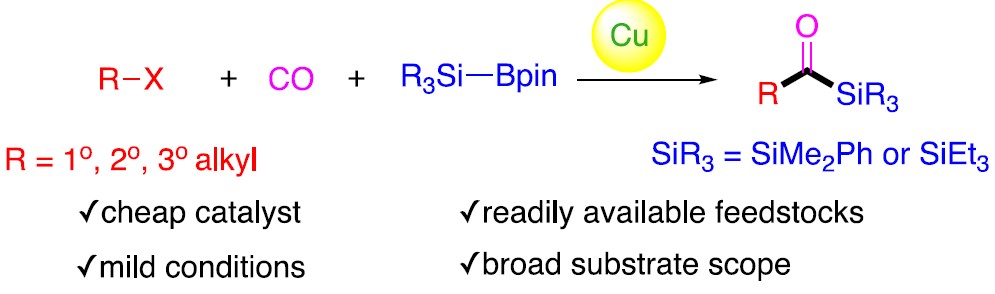
近日,伊利诺伊大学Mankad Neal教授课题组在JACS发表论文,报道了Cu催化下,实现未活化烷基卤化物的羰基硅烷化反应,高效地合成了烷基取代的酰基硅烷衍生物。在温和的反应条件下可以耐受多种官能团,伯、仲和叔烷基卤化物均可适用。此外,该方法不仅合成不同甲硅烷基的酰基硅烷衍生物,同时可将产物还原为相应的α-羟基硅烷衍生物。机理研究表明,甲硅烷基铜中间体通过单电子转移活化烷基卤,形成烷基自由基中间体,进而进行羰基硅烷化反应。
Cu-Catalyzed Carbonylative Silylation of Alkyl Halides: Efficient Access to Acylsilanes
Li-Jie Cheng, Neal P. Mankad*
J. Am. Chem. Soc. 2020, 142, 1, 80-84. DOI:10.1021/jacs.9b12043
正文
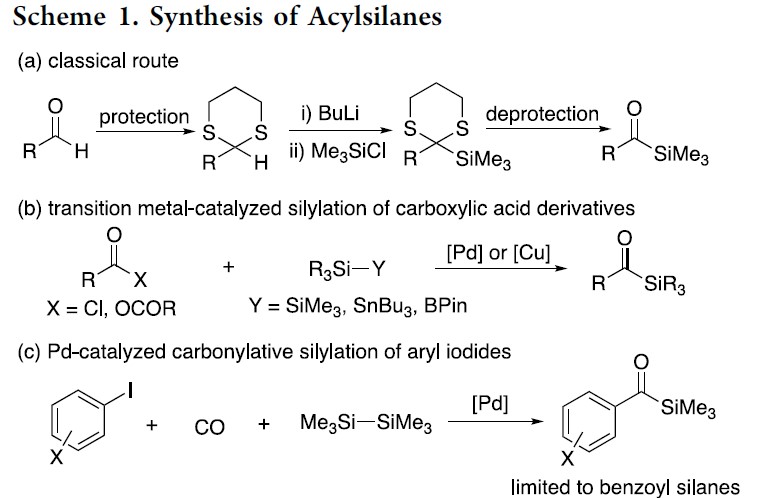
有机硅烷化合物广泛应用于有机合成和材料科学中,含有酰基硅烷的结构单元作为典型代表,Brook重排是制备此类骨架的常用方法。然而,大多数已报道文献中存在一些不足,如需多步制备、底物范围窄等。Brook和Corey报道的经典合成路线中,从醛类底物中合成酰基硅烷衍生物,但需要繁琐的保护/脱保护过程(Scheme 1a)。尽管可将含有阴离子甲硅烷亲核试剂直接加成到羧酸衍生物中(一步合成酰基硅烷衍生物),但通常需要化学计量的甲硅烷基铜试剂或甲硅烷基锂试剂(这类试剂会限制官能团的兼容性)。已报道文献中,钯催化下,可实现酰氯与乙硅烷或甲硅烷基锡试剂的甲硅烷基化反应,合成酰基硅烷衍生物。此外,Riant通过使用甲硅烷基硼烷试剂,在铜催化下,实现酸酐甲硅烷基化反应,获得苯甲酰基硅烷衍生物(Scheme 1b)。尽管这些方法可以在温和条件下简单地合成酰基硅烷衍生物,但由于底物对水分敏感(如酰氯或酸酐),从而限制了它们的应用范围。为了克服这类问题,羰基化制备酰基硅烷作为一种高效的方法(可将羰基直接引入简单的前体中)。早期,Seyferth和Weinstein报道了通过有机锂化合物在-110℃时进行羰基化反应,从而获得酰基硅烷衍生物。此后,Beller报道了更为实用的钯催化体系,通过芳基碘化物的羰基硅烷化反应,获得苯甲酰基硅烷(Scheme 1c)。但是,烷基卤化物底物尚未研究,可能是由于烷基亲电试剂在羰基化反应中,氧化加成速度非常慢,并且存在β-消除的竞争关系。
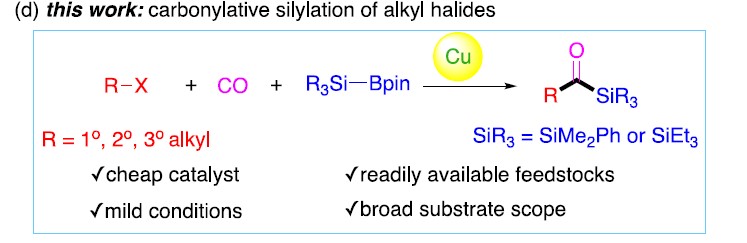
基于前期报道工作总结(铜催化炔烃与卤代烷的羰基化C-C偶联反应和未活化烷基卤的还原羰基化反应),作者发现在此类反应中,通常由烷基卤生成酰基后再与各种有机铜亲核试剂偶联,得到相应的羰基类化合物。作者假设,通过铜催化剂和甲硅烷基硼烷反应生成亲核甲硅烷基铜,是否可与卤代烷反应制备酰基硅烷衍生物(Scheme 1d)。在本文中,作者通过铜催化的羰基硅烷化过程,从烷基卤化物直接催化合成烷基取代的酰基硅烷衍生物。
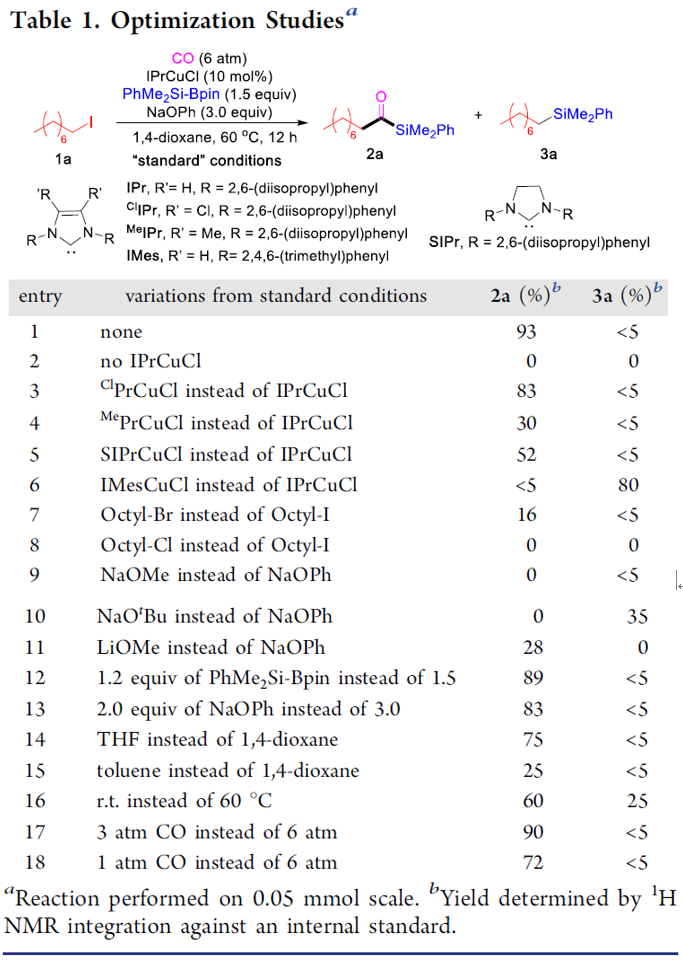
首先,作者以1-碘辛烷1a与PhMe2Si-Bpin作为模型底物,在含有CO(6 atm)下反应,经过大量的条件筛选发现(Table 1),当使用IPrCuCl作为催化剂,以NaOPh作为碱,以二氧六环作为溶剂时,可获得93%收率的酰基硅烷2a(entry 1)。当不加入铜催化剂时,则不发生反应(entry 2)。而对NHC配体筛选中(entries 3-6),使用ClIPr配体时收率略低,而使用SIPr和MeIPr配体时收率大幅下降。有趣的是,使用空间位阻较小的IMes配体时,没有目标产物,但获得较高收率烷基硅烷3a。如果将底物1a的碘取代改为溴或氯时,导致更差的反应结果(entries 7-8)。而对碱的筛选中(entries 9-11),NaOMe、NaOtBu、LiOMe均没有获得较好的结果。而将PhMe2Si-Bpin的量减少至1.2倍当量或将NaOPh降至2.0倍当量时,产率都略有降低(entries 12-13)。而对溶剂的筛选中(entries 14-15),二氧六环作为最佳溶剂。如果将反应在室温下进行,则导致大量烷基硅烷副产物(entry 16)。值得注意的是,如果将反应在3 atm或1 atm大气CO压力下也可获得所需产物,但收率略有降低(entries 17-18)。
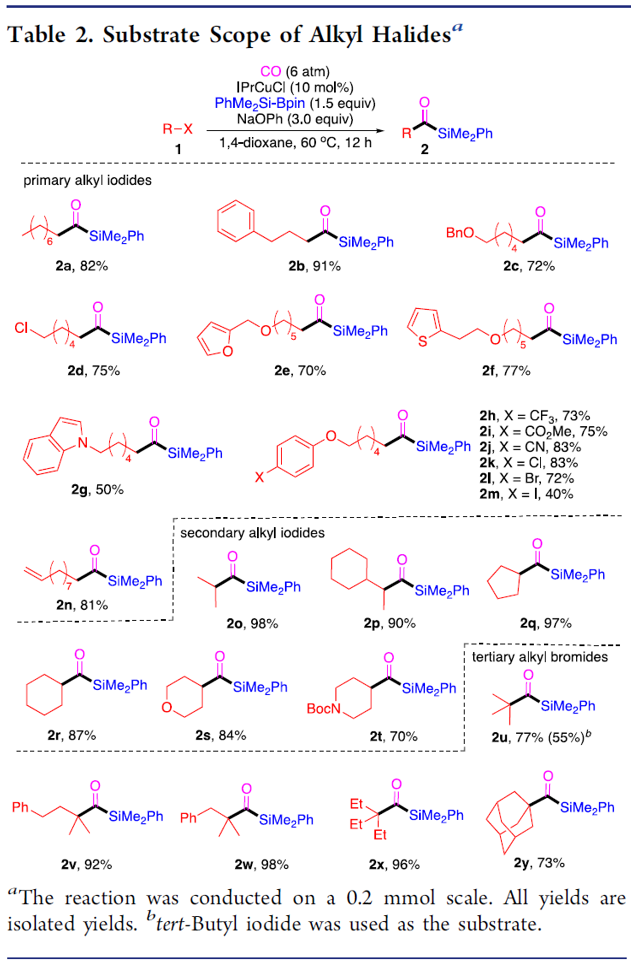
在获得上述最佳反应条件后,作者开始对底物进行了扩展(Table 2)。反应结果表明,烷基碘化物末端含有苯基(2b)、苄基醚(2c)、氯烷基(2d)、末端烯烃(2n)等,均获得较好的结果。而含有杂环的底物也能够与体系兼容,如呋喃(2e)、噻吩(2f)、吲哚基(2g)等。末端苯基(2h–2l)含有三氟甲基、酯基、氰基、氯基、溴基取代时,也可获相应的目标产物,但碘取代的底物(2m)存在一定的副反应。随后,作者将伯烷基碘扩大到仲烷基碘,底物仲烷基碘(2o–2r)不受位阻影响,同时环烷基碘(2s、2t)也与体系兼容。随后,叔烷基亲电体(2u–2y)也获得了令人满意的结果,同时具有更高的收率。
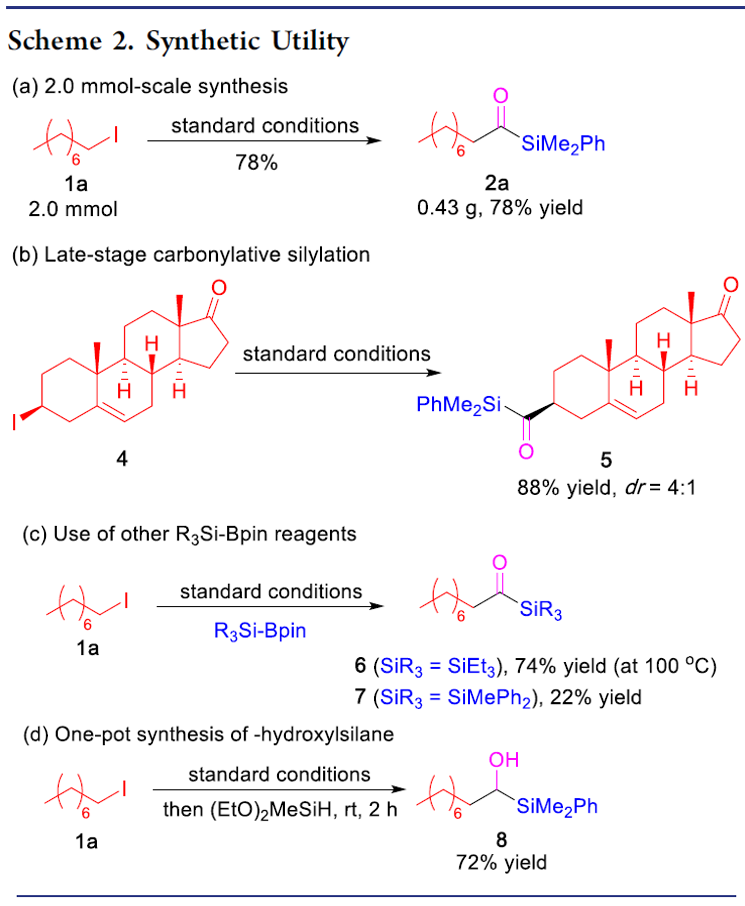
为了验证该方法的适用性,作者进行了如下实验(Scheme 2)。首先,克级实验同样以高收率获得了预期的酰基硅烷产物2a(Scheme 2a)。此外,该方案可对天然产物或药物进行后期的修饰。如雌酮衍生物4,在上述标准条件下,以优异的产率获得酰基硅烷5(Scheme 2b)。此外,除了PhMe2Si-Bpin作为甲硅烷基来源外,活性较低的Et3Si-Bpin(高温下)也可作为偶联底物(Scheme 2c)。如果在反应完成之后,向反应混合物中加入氢硅烷,可进一步还原酰基硅烷(Scheme 2d)。因此,该方案也作为合成α-羟基硅烷(烷基卤化物作为底物)的有效方法。
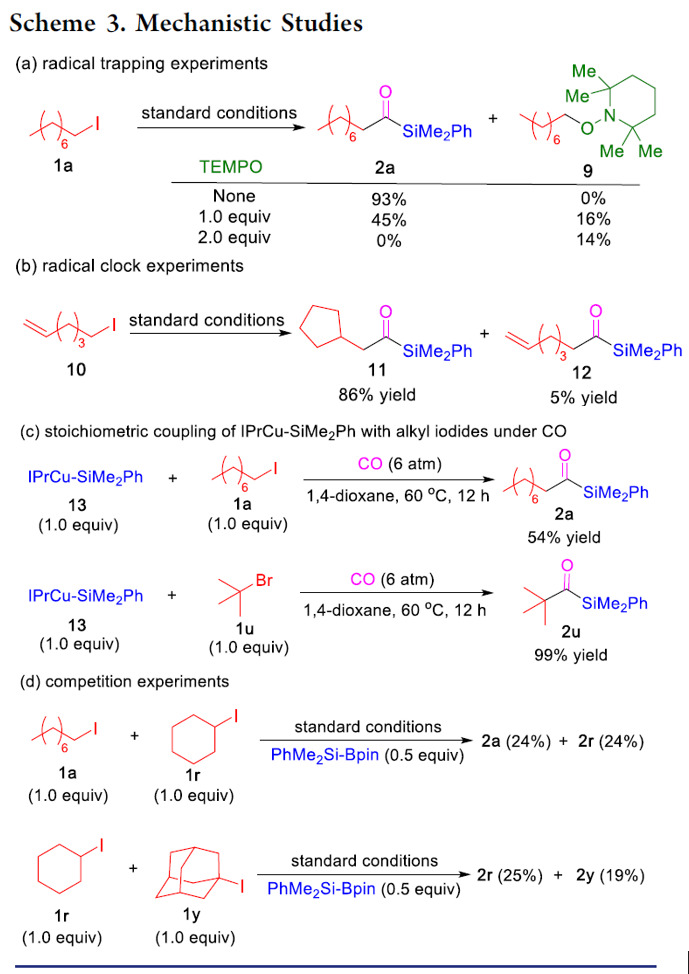
为了进一步验证机理的正确性,作者进行了相关的对照实验(Scheme 3)。当将TEMPO加入反应中时,未获得目标产物,并且通过1H NMR检测发现自由基中间体9的存在(Scheme 3a),从而证明了自由基机理。同时,使用碘代烷10进行自由基反应,获得86%收率的环化产物11(Scheme 3b)。此外,通过相关实验制备了甲硅烷基铜物种IPrCu-SiMe2Ph中间体13,并在CO与伯烷基碘(1a)和叔烷基碘(1u)进行相关反应,分别获得54%和99%收率的酰基硅烷(Scheme 3c),表明甲硅烷基铜中间体可促进伯和叔烷基碘的单电子转移过程,进而进行自由基羰基化反应。此外,由于伯,仲和叔烷基碘之间存在的竞争关系,因此作者对反应的相对速率也进行了研究,但反应结果获得相似的收率产物(Scheme 3d)。
根据上述的实验和相关文献的查阅,作者提出了一种可能的反应机理(Scheme 4)。首先,通过PhMe2Si-Bpin与IPrCuOPh(由IPrCuCl和NaOPh形成)反应生成甲硅烷基铜(I)配合物A。随后,配合物A和烷基卤化物之间的进行单电子转移(SET),形成甲硅烷基铜(II)配合物B和一个烷基自由基R·。紧接着,自由基R·进行羰基化反应,得到酰基自由基C,再与铜(II)配合物B配位,形成铜(III)中间体D。最后,经还原消除得到酰基硅烷,同时再生铜(I)催化剂,从而实现催化循环。
总结
Mankad教授课题组报道了通过Cu催化下的羰基硅烷化反应,从未活化的烷基碘底物合成烷基取代的酰基硅烷衍生物。该方法不仅适用于伯、仲和叔烷基卤底物,同时还具有良好的官能团兼容性。此外,通过雌酮衍生物的后期羰基硅烷化反应以及将产物还原为相应的α-羟基硅烷衍生物,进一步证明了该方法的综合实用性。机理研究表明,甲硅烷基铜中间体通过单电子转移活化烷基卤,形成烷基自由基中间体,进而进行羰基硅烷化反应。
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!
















No comments yet.