- 概要
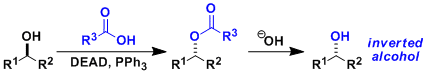
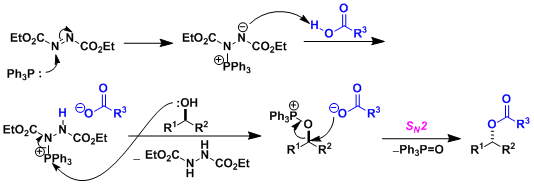
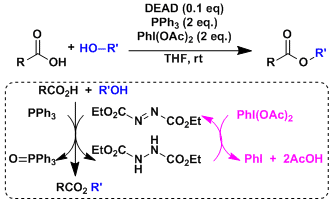
由仲醇和偶氮二甲酸二乙酯(DEAD)、三苯基膦(Ph3P)、苯甲酸反应通过立体翻转(SN2)生成相应的苯甲酸酯衍生物、接着碱性水解可以转变成醇化合物。即可以用于醇的立体反转变换。因本反应能在温和条件下进行、使该反应常用在天然物・比较复杂的化合物的合成。但是、常伴随副产物的生成,使得TLC跟踪监测和纯化分离操作较困难。
- 基本文献
・Mitsunobu, O.; Yamada, M.; Mukaiyama, T. Bull. Chem. Soc. Jpn. 1967, 40, 935. doi:10.1246/bcsj.40.935
・Mitsunobu, O.; Yamada, M. Bull. Chem. Soc. Jpn. 1967, 40, 2380. doi:10.1246/bcsj.40.2380
・Review: Mitsunobu, O. Synthesis 1981, 1.
・Review: Hughes, D. L. Org. React. 1992, 42, 335.
・Review: Dandapani, S.; Curran, D. P. Chem. Eur. J. 2004, 10, 3130. DOI:10.1002/chem.200400363
・Review: Dembinski, R. Eur. J. Org. Chem. 2004, 2763. DOI: 10.1002/ejoc.200400003
・But,T. Y. S.; Toy, P. H. Chem. Asian. J. 2007, 2, 1340. doi:10.1002/asia.200700182
・Swamy, K. C. K.; Kumar, N. N. B.; Balaraman, E.; Kumar, K. V. P. P. Chem. Rev. 2009, 109, 2551. doi:10.1021/cr800278z
- 反应机理
偶氮二甲酸二乙酯(DEAD)的膦加成物碱性弱、所以亲核试剂需要酸性质子(pKa<13)。如果以醇的反转为目的而使用本反应,反应剂使用酸性比苯甲酸更强的对-氰基苯甲酸会得到更高的收率 (参考:Chirality 2000, 12, 346)
- 反应实例
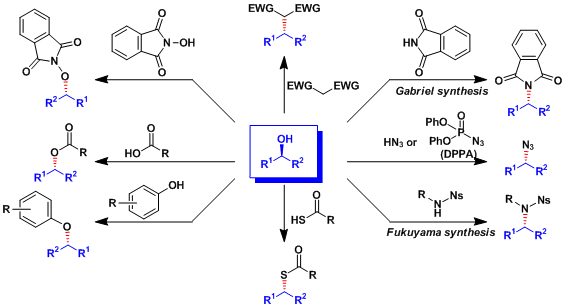
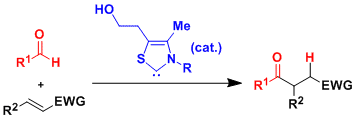
本反应还能利用羧酸以外的亲核试剂,可以得到多种目标产物。实例总结如下。
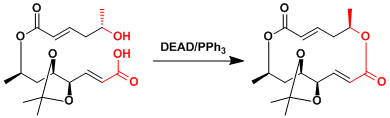
本反应能利用在大的环化合物的合成中。
使用角田试剂的光延反応[1]:在弱酸(pKa>13)条件下也能进行反应。
若加入氧化剂PhI(OAc)2、能大量减少DEAD的使用量。
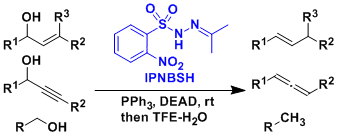
使用Movassaghi发明的IPNBSH試薬能使醇发生脱氧化反应(Movassaghi脱氧化)。
- 实验步骤
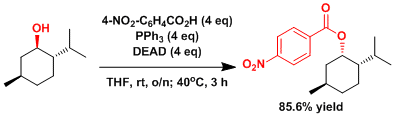
立体位阻大的醇的立体反转 [3]
把(-)-薄荷醇(3.00g, 19.2mmol)、4-硝基苯甲酸(12.9g, 77.2mmol)、三苯基膦(20.1g, 76.6mmol)、溶化到四氢呋喃 里(150mL)。在10℃以下的温度条件慢慢滴加DEAD(12.1mL, 77mmol)。滴加後、把温度升至室温搅拌一夜 (14h)。接下来把反应温度升高到40℃再搅拌3h。反应温度恢复到室温后、用乙醚(150mL)稀释。把有机相用饱和水溶液(2×100mL)洗涤后,再次用乙醚(100mL)反萃取水层。用硫酸钠干燥,过滤后,把溶剂和低沸点化合物用旋转蒸发器和真空泵(0.2mmHg, 30℃, 3時間)除去。得到的粗产品悬浮在乙醚(40mL)里,放置一晚上。加入正己烷(20mL)后,产生的白色固体,减压抽滤,体积比1:1的乙醚和正己烷洗涤,把得到的滤液用旋转蒸发仪浓缩 残留的黄色油状物质溶解于二氯甲烷(10mL)中,用8%的乙醚/正己烷稀释,然后柱层析(8%乙醚/正己烷做展开剂) 纯化后得到白色结晶性固体(产量5.03g, 产率85.6%)。
- 实验技巧
- 参考文献
[2] But, T. Y. S.; Toy, P. H. J. Am. Chem. Soc. 2006, 128, 9636. DOI: 10.1021/ja063141v
[3] Dodge, J. A.; Nissen, J. S.; Presnell, M. Org. Synth. 1996, 73, 110. [PDF]
- 相关书籍
- 相关链接
・The Mitsunobu Reaction
・Mitsunobu Reaction (organic-chemistry.org)
・光延反応 (Wikipedia日本)
・Mitsunobu Reaction (Wikipedia)
・Mitsunobu reaction
・Sulfur and Phosphorus Compounds
・光延旺洋 (Wikipedia日本)
・光延反応 (TCI)














No comments yet.