本文作者:杉杉
导读
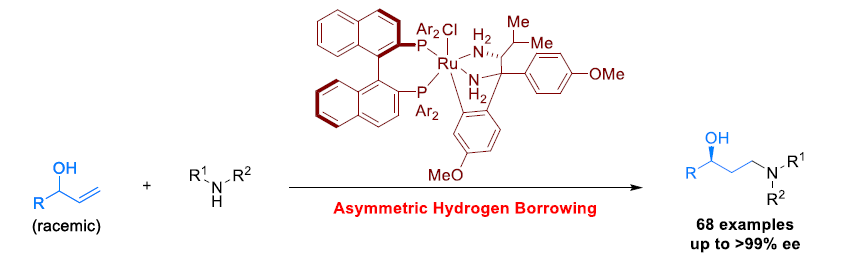
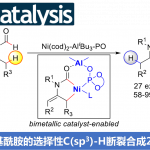
近日,陕西师范大学王超教授课题组在Angew. Chem. Int. Ed.上报道了通过钌催化,实现烯丙基醇的反马氏氢胺化反应(anti-Markovnikov hydroamination),获得多种手性γ-氨基醇衍生物。同时,通过不对称借氢反应(asymmetric hydrogen-borrowing)过程,将外消旋二级烯丙基醇与各种胺反应,从而获得各类对映富集的手性γ-氨基醇衍生物。该方法学具有反应条件温和、底物范围广、对映选择性优良(68例,高达 99%ee)等优点。
Anti-Markovnikov Hydroamination of Racemic Allylic Alcohols toAccess Chiral γ-Amino Alcohols
R. Xu, K. Wang, H. Liu, W. Tang, H. Sun, D. Xue, J. Xiao, C. Wang
Angew. Chem. Int. Ed. ASAP. DOI:10.1002/anie.202009754 https://doi.org/10.1002/anie.202009754
正文
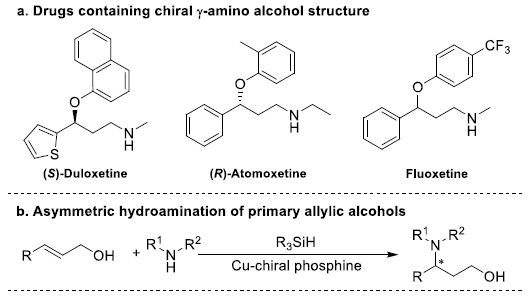
目前,手性γ-氨基醇已成为多种药物与生物活性分子,如(S)-Duloxetine、(R)-Atomoxetine以及Fluoxetine等构建时的关键中间体(Figure 1a)。同时,性γ-氨基醇类化合物同样可以作为不对称合成中的手性辅基与配体。对映体富集的手性γ-氨基醇的合成方法学研究已有诸多文献报道,其中β-氨基酮的不对称加氢反应已成为构建手性γ-氨基醇最佳方法之一。此外,Buchwald课题组开创的烯丙醇的不对称氢胺化反应方法学,同样成为获得手性γ-氨基醇的另一种具有原子经济性理想方法。然而,传统的烯丙醇氢胺化反应仅能够获得立体生成中心与氮原子连接的手性γ-氨基醇(Figure 1b)。
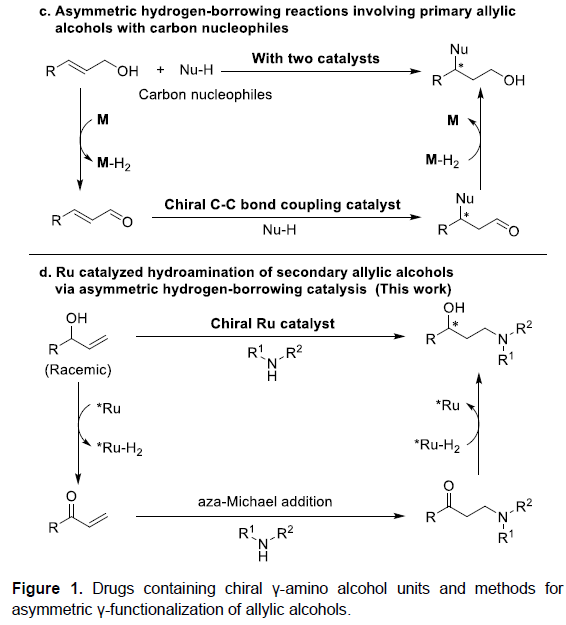
同时,借氢催化反应(hydrogen-borrowing catalysis)为烯丙醇不对称γ-官能化提供了另外一种行之有效的方法。Quintard与Dydio课题组分别报道了采用非手性借氢催化剂与手性C-C偶联催化剂的串联反应,进而实现一级烯丙基醇与碳亲核试剂之间通过借氢过程,获得生成γ-手性一级醇的反应(Figure 1c)。同时,Oe小组以及近期的研究表明,借氢策略能够成功应用于用于烯丙醇的形式反马氏氢胺化反应(formal anti-Markovnikov hydroamination),生成外消旋γ-氨基醇产物。受上述研究的启发,作者设想如果可以筛选出有效的手性借氢催化剂,使外消旋二级烯丙基醇脱氢,随后,再能够完成氨基酮中间体的不对称氢化,即可获得立体生成中心与羟基相连接的手性γ-氨基醇(Figure 1d)。
通过这一设想,陕西师范大学王超教授课题组报道了采用手性Ru-双胺-双膦配合物催化的外消旋二级烯丙基醇的形式反马氏氢胺化反应,获得多种手性γ-氨基醇衍生物,其立体生成中心与OH相连接。值得注意的是,这种类型的手性γ-氨基醇无法通过正常的不对称氢胺化反应获得(Figure 1b),并且,选择性模式同样与先前报道的烯丙醇的γ-官能化不同(Figure 1c)。
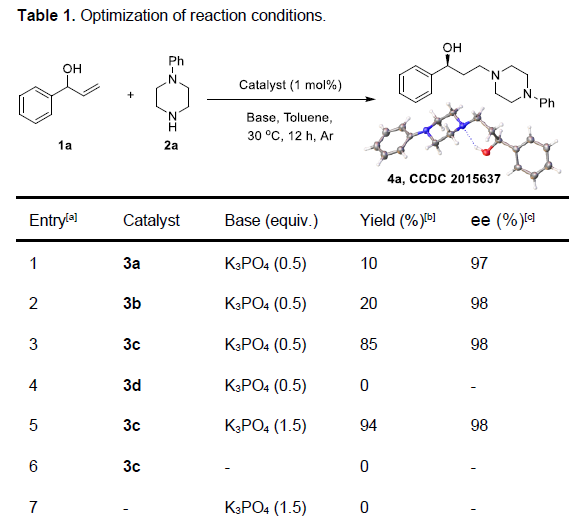
首先,作者以1-苯基丙-2-烯-1-醇1a与1-苯基哌嗪2a作为模型底物,使用Ru-二胺-二膦催化剂,进行了相关反应条件的筛选(Table 1)。结果表明,当采用手性Ru配合物3c以及K3PO4 (1.5eq)作为碱时,可获得94%收率与98% ee的产物4a。
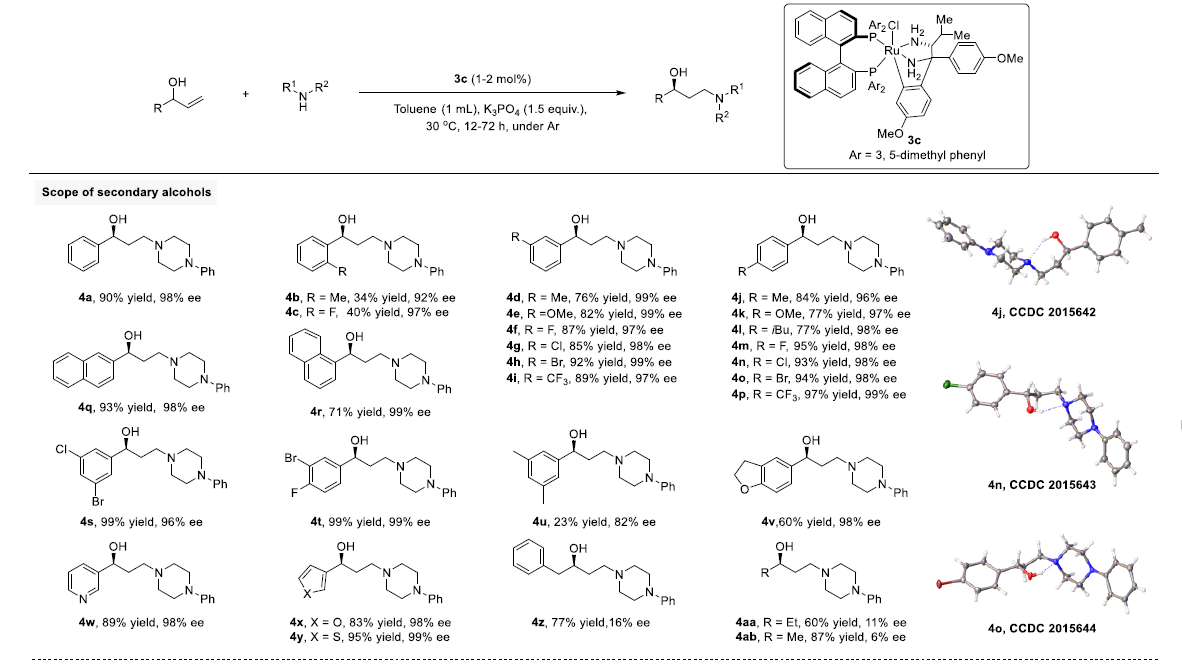
在获得上述最佳反应条件后,作者开始对底物应用范围进行进一步研究(Figure 2)。研究发现,在多数情况下,需要将反应时间延长至48h。同时,对于部分底物而言,需要采用2 mol%的3c,以确保反应产率最高。
首先,作者对二级烯丙醇底物的应用范围进行研究(4a-4ab)。作者发现,在二级烯丙基醇的苯基取代基间位于对位中存在各种供电子与吸电子取代基时,均能够良好地兼容。并以良好的产率与优良的对映选择性获得相应的手性γ-氨基醇产物4d-4p。然而,研究发现,对于苯基邻位取代的底物(4b,4c),反应活性较低。进而表明该反应条件对于立体位阻的敏感性。同时,作者进一步发现,具有萘基、二取代苯基和杂环取代基的二级烯丙醇,均与上述反应体系兼容(4s-4y),尽管4u的收率很低。而对于苄基或脂肪族基团连接的二级烯丙基醇底物,观察到极低的对映选择性(4z-4ab)。
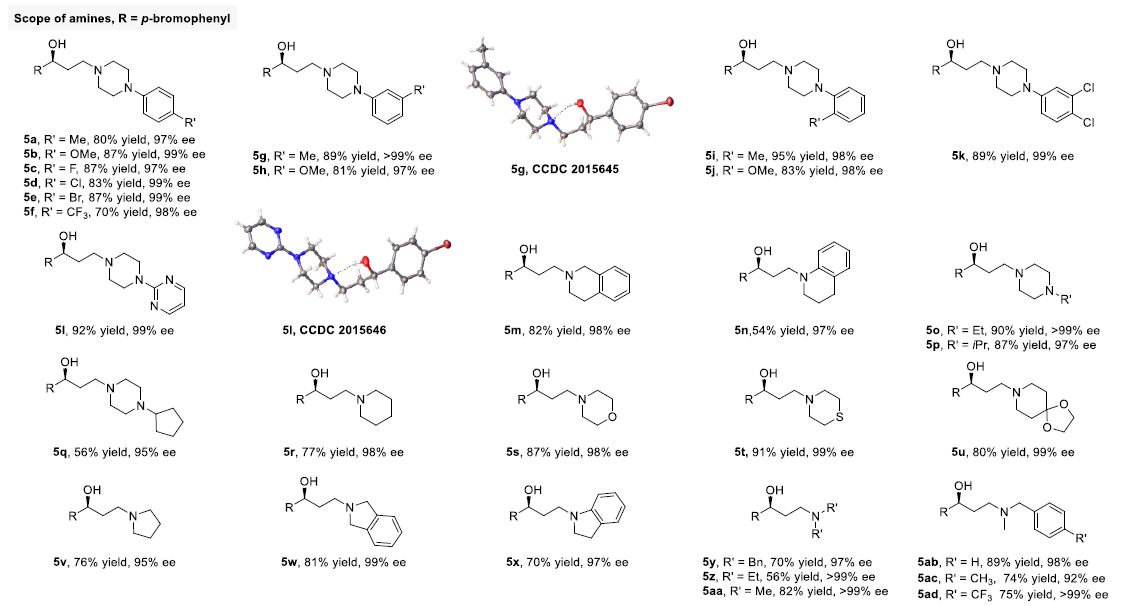
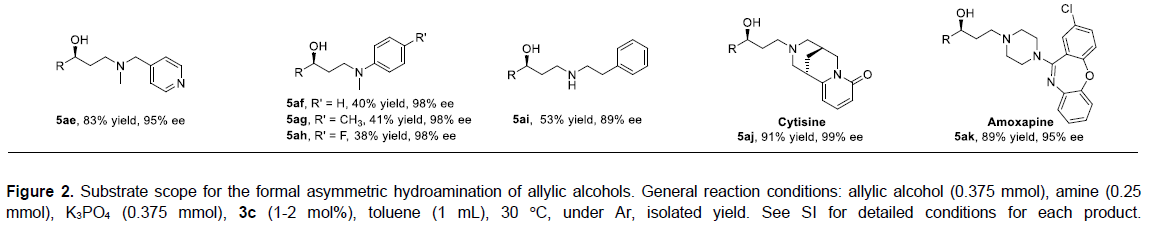
接下来,作者对胺的底物范围进行了考察(5a-5aj)。研究表明,对于环状与非环状二级胺(5a-5ah¬),均可以获得优良的对映选择性。然而,对于非环状二级芳胺底物(5af-5ah),观察到较低的反应收率(可能源于其较低的亲核性与较高的立体位阻)。同时,作者发现一级芳胺底物,几乎无法进行上述反应,尽管对于一级脂肪胺(5ai),能够观察到中等程度的产率与良好的ee。
由于许多天然产物与药物分子中均含有二级胺结构,因此,上述策略能够应用于天然产物与药物的修饰。作者进一步通过上述策略顺利完成Cytisine与Amoxapine的功能化,进而获得5aj和5ak(Figure 2)。
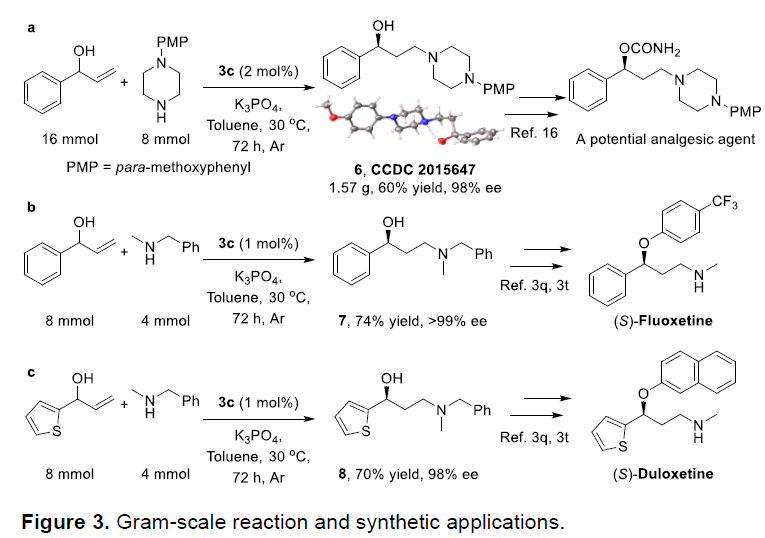
为了进一步证实该方法学的实用性,作者进一步进行了用于合成潜在镇痛药的关键中间体(6)与合成(S)- Fluoxetine以及抗抑郁药Duloxetine的相应中间体的克级实验进行研究(Figure 3)。该小组惊喜地发现,该反应条件在克级规模的反应中,仍然能够获得良好的收率与对映选择性。
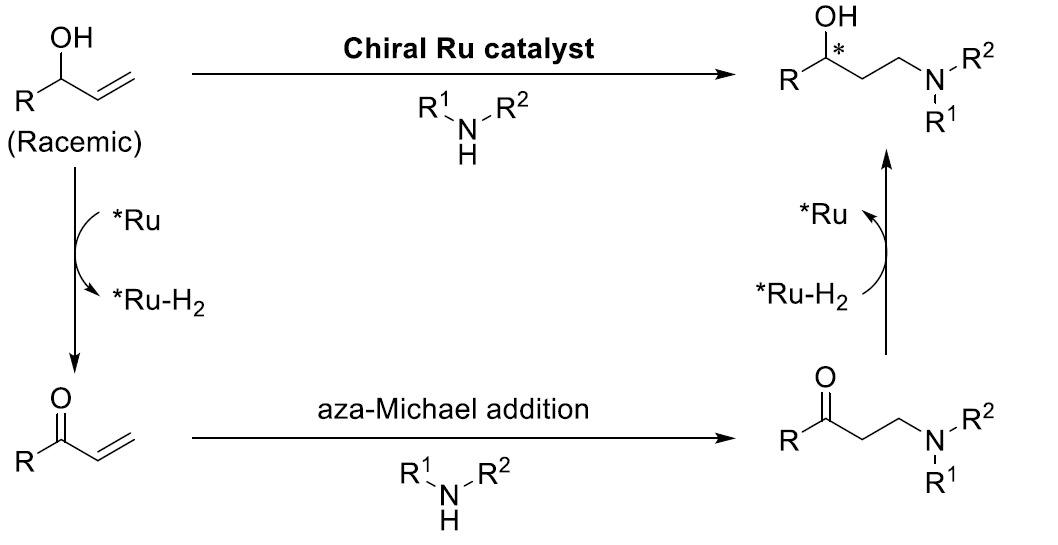
根据相关文献的查阅,作者提出了可能的反应机理(Figure 1D)。首先,手性Ru催化剂存在下,烯丙醇发生脱氢过程,产生手性Ru-H2氢负离子配合物与α,β-不饱和酮中间体。随后,经aza-Michael加成反应,形成β-氨基酮中间体。最后,通过手性Ru-H2氢负离子配合物还原,最终获得手性γ-氨基醇产物,并使手性Ru催化剂再生,进而实现催化循环。
总结
陕西师范大学王超教授课题组报道了通过手性钌催化剂参与,成功实现烯丙基醇与各类二级胺的形式反马式氢胺化反应(反应过程中涉及不对称借氢反应),进而获得一系列手性γ-氨基醇衍生物。该反应具有广泛的底物范围、良好收率与优良的对映选择性等优点。同时,该反应条件能够适用于克级规模,在各类药物分子的合成具有潜在的应用价值。
















No comments yet.