导读:
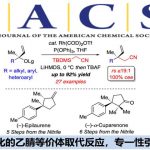
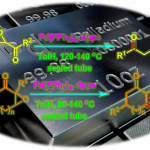
近日,中国科学院上海有机化学研究所的麻生明等课题组在J. Am. Chem. Soc.中发表论文,报道一种全新的有机光催化与铜催化相结合的催化体系,实现了allenoic acids或联烯酸酯的立体选择性氯磺酰化反应,高效合成了一系列含硫原子取代基的Z-选择性四取代烯烃。该反应具有优异的官能团兼容性。此外,通过中间体捕获实验及手性联烯酸酯参与的反应,进一步证实了磺酰基自由基与烯丙基自由基的存在。循环伏安法研究与Stern-Volmer淬灭实验表明,反应遵循氧化淬灭机理。同时,Cu(acac)2在立体选择性氯磺酰化反应形成立体结构明确的π-烯丙基铜配合物中具有关键作用。
Photo- and Copper Dual-Catalyzed Z‑Selective Chlorosulfonylation of Allenes for Tetrasubstituted Alkenes
Y. Shi, S. Hong, X. Zhang, J. Zheng, S. Ma, J. Am. Chem. Soc. 2026, ASAP. doi:. 10.1021/jacs.5c17536.

正文:
立体结构明确的四取代烯烃因其独特的生物、材料及化学性质备受关注。在药物化学领域,其Z/E异构体的独特生物活性已得到充分证实,如(E)-Clomiphene呈现抗雌激素活性,而(Z)-Clomiphene则表现雌激素效应(Scheme 1a)。同时,全取代烯烃也在功能材料领域中获得广泛应用,包括光致变色分子开关与分子马达的构建。并且,该类化合物作为通用型分子骨架,在有机合成中可高效构建复杂的分子结构。前期,化学家们已开发多种构建四取代烯烃的方法[1],但对于相应立体与区域选择性的控制则具有难度。另一方面,联烯分子结构中任一碳碳双键通过官能团化修饰,也可作为高效合成四取代烯烃的方法,但也存在区域于立体选择性控制的难题(Scheme 1b)。近年来,诸多研究团队已经成功设计出多种采用联烯立体选择性制备四取代烯烃的合成转化策略,如亲电加成[2]、亲核加成[3]和过渡金属催化策略等[4](Scheme 1c)。基于上述的讨论,麻生明等团队设想,金属催化剂可通过其模板效应调控自由基中间体反应活性,与原位生成的非立体选择性π-烯丙基自由基偶联形成立体结构明确的π-烯丙基金属中间体,该中间体经Y试剂捕获后,可为立体结构明确的四取代烯烃提供普适性合成策略(Scheme 1d)。近日,中国科学院上海有机化学研究所的麻生明等课题组报道一种全新的有机光与铜双重催化体系,实现了联烯衍生物的立体选择性氯磺酰化反应,高效合成了一系列含硫原子取代基的Z-选择性四取代烯烃(Scheme 1e)。
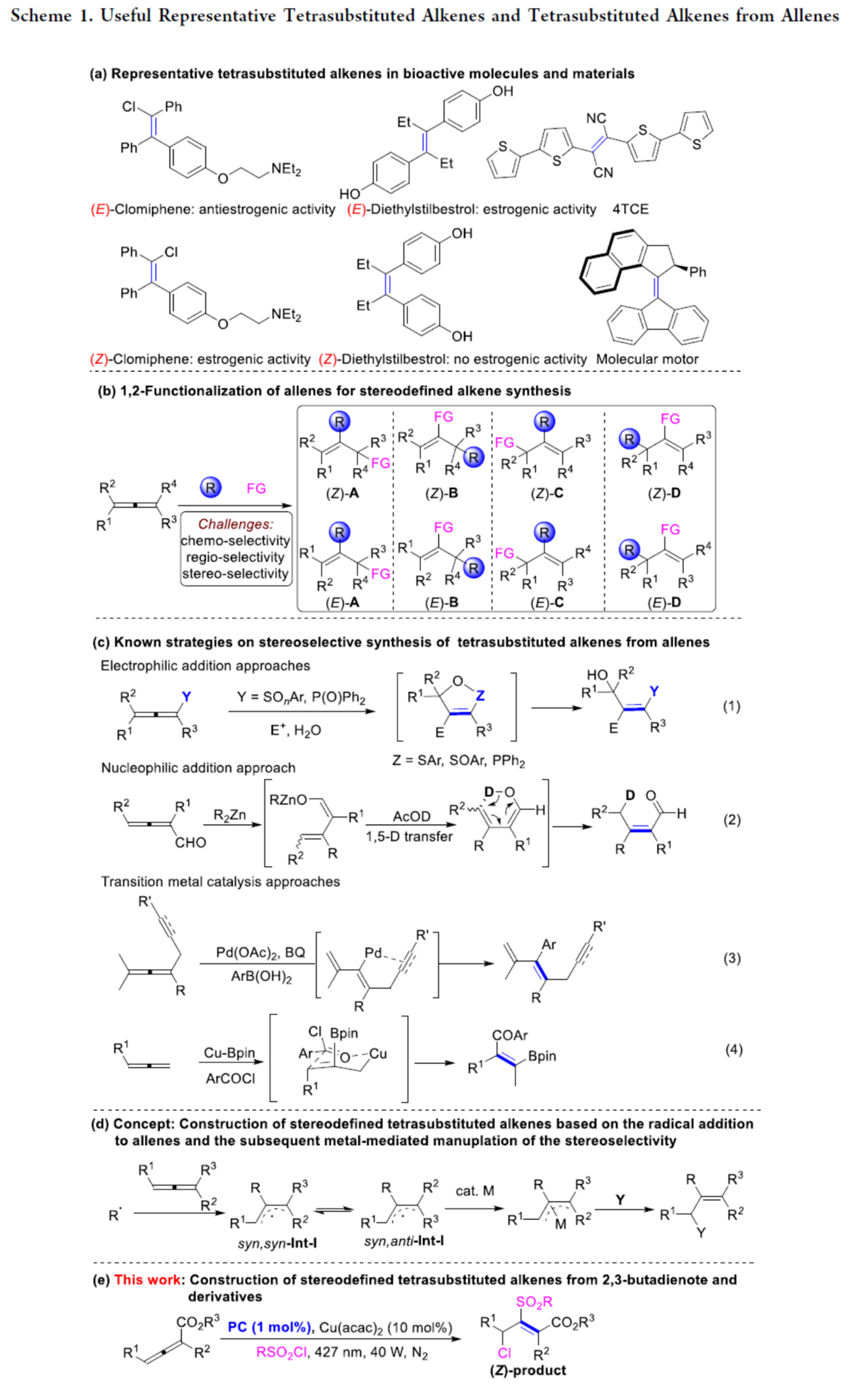
首先,作者采用allenoic acid (1a)与PhSO2Cl (2a)作为模型底物,进行相关氯磺酰化反应条件的优化筛选 (Table 1)。进而确定最佳的反应条件为:采用4CzIPN作为光催化剂,Cu(acac)2作为金属催化剂,蓝色LEDs(427 nm与40 W)作为光源,在CH3CN反应溶剂中,反应温度为45 oC,最终获得69%收率的四取代丙烯酸产物(Z)-3aa。
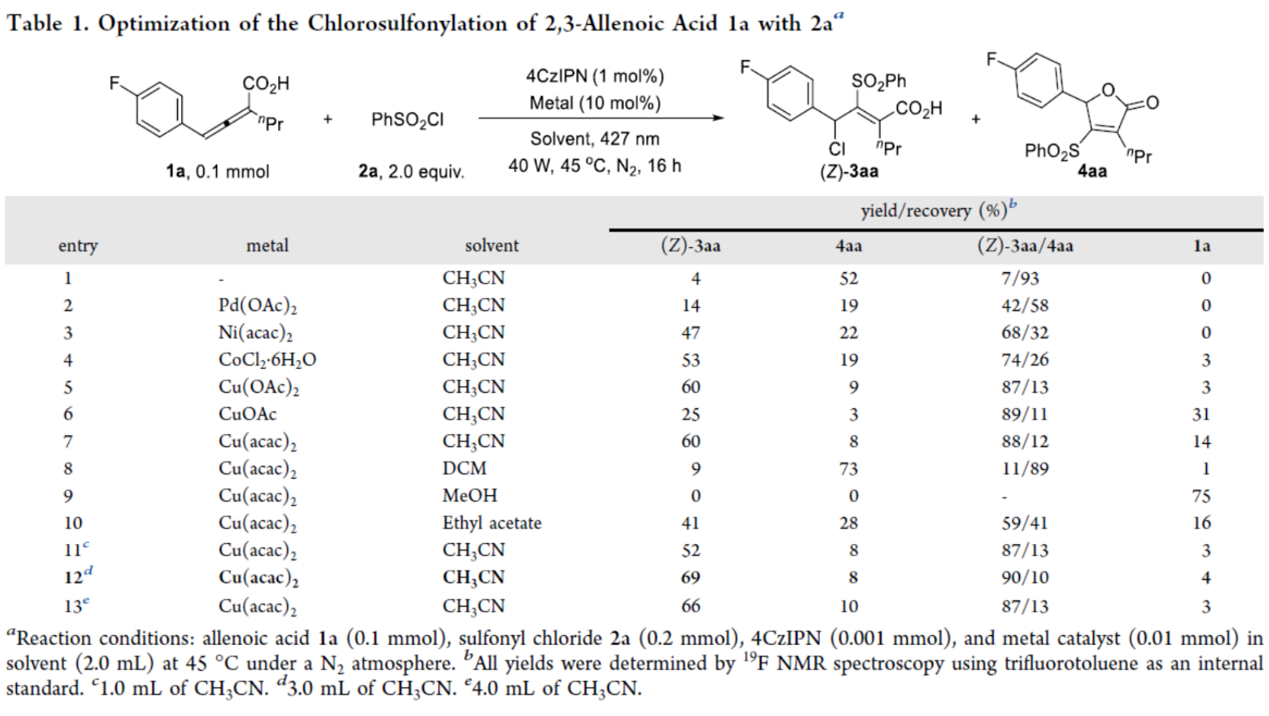
在上述的最佳反应条件下,作者对一系列底物的应用范围进行深入研究(Table 2)。研究结果表明,4-(4-fluorophenyl)-2-propyl-2,3-butadienoic acid(1a)以及4-芳基取代2,3-allenoic acid(1t)可分别与不同电性取代的苯磺酰氯衍生物顺利进行氯磺酰化反应。同时,生成的羧酸衍生物可与TMSCHN2进行进一步的酯化反应,从而获得相应的目标产物(Z)-5aa、(Z)-5ta、(Z)-5af、(Z)-5th、(Z)-5td和(Z)-5aj,收率为53-59%。
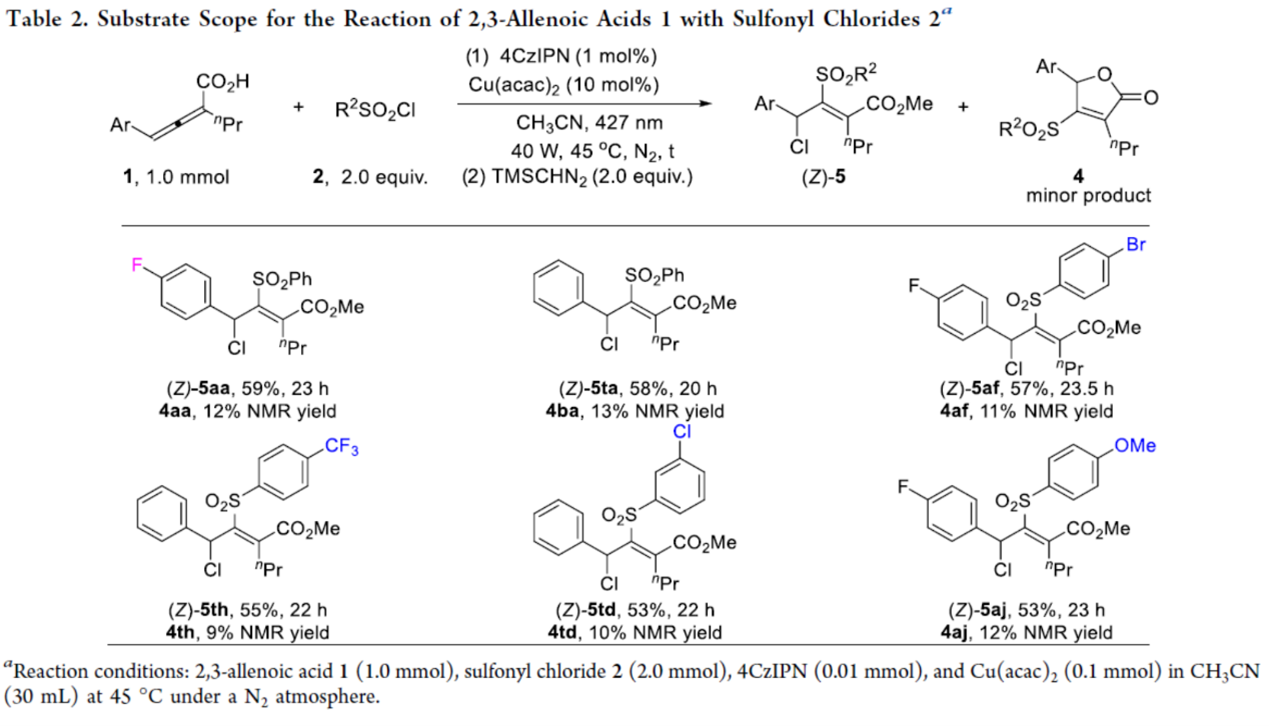
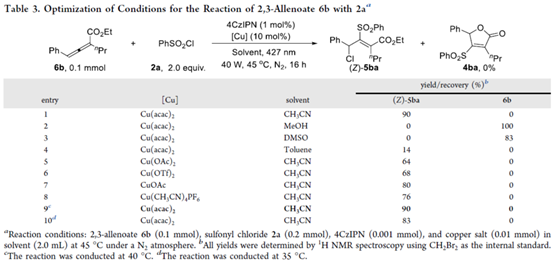
除了allenoic acid (1)以外,作者还以联烯酸酯(6b)与PhSO2Cl(2a)作为模型底物,进行相关氯磺酰化反应条件的优化筛选(Table 3)。进而确定最佳的反应条件为:采用4CzIPN作为光催化剂,Cu(acac)2作为金属催化剂,蓝色LEDs(427 nm与40 W)作为光源,在CH3CN反应溶剂中,反应温度为40 oC,同样可获得90%收率的四取代丙烯酸产物(Z)-5ba。
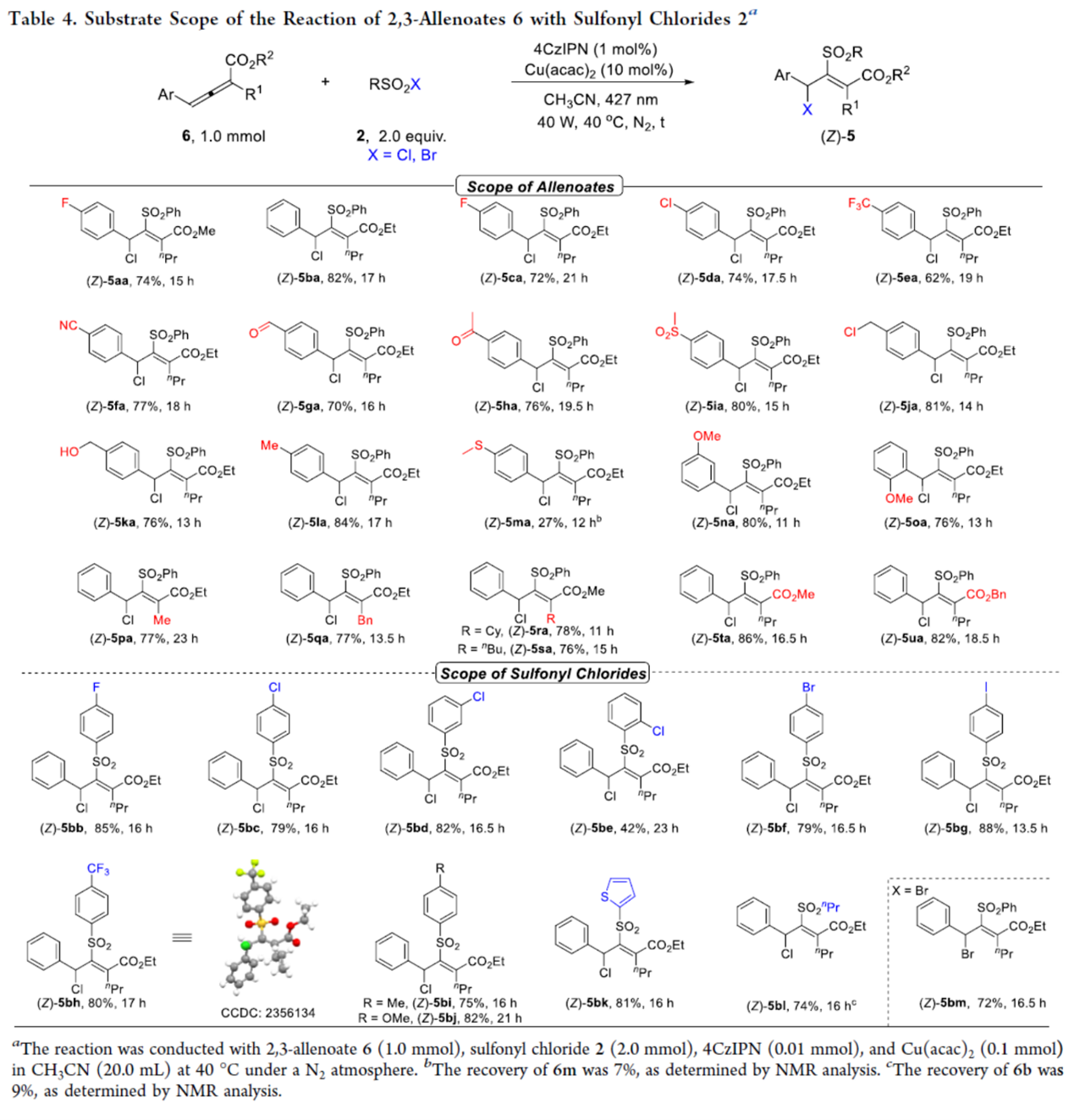
其次,作者还对联烯酸酯与磺酰氯衍生物的底物范围进行了扩展(Table 4)。首先,当联烯酸酯6中的芳基上含有不同电性的取代基时,均可顺利进行反应,获得相应的产物(Z)-5aa-(Z)-5oa,收率为27-84%。其中,仅芳基上有含有甲硫基的联烯酸酯底物,反应收率较低,如(Z)-5ma。当联烯酸酯6中的R1为-Me/-Bn/-Cy/-nBu或者R2为-Me/-Bn时,也能够顺利进行反应,获得相应的产物(Z)-5pa-(Z)-5ua,收率为76-86%。其次,当磺酰氯底物2中的R为不同电性取代的芳基、噻吩基或正丙基时,也与体系兼容,获得相应的产物(Z)-5bb-(Z)-5bl,收率为42-88%。除了磺酰氯衍生物以外,磺酰溴衍生物也是合适的底物,如(Z)-5bm,收率为71%。值得注意的是,该策略具有出色的官能团耐受性。
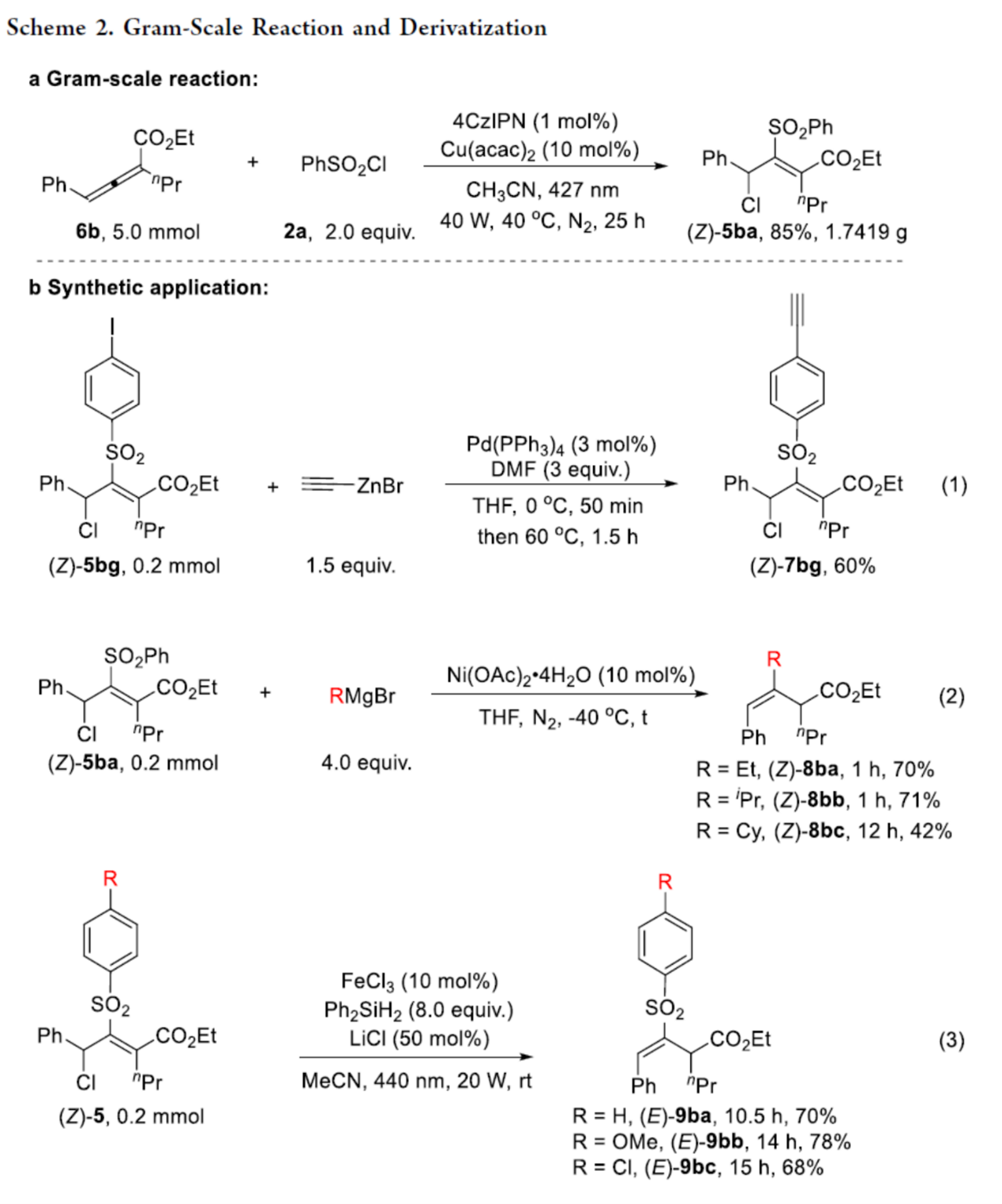
紧接着,作者对反应的实用性进行了研究(Scheme 2)。首先,6b与2a的克级规模实验,同样可以85%的收率得到产物(Z)-5ba。其次,合成的产物可进行多种衍生化实验。例如,产物(Z)-5bg经Negishi偶联反应,可获得化合物(Z)-7bg,收率为60%。产物(Z)-5ba与格式试剂进行反应,可获得化合物(Z)-8ba-(Z)-8bc,收率为42-71%。产物(Z)-5还可进行消除反应,可获得化合物(Z)-9ba-(Z)-9bc,收率为68-78%。
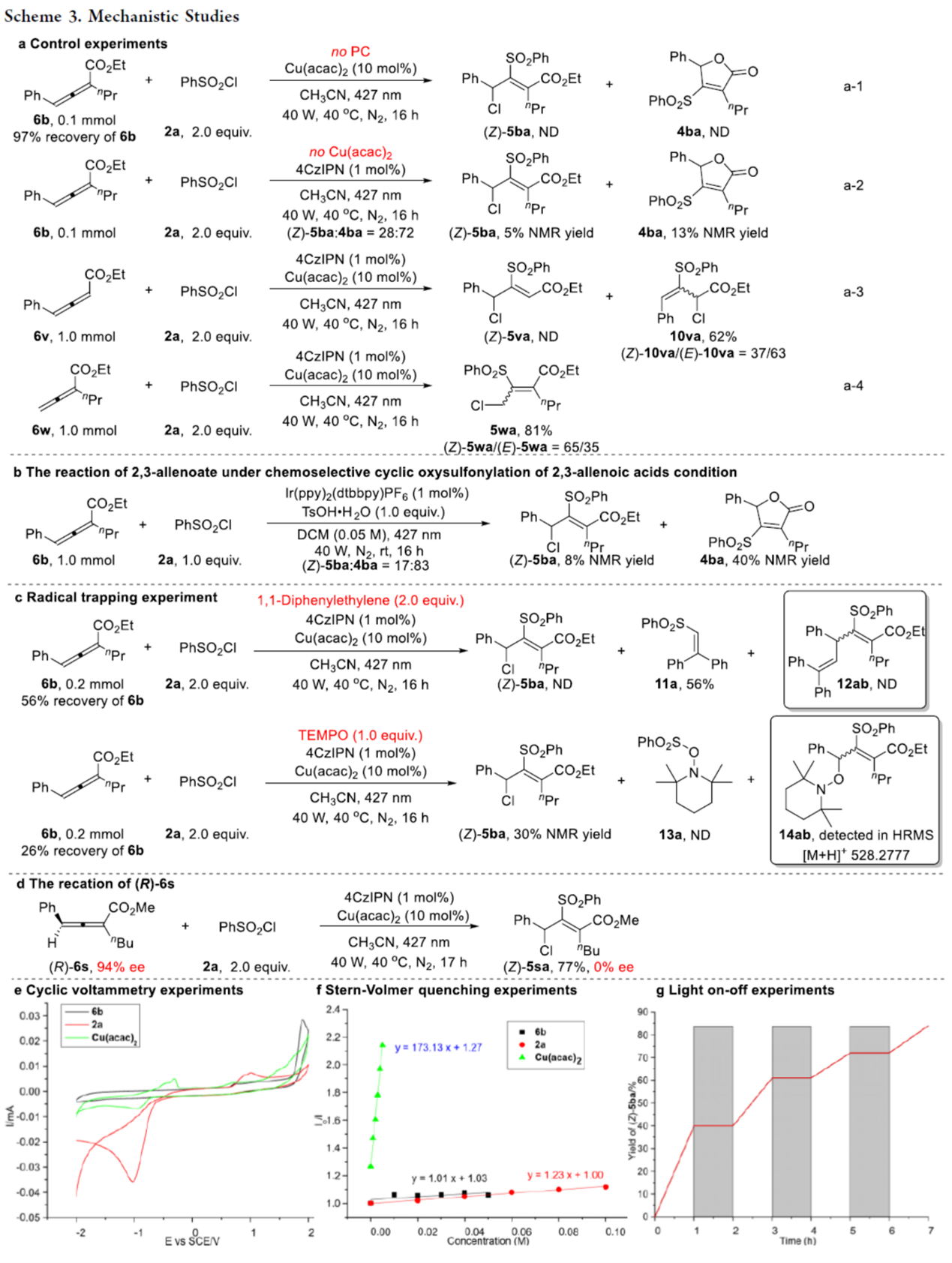
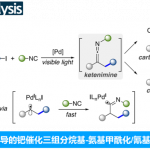
随后,作者对反应的机理进行了相关的研究(Scheme 3)。首先,控制实验结果表明,4CzIPN和Cu(acac)2对该转化反应均具有关键作用。同时,联烯酸酯4-位的芳环与2-位烷基,对该转化反应也至关重要(Scheme 3a)。6b和2a的对照实验结果,同样证实了4CzIPN与Cu(acac)2催化体系对生成含氯磺酰基产物(Z)-5具有关键作用(Scheme 3b)。其次,通过自由基捕获实验(Scheme 3c)以及产物的外消旋实验(Scheme 3d)结果表明,反应涉及形成磺酰基自由基与烯丙基自由基。此外,CV实验结果表明,化合物6b具有较高的还原电势,其值超出了*4CzIPN的还原范围(Scheme 3e)。Stern-Volmer淬灭实验结果表明,Cu(acac)2对激发态光催化剂*4CzIPN的淬灭效率高于化合物2a与6b(Scheme 3f),证实了Cu(acac)2是该激发态光催化剂的精确淬灭剂。Light on−off实验,证实光辐照不可或缺,并排除了链式反应机理(Scheme 3g)。
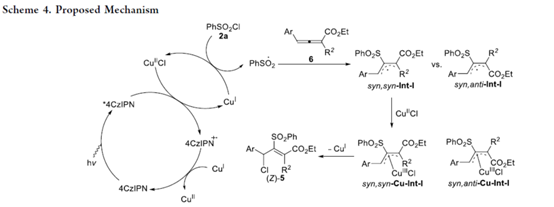
基于上述的实验研究,作者提出如下合理的反应机理(Scheme 4)。首先,激发的光催化剂*4CzIPN可被Cu(II)物种氧化淬灭,生成4CzIPN•+和Cu(I)配合物。其次,Cu(I)配合物能与磺酰氯2a发生反应,通过单电子转移过程再生Cu(II)配合物,并生成磺酰基自由基。磺酰基自由基与联烯酸酯6相互作用,生成烯丙基自由基中间体(syn,syn–Int-I和syn,anti–Int-I),其可被Cu(II)配合物种捕获,形成更稳定的烯丙基Cu(III)配合物syn,syn–Cu-Int-I。随后,经还原消除反应,得到目标氯磺酰化产物(Z)-5,同时再生Cu(I)配合物。同时,同时,4CzIPN•⁺通过与Cu(I)配合物相互作用再生为4CzIPN,从而完成催化循环。
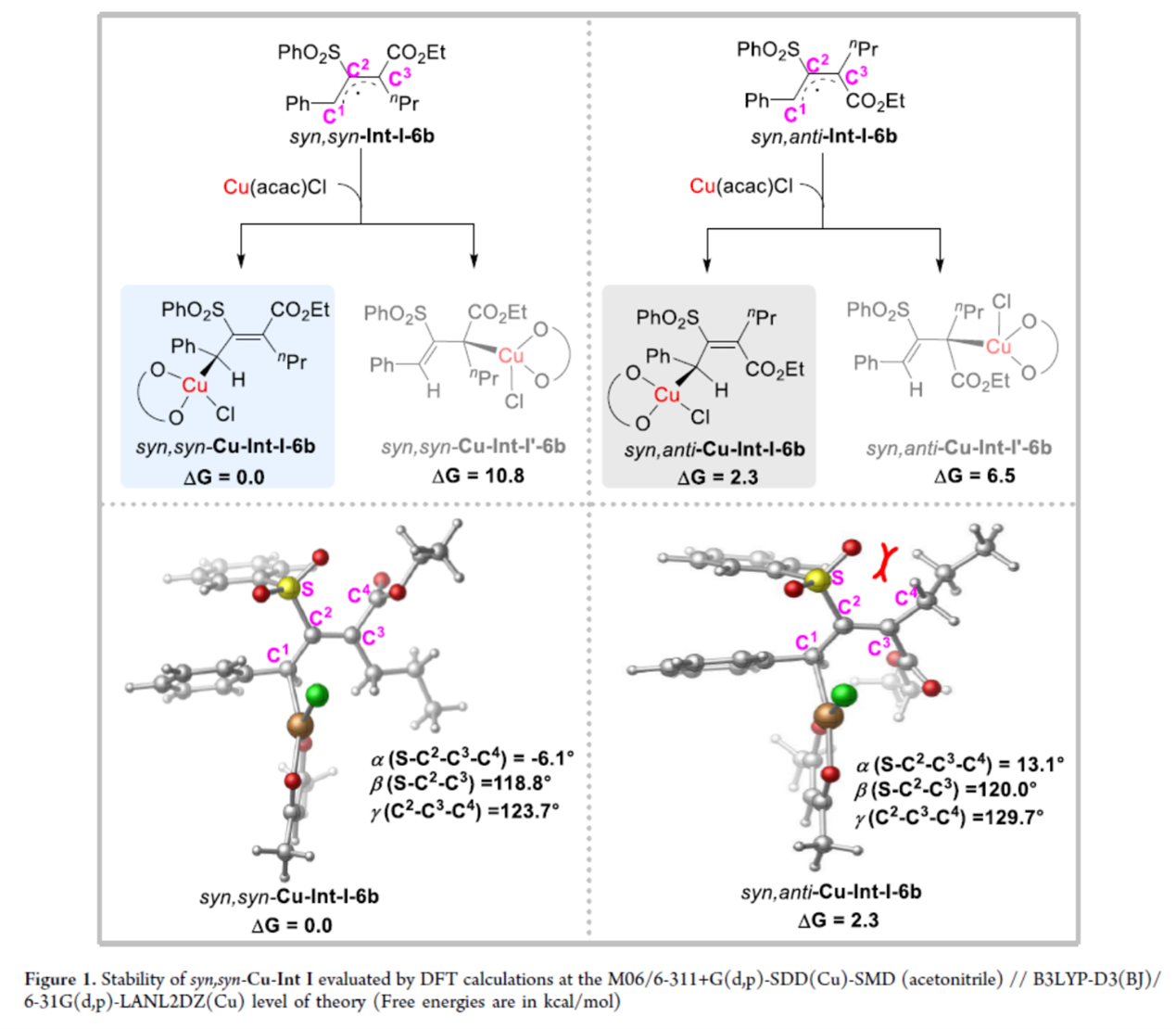
最后,作者对关键的烯丙基-CuIII中间体的区域选择性和相对稳定性进行了DFT的研究(Figure 1)。CuII(acac)Cl选择性捕获空间位阻较小的C1-位自由基中间体,形成烯丙基-CuIII配合物syn,syn–Cu-Int-I-6b和syn,anti–Cu-Int-I-6b。相比之下,由于空间排斥作用,C3-进攻的对应中间体(syn,syn–Cu-Int-I’-6b和syn,anti–Cu-Int-I’-6b)能量显著更高。此外,两个C1-进攻中间体 (syn,syn–Cu-Int-I-6b和syn,anti–Cu-Int-I-6b) 之间存在能量差,这是由于syn,anti–Cu-Int-I-6b中磺酰基与正丙基的相互作用导致其结构扭曲更显著。几何结构对比分析证实了这一点:在syn,anti–Cu-Int-I-6b中,C2=C3双键的取代基更明显偏离平面性。这些结构差异清晰地解释了观测到的中间体能量差异。
总结:
中国科学院上海有机化学研究所的麻生明等课题组报道一种全新的有光/铜双重催化体系,实现了联烯衍生物与与磺酰氯的化学选择性、区域选择性和立体选择性氯磺酰化反应,可高效合成具有磺酰基取代的Z-构型专一性四取代烯烃,具有优异的官能团兼容性。值得注意的是,Cu(acac)2通过形成立体结构明确的烯丙基铜中间体,对实现立体选择性氯磺酰化至关重要。循环伏安法与Stern-Volmer淬灭实验证实,激发态光催化剂*4CzIPN被Cu(II)物种氧化淬灭。自由基捕获实验及手性2,3-联烯酸酯反应结果表明,该催化循环中生成了磺酰基自由基与烯丙基自由基。
参考文献:
- [1] A. B. Flynn, W. W. Ogilvie, Chem. Rev. 2007, 107, 4698. doi:10.1021/cr050051k.
- [2] C. Zhou, C. Fu, S. Ma, Angew. Chem. Int. Ed. 2007, 46,4379. doi:10.1002/anie.200700619.
- [3] J. Dai, M. Wang, G. Chai, C. Fu, S. Ma, J. Am. Chem. Soc. 2016, 138, 2532. doi:10.1021/jacs.6b00051.
- [4] C. Zhu, B. Yang, T. Jiang, J. E. Backvall, Angew. Chem. Int. Ed. 2015, 54, 9066. doi:10.1002/anie.201502924.
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载.
关注Chem-Station抖音号:79473891841
请登陆TCI试剂官网查看更多内容
https://www.tcichemicals.com/CN/zh/















No comments yet.