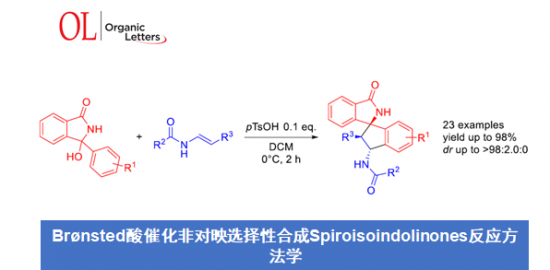
- 概要
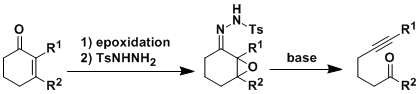
将α,β-环氧酮变成对甲苯磺酰肼之后,加入碱就会发生裂解反应。生成物是非共轭的羰基炔。一般在β位有取代基的情况下产率比较高。
- 基本文献
・Eschenmoser, A.; Felix, D.; Ohloff, G. Helv. Chim, Acta 1967, 50, 708. doi:10.1002/hlca.19670500232
・Schreiber, J.; Felix, D.; Eschenmoser, A.; Winter, M.; Gautschi, F.; Schulte-Elte, K. H.; Sundt, E.; Ohloff, G.; Kalovoda, J.; Kaufmann, H.; Wieland, P.; Anner, G. Helv. Chim. Acta 1967, 50, 2101. doi:10.1002/hlca.19670500747
・Tanabe, M.; Crowe, D. F.; Dehn, R, L,; Detre, G. Tetrahedron Lett. 1967, 8, 3943. doi:10.1016/S0040-4039(01)89757-4
・Felix, D.; Schreiber, J.; Ohloff, G.; Eschenmoser, A. Helv. Chim. Acta 1971, 54, 2896. doi:10.1002/hlca.19710540855
・Reese, C. B.; Sanders, H. P. Synthesis 1981, 276
- 反应机理
甲苯磺酰肼在碱的作用下过氧化酮的环打开,生成一个双氮化合物的中间体,接着磺酰基脱离的同时,生成羰基和炔。
- 反应实例
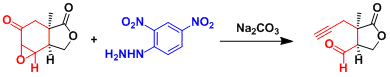
β位上没有取代基的底物用同样的条件反应会得到多种副产物,而目标产物的炔或是醛不会生成。但是,用2,4-二硝基甲苯磺酰肼的话,生成的中间体较稳定,因此能得到目标的炔和醛。以下反应例子。[1]
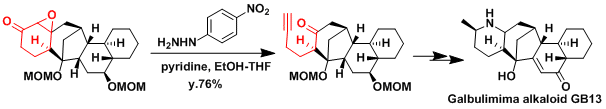
Galbulimima alkaloid GB13的合成[2]
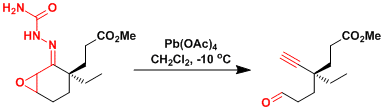
Mercicarpine的全合成[3]:使用了semicarbazone型改良法[4]。
- 实验步骤
- 实验技巧
- 参考文献
[2] Mander, L. N.; McLachlan, M. M. J. Am. Chem. Soc. 2003, 125, 2400. DOI: 10.1021/ja029725o
[3] Nakajima, R.; Ogino, T.; Yokoshima, S.; Fukuyama, T. J. Am. Chem. Soc. 2010, 132, 1236. DOI: 10.1021/ja9103233
[4] MacAlpine, G. A.; Warkentin, J. Can. J. Chem. 1978, 56, 308.