本文投稿作者 齐藩
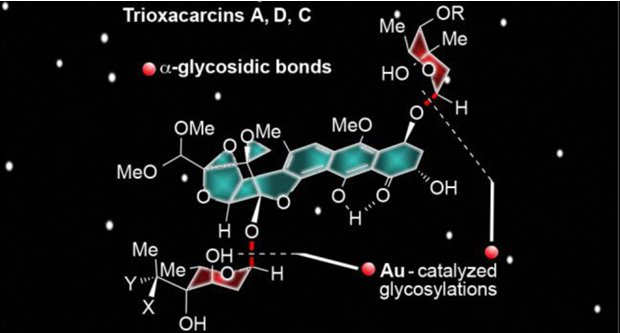
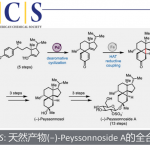
Trioxacarcins是最近合成化学家关注的分子,这个分子是一个以二氧稠环[2.2.1]并接有一个螺二氧乙烷结构为核,同时分子中会有不同数量的单糖片段分子。这一分子的重要合成目前主要由Myers课题组和Nicolaou教授课题组完成。本文将介绍Nicolaou教授课题组近期对这一类分子的全合成。这一合成完成了四种含糖的这一分子的合成,分子通过立体选择性策略被合成,这一策略主要涉及BF3·Et2O催化涉及酮和环氧乙烷的开环重排反应用于构建主体的稠环结构,金催化的糖苷化反应用于立体选择性引入糖单元[3]。这一工作由博士毕业于上海有机所的博士后蔡泉完成,现已入职复旦大学化学系。
Total Synthesis of Trioxacarcins DC-45-A1, A, D, C, and C7″-epi-C and Full Structural Assignment of Trioxacarcin C
Nicolaou, K. C.; Cai, Q.; Sun, H.; Qin, B.; Zhu, S
J. Am. Chem. Soc. 2016,138, 3118. DOI:10.1021/jacs.5b12687.
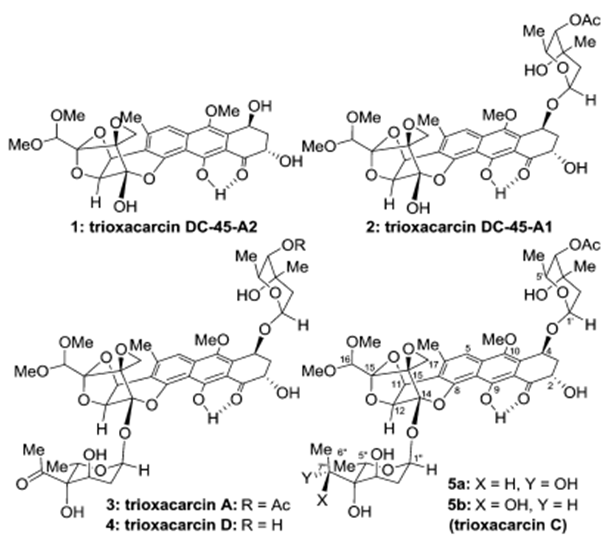
图1 Molecular structures of trioxacarcins DC-45-A2 (1), DC-45-A1 (2), A (3), D (4), and C
2011年Myers课题组在PNAS报道了DC-45-A2合成,反应最终得到一组內型的非对映异构体,只能通过HPLC拆分得到[1]。2015年Nicolaou教授课题报道了一种对映选择性且与众不同的策略,利用路易斯酸催化环氧乙烷开环重排反应用于构建主体的稠环结构完成了主体结构单元trioxacarcin DC-45-A2的合成[2](不含糖单元)。2016年Nicolaou教授接着利用金催化的糖苷化反应用于立体选择性引入糖单元,完成了Trioxacarcins DC-45-A1, A, D, C, and C7″-epi-C的合成[3]。
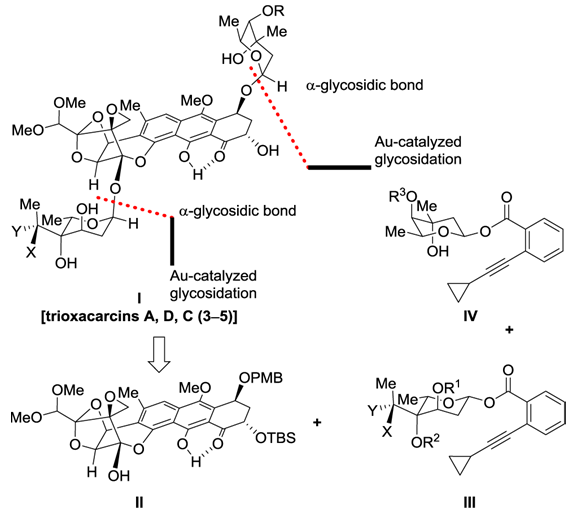
1. 逆合成分析:
首先是通过BF3 Et2O催化涉及酮和环氧乙烷的开环重排反应用于构建二氧稠环[2.2.1]并接有一个螺二氧乙烷的主体结构。后通过金催化的糖苷化反应用于立体选择性引入糖单元完成分子的合成。
图3 Nicolaou‘s Retrosynthetic Analysis of Trioxacarcins
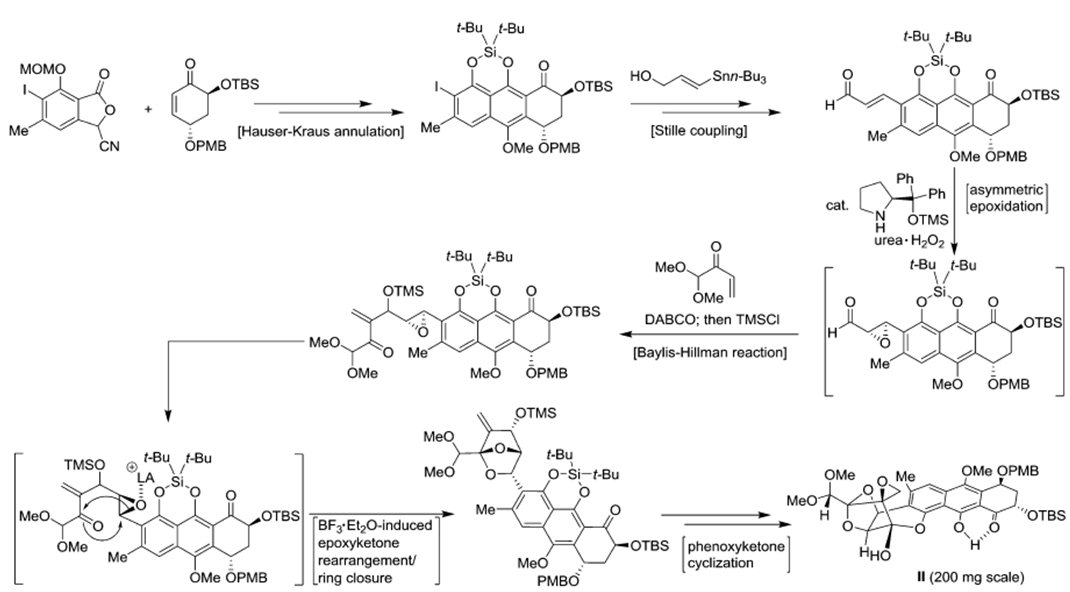
2. Synthesis of Common Trioxacarcin Precursor II
图4 Lewis acid-induced cascade rearrangement of epoxyketone
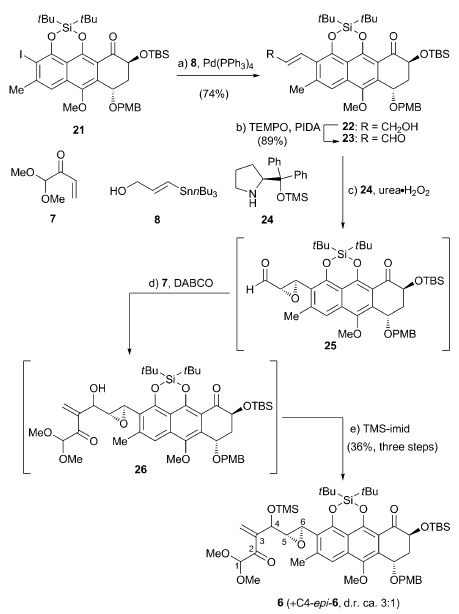
首先是通过Hauser-kraus annulation反应合成萘氢醌结构[4],醌式结构容易转化成苯酚式结构,后发生stille coupling得到烯酮式结构,再通过Jorgensen asymmetric
epoxidation of αβ-unsaturated aldehyde得到环氧乙烷中间体[5],该中间体与烯酮结构发生Baylis-Hillman反应得到关键重排反应中间体[6]。
图5 Jorgensen asymmetric epoxidation of a,b-unsaturated aldehyde
3. 关键反应之一
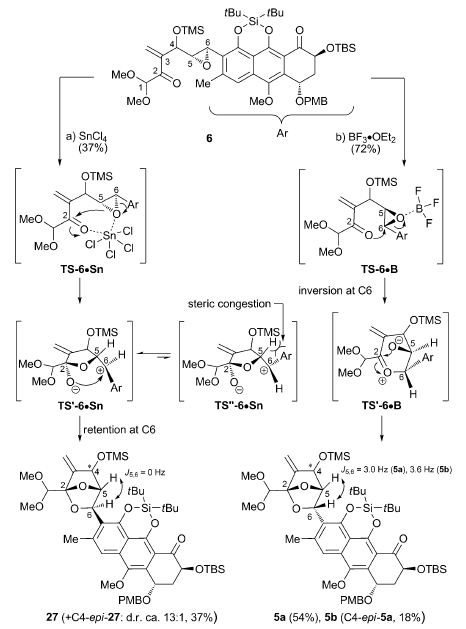
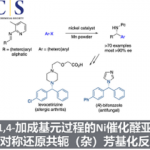
路易斯酸催化涉及酮和环氧乙烷的开环重排反应。6在不同路易斯酸作用下得到一对非对映异构体,SnCl4大体积路易斯酸同时作用酮和环氧乙烷上的氧,经过过渡态TS-6·Sn最后通过氧负离子背面进攻得到化合物27。当用小体积的强路易斯酸BF3Et2O时,催化剂作用于环氧乙烷,羰基上的氧进攻取代基多的碳发生开环反应,随即氧负离子进攻离子化的羰基得到5a。
图6Lewis acid-induced cascade rearrangement of epoxyketone
4. 关键反应之二
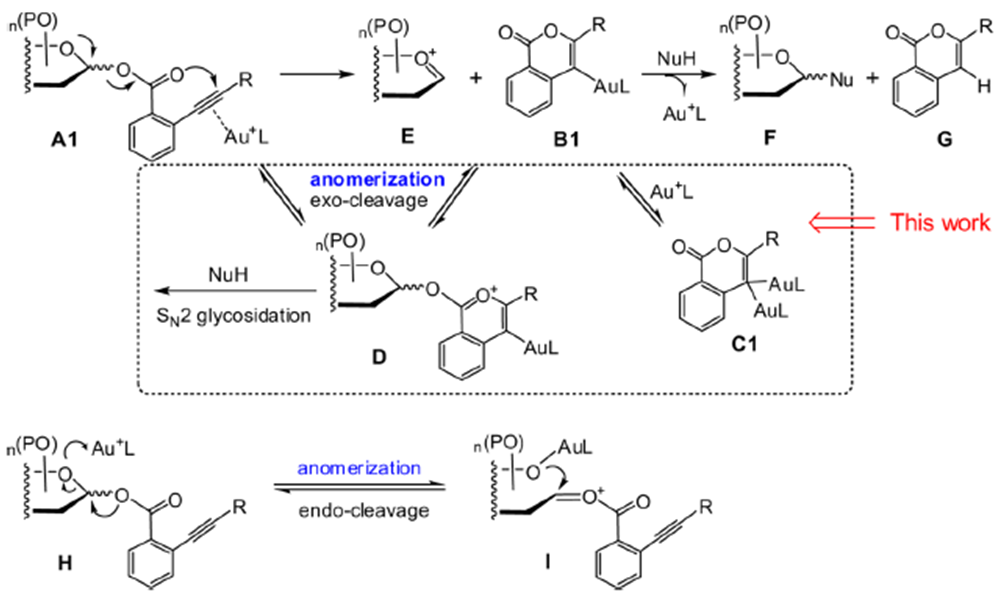
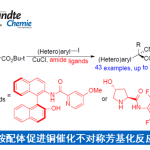
金催化的糖苷化反应用于立体选择性引入糖单元。2008年,上海有机所上海有机所俞飙研究员报道了金催化的糖苷化反应,并将这一反应用复杂多糖的全合成中,2013年详细研究了这一反应的历程[6]。该反应利用邻炔基苯甲酸为给体,通过金催化实现糖苷化。
图7 Nicolaou’s synthesis of carbohydrate donors
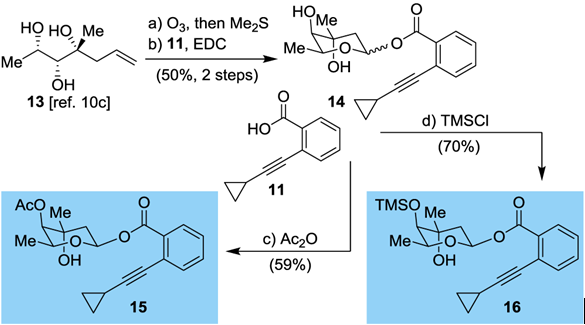
光学纯的三醇经臭氧和二甲硫醚作用合成得到吡喃糖,然后与化合物11在EDC缩合下得到特定的糖的给体11,通过两种不同保护策略可得到两种β异头碳的糖基给体15, 16。
图8 Gold-catalyzed glycosylation reactions
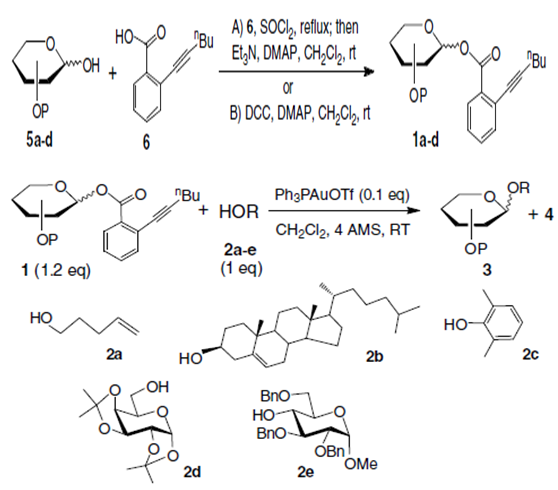
DCC作用下,糖与6缩合成糖苷给体1,或者是先利用二氯亚砜得到酰氯,然后在DMAP作用下合成1,然后1与糖在金催化剂催化下得到糖苷化的产物。
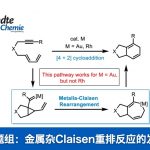
图9 Mechanism of gold-catalyzed glycosylation reactions
金催化剂与碳碳三键配位,经过分子内的重排得到一个稳定的六元环中间体B1,然后亲核试剂进攻E得到糖苷化产物,也可能是通过D经过SN2糖苷化得到产物。
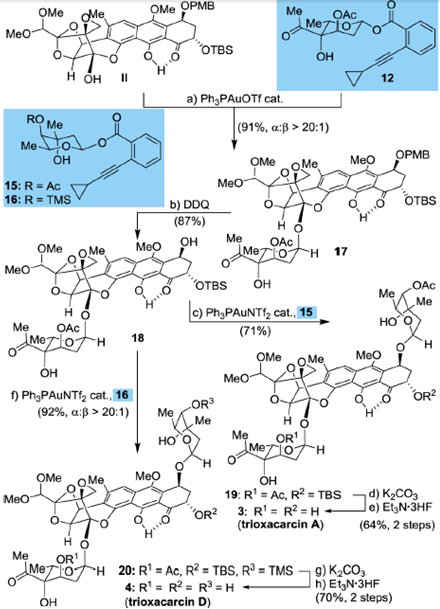
5. Synthesis of Trioxacarcins A, D
图10 Nicolaou’s synthesis of Trioxacarcins A, D
化合物Ⅱ经PMB和TBS保护,先考虑糖苷化主体稠环结构的羟基,这一桥头碳的羟基可以很好地反应,并且α:β>20:1,然后经DDQ氧化去除PMB,再糖苷化六元环上的羟基,然后经K2CO3和Et3N在THF作用下去除TBS,取代基不同分别得到Trioxacarcins A, D。
6. Synthesis ofTrioxacarcins DC-45-A1
图11Nicolaou’s synthesis of Trioxacarcins DC-45-A1
Trioxacarcins DC-45-A1的糖基在苯并六元环上,因此这里需要先保护桥头碳的羟基,化合物Ⅱ中苯并六元环上的羟基DDQ氧化去除PMB,然后经过金催化的糖苷化反应并且K2CO3和Et3N在THF作用下去除TBS合成得到目标产物。
7. Synthesis of C, and C7″-epi-C
图12Nicolaou’s synthesis of C, and C7″-epi-C
这两个分子的合成相对更有挑战性,一方面要合成立体选择性制备糖苷受体25a, 25b; 另一方面要控制产物为α糖苷键的产物。其他过程与之前一致,完成了Trioxacarcins C, and C7″-epi-C的合成。
参考文献
- [1] (a) Švenda, J.; Hill, N.; Myers, A. G. Proc. Natl. Acad. Sci. U. S. A. 2011, 108, 6709. DOI: 10.1073/pnas.1015257108. (b) Magauer, T.; Myers, A. G. Org. Lett. 2011, 13, 5584. DOI:10.1021/ol202315m.
- [2] Nicolaou, K. C.; Cai, Q.; Qin, B.; Petersen, M. T.; Mikkelsen, R. J.; Heretsch, P., Total synthesis of trioxacarcin DC-45-A2. Angew. Chem. Int. Ed. 2015,54, 3074. DOI: 10.1002/anie.201410369.
- [3] Nicolaou, K. C.; Cai, Q.; Sun, H.; Qin, B.; Zhu, S., Total Synthesis of Trioxacarcins DC-45-A1, A, D, C, and C7”-epi-C and Full Structural Assignment of Trioxacarcin C. J. Am. Chem. Soc. 2016,138, 3118. DOI: 10.1021/jacs.5b12687.
- [4] (a) Hauser, F. M.; Rhee, R. J. Am. Chem. Soc. 1977, 99, 4533. DOI: 10.1021/ja00455a069. (b)Hauser, F. M.; Rhee, R. J. Org. Chem. 1978, 43, 178 .DOI: 10.1021/jo00395a048.
- [5] M. Marigo, J. Franzén, T. B. Poulsen, W. Zhuang, K. A. Jørgensen, J. Am. Chem. Soc. 2005, 127, 6964. DOI: 10.1021/jo00395a048.
- [6] (a) Baylis, A. B.; Hillman, M. E. D. Chem. Abstr. 1972, 77, 34174.(b) Drewes, S. E.; Roos, G. H. P. Tetrahedron. 1988, 44, 4653. DOI:org/10.1016/S0040-4020(01)86168-8.
- [7] (a) Li, Y.; Yang, Y.; Yu, B. Tetrahedron Lett. 2008, 49, 3604. DOI:10.1016/j.tetlet.2008.04.017. (b) Yang, Y.; Li, Y.; Yu, B. J. Am. Chem. Soc. 2009, 131, 12076. DOI: 10.1021/ja9055245. (c) Li, Y.; Yang, X.; Liu, Y.; Zhu, C.; Yang, Y.; Yu, B. Chem. -Eur. J. 2010, 16,1871. DOI: 10.1002/chem.200902548. (d) Zhang, Q.; Sun, J.; Zhu, Y.; Zhang, F.; Yu, B. Angew. Chem., Int. Ed. 2011, 50, 4933. DOI: 10.1002/anie.201100514. (e) Tang, Y.; Li, J.; Zhu, Y.; Li, Y.; Yu, B. J. Am. Chem. Soc. 2013, 135, 18396. DOI: 10.1021/ja4064316.
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!

















No comments yet.