概要
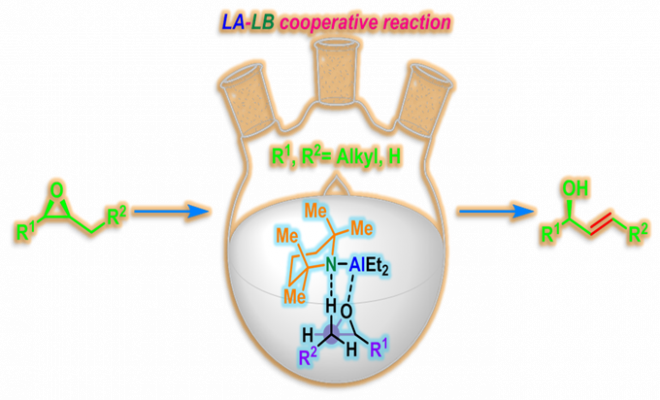
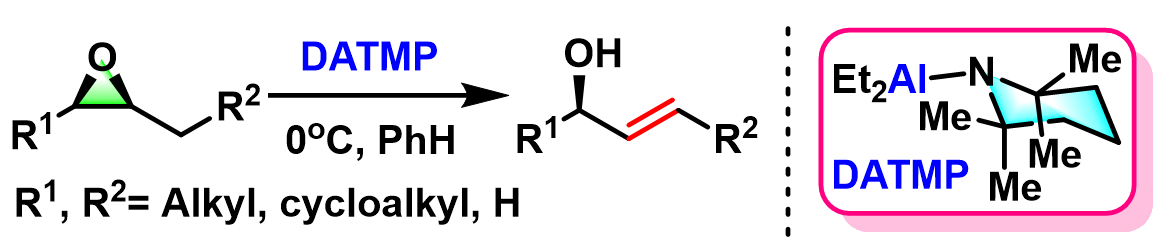
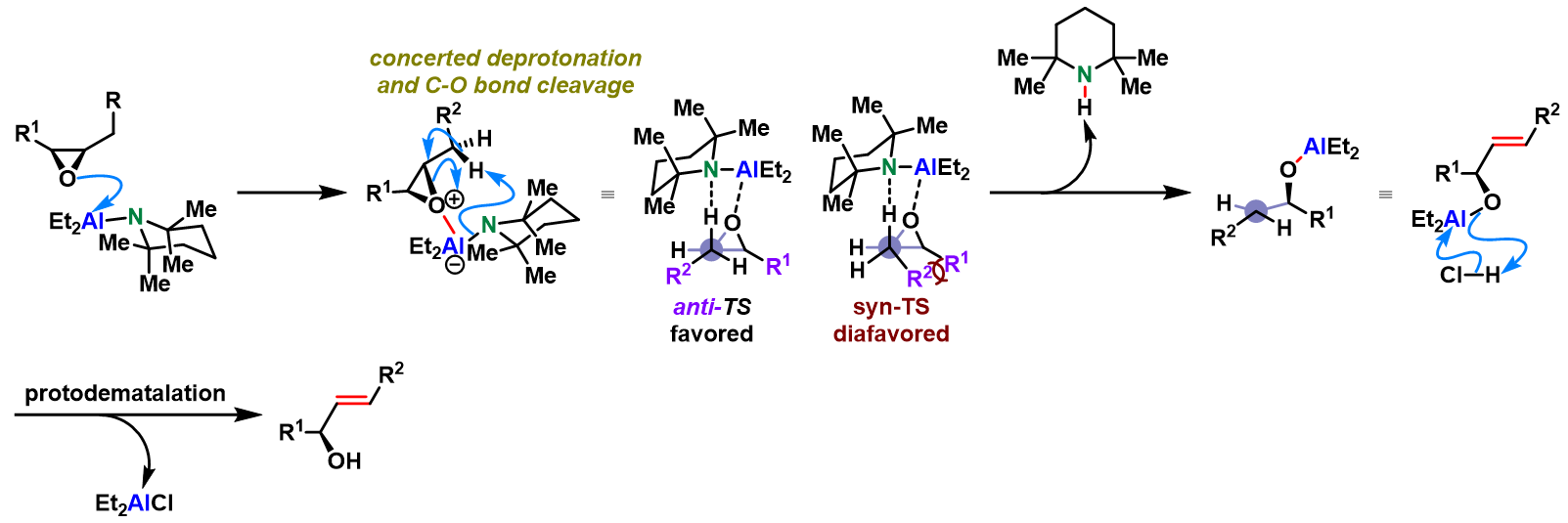
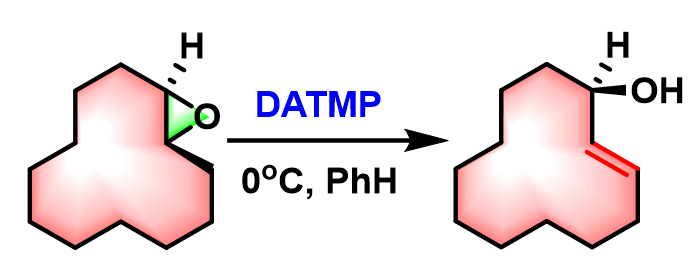
Nozaki-Yamamoto消除(Nozaki-Yamamoto elimination)是在氨基有机铝(organoaluminum amide, 又称为铝氨基碱,aluminum amide base)试剂 2,2,6,6-四甲基哌啶基二乙基铝 (diethylaluminum 2,2,6,6-tetramethylpiperidide, DATMP)[1]-[3]作用下,环氧化物进行的高度区域及立体专一性开环重排过程,生成相应烯丙醇类化合物的反应[1]-[3]。
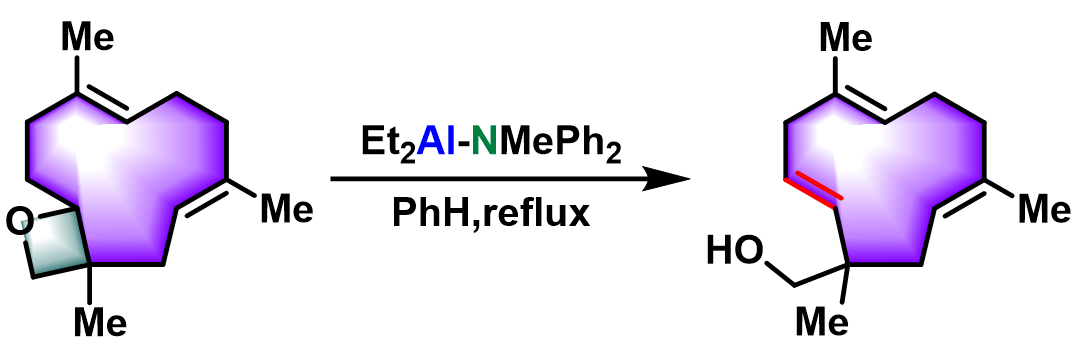
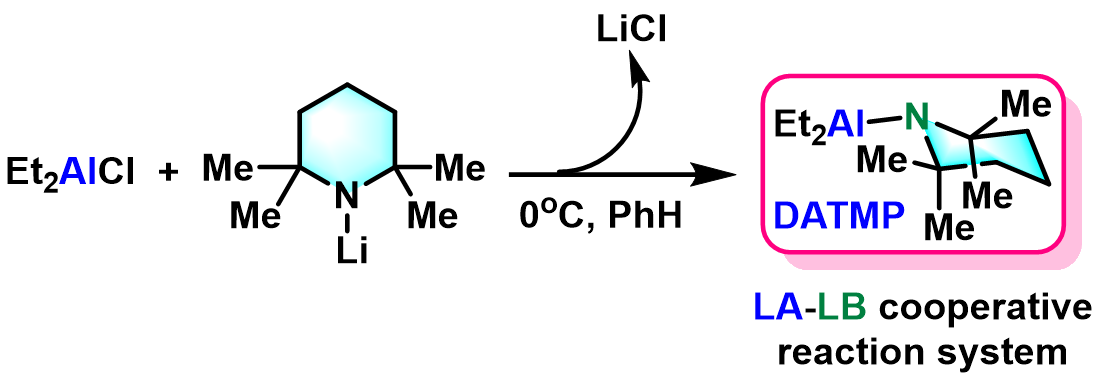
该反应在1974年由日本京都大学工业化学系 (京都大学工学部工業化学教室, Department of Industrial Chemistry, Kyoto University)的山本尚 (山本 尚, Yamamoto Hisashi)与野崎一 (野崎 一, Nozaki Hitoshi)教授首次报道[1]。Nozaki-Yamamoto消除反应极高的区域及立体专一性源于铝氨基碱试剂比之前报道的锂氨基碱[4]-[6]与丁基锂[7]试剂具有更高的立体位阻,以及该试剂特有的Lewis酸-碱协同反应 (LA-LB cooperative reaction)特性。反应完成后,手性环氧化物的构型保持,同时形成trans-双键。该反应对于与碱存在竞争性亲核加成反应的末端环氧化物同样适用。1977年该研究组采用N-甲基苯胺基二乙基铝,将底物扩展至氧杂环丁烷,成功实现了高烯丙醇的合成[8]。
目前已经广泛应用于各类烯丙醇[1]-[3]及高烯丙醇[8]类化合物的合成及部分天然产物全合成时的关键步骤[3], [8]。
基本文献
- [1] A. Yasuda, S. Tanaka, K. Oshima, H. Yamamoto, H. Nozaki, J. Am. Chem. Soc. 1974, 96, 6513. doi: 10.1021/ja00827a044.
- [2] A. Yasuda, H. Yamamoto, H. Nozaki, Bull. Chem. Soc. Jpn. 1979, 52, 1705. doi: 10.1246/bcsj.52.1705.
- [3] H. Yamamoto, Tetrahedron 2007, 63, 8377. doi: 10.1016/j.tet.2007.05.128.
- [4] P. Thummel, B. Rickborn, J. Org. Chem. 1971, 36, 1365. doi: 10.1021/jo00809a011.
- [5] J. K. Crandall, H. Chang, J. Org. Chem. 1967, 32, 435. doi: 10.1021/jo01288a038.
- [6] C. Cope, A. Trumbull, A. PatriciaTrumbull, R. Elmer J. Am. Chem. Soc. 1958, 80, 2844-2849. doi: 10.1021/ja01544a063.
- [7] R. W. Thies, M. Gasic, D. Whalen, J. D. Grutzner, M. Sakai, B. Johnson, S. Winstein, J. Am. Chem. Soc. 1972, 94, 2262. doi: 10.1021/ja00762a015.
- [8] Y. Kitagawa, A. Itoh, S. Hashimoto, H. Yamamoto, H. Nozaki, J. Am. Chem. Soc. 1977, 99, 3864. doi: 10.1021/ja00453a069.
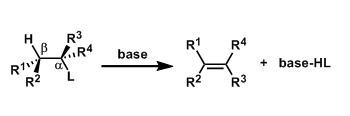
反应机理
参考文献
- [1] S. Bertillson, M. Sodergren, P. Andersson, J. Org. Chem. 2002, 67, 1567. doi: 10.1021/jo010934l.
- [2] C. Cope, H. Lee, E. Petree, J. Am. Chem. Soc. 1958, 80, 2849. doi: 10.1021/ja01544a064.
- [3] B. M. Trost, M. J. Bogdanowicz, J. Am. Chem. Soc. 1973, 95, 5311. doi: 10.1021/ja00797a036.
- [4] A. C. Cope, J. K. Heeren, J. Am. Chem. Soc. 1965, 87, 3125. doi: 10.1021/ja01092a021.
- [5] B. Rickborn, R. P. Thummel, J. Org. Chem. 1969, 34, 3583. doi: 10.1021/jo01263a078.
- [6] R. P. Thummel, B. Rickborn, J. Am. Chem. Soc. 1970, 92, 2064. doi: 10.1021/ja00710a045.
- [7] R. P. Thummel, B. Rickborn, J. Org. Chem. 1971, 36, 1365. doi: 10.1021/jo00809a011.
- [8] C. L. Kissel, B. Rickborn, J. Org. Chem. 1972, 37, 2060. doi: 10.1021/jo00978a002.
反应实例
链状烯丙醇的合成[1]-[2]
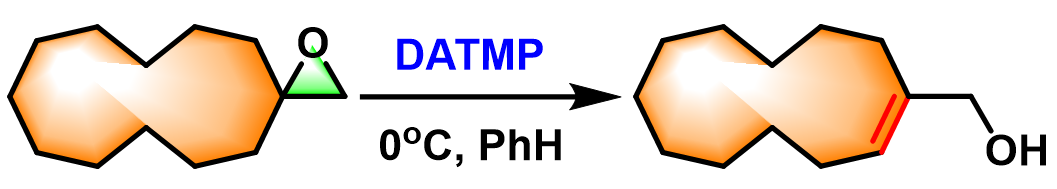
环烯丙醇的合成[1]
实验步骤
DATMP的原位生成:0 oC下,将二乙基氯化铝 (1 eq.)的苯溶液滴入到2,2,6,6-四甲基哌啶基锂 (1 eq.)的苯溶液中。将产生的浆状混合物搅拌30 min后,立即用于后续的Nozaki-Yamamoto消除过程。
Nozaki-Yamamoto消除过程:0 oC下,将原位生成的DATMP的苯溶液(4 eq., 0.4 M)滴加至环氧化物的苯溶液中(1 eq., 底物浓度为0.33 M),超过五分钟后,滴加结束。维持0 oC,将上述反应混合物继续搅拌,直至反应结束。反应结束后,加入冰冷却的1M HCl 淬灭反应。淬灭结束后,分出有机相,水相继续用乙醚进行萃取。将合并的有机相依次用饱和食盐水洗涤、无水硫酸钠干燥后,减压除去溶剂。粗产物采用制备TLC (乙醚/正己烷1:2v/v 作为展开剂)进行分离,获得相应目标产物。
参考文献
- [1] A. Yasuda, S. Tanaka, K. Oshima, H. Yamamoto, H. Nozaki, J. Am. Chem. Soc. 1974, 96, 6513. doi: 10.1021/ja00827a044.
- [2] A. Yasuda, H. Yamamoto, H. Nozaki, Bull. Chem. Soc. Jpn. 1979, 52, 1705. doi: 10.1246/bcsj.52.1705.
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!
















No comments yet.