本文作者:杉杉
导读
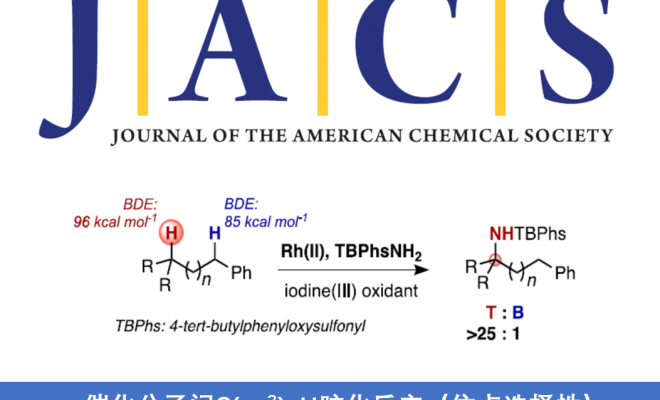
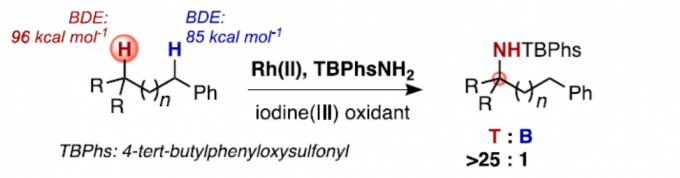
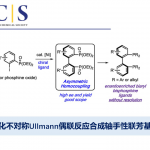
近日,巴黎萨克雷大学Philippe Dauban课题组在J. Am. Chem. Soc.上发表论文,报道了一种未活化三级C(sp3)-H键的分子间胺化反应,从而以高收率合成α,α,α-三取代酰胺衍生物。值得注意的是,对于同时含有未活化三级C-H键与苄基C-H键时,当使用Rh2(S-tfpttl)4为催化剂,TBPhsNH2为氨基磺酸盐时,反应优先选择三级C-H键。此外,将反应放大至50 mmol时,可将催化剂的量降至0.01mol%。
Catalytic Intermolecular C(sp3)-H Amination: Selective Functionalization of Tertiary C−H Bonds vs Activated Benzylic C-H Bonds
Erwan Brunard, Vincent Boquet, Elsa Van Elslande, Tanguy Saget, and Philippe Dauban*
J.Am. Chem. Soc.ASAP DOI:10.1021/jacs.1c03872
正文
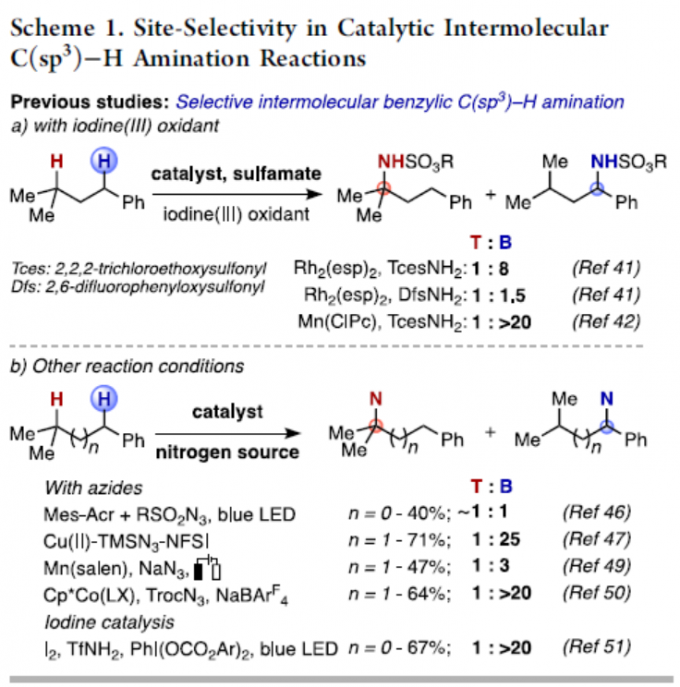
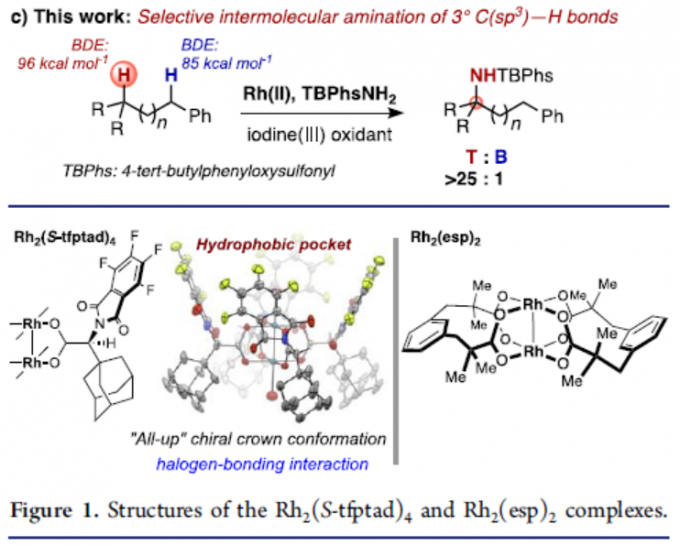
在有机合成和药物化学中,定点选择性C(sp3)-H键官能能化反应是十分具有潜力和挑战的。对C(sp3)-H键活化的策略大概有以下几种。第一种通用方法是基于导向基团的定向功能化反应,包括使用配位基团或分子内反应。对于无导向C-H功能化反应的位点选择性,主要基于底物的固有参数(即C-H键的键解离能(BDE)或极性效应)。目前,已通过烷烃硼化、卡宾插入,C-H氧化等来突破底物的局限性。同时,催化C(sp3)-H胺化反应已成为具有价值的合成策略。通过使用叠氮化物、N-oxy试剂催化氮烯C-H键的插入已取得重大地进展。然而,对于同时含有苄基C-H键和叔C-H键的氮烯底物,选择性活化其中的某个C-H键则具有很大的难度。虽然已依靠催化剂改性来实现分子内C(sp3)-H选择性胺化反应,但对于分子间的反应存在的问题尚未被解决。由于底物同时存在两个不同C(sp3)-H键,无论氨基磺酸盐或金属催化剂如何改变,反应始终优先选择苄基位(Scheme 1a)。同时,在使用叠氮化物或涉及碘催化分子间C(sp3)-H胺化反应中,也观察到相同的趋势(Scheme 1b)。在此,巴黎萨克雷大学Philippe Dauban课题组通过使用Rh2(S-tfpttl)4为金属催化剂,TBPhsNH2为氨基磺酸盐时,实现了与前人工作相反C(sp3)-H选择性,使反应优先选择三级C-H键,从而合成一系列α,α,α-三取代酰胺衍生物(Scheme 1c)。
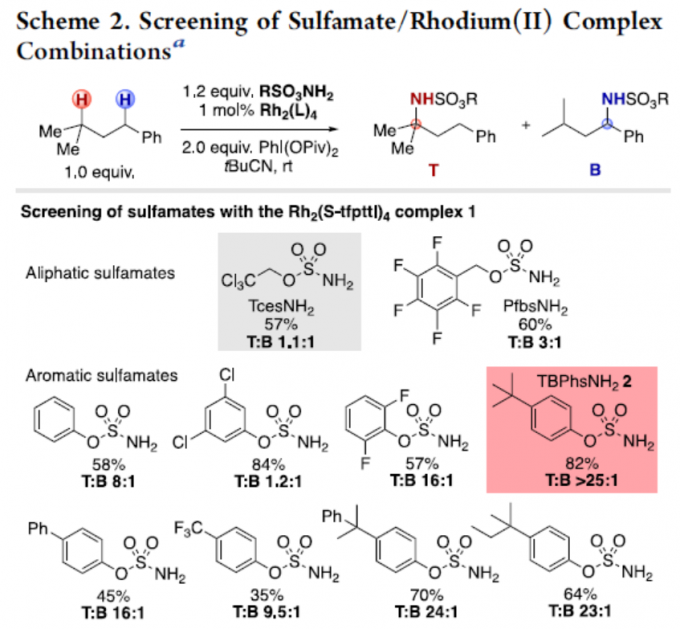
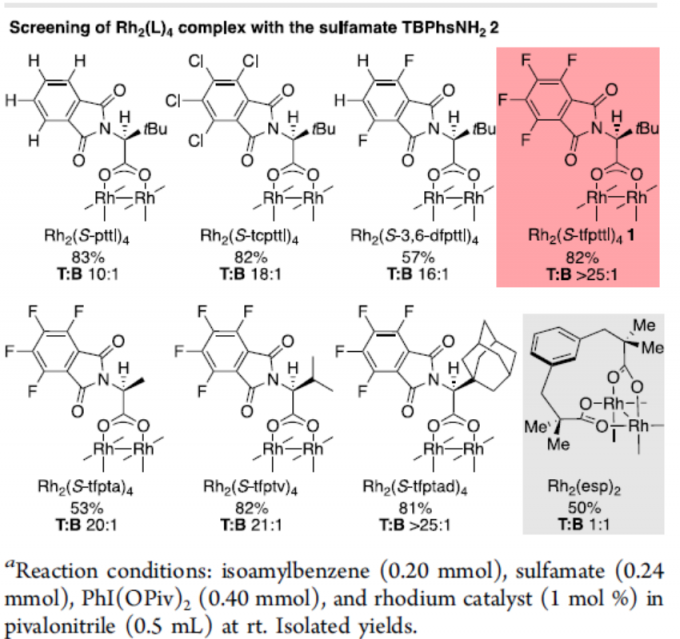
首先,对各种氨基磺酸盐和铑催化剂的大量筛选后发现(Scheme 2),室温反应以Rh2(S-tfpttl)4(1)为金属催化剂,TBPhsNH2(2)为氨基磺酸盐,PhI(OAc)2为氧化剂时,可在三甲基乙腈溶剂中,获得82 %收率和T:B > 25:1的选择性,来获得目标产物3T。
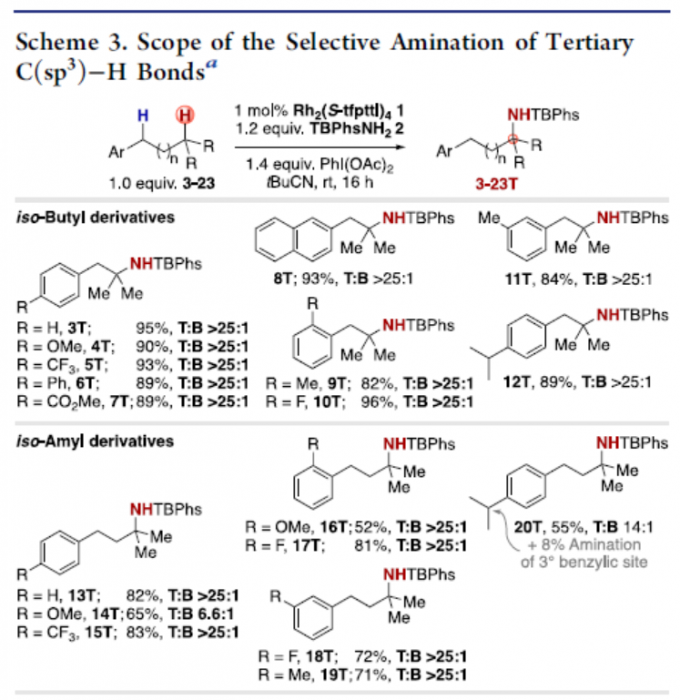
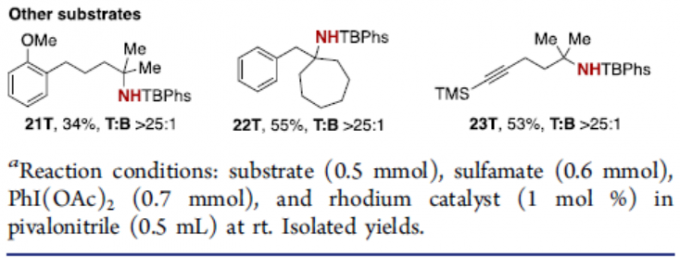
通过大量的条件筛选后,获得了最佳反应条件后,作者开始对底物范围进行了扩展(Scheme 3)。一系列异丁基和异戊基衍生物,均可顺利反应,获得相应的产物3T–20T,收率高达96%,T/B高达25:1。同时,底物中的芳基取代不受电子效应和定位效应的影响。其次,异已基衍生物(21)、环状底物(22)以及含有炔烃的底物(23),均具有良好的选择性,获得相应的产物21T–23T。
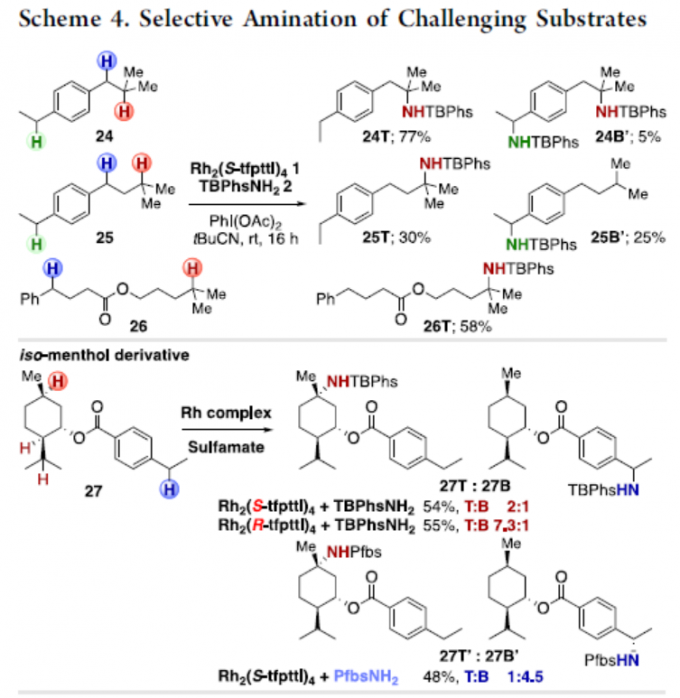
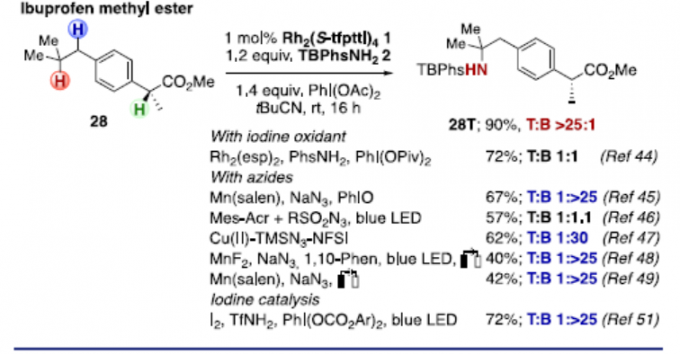
随后,作者对一些更具挑战性的底物进行了研究(Scheme 4)。首先,对于对位具有乙基的底物(24和25),异丁烯衍生物24以77%的收率获得高选择性产物24T,而异戊烯衍生物25则选择性较差。对于酯底物26,也具有良好的选择性,获得产物26T。其次,对于同时具有三个叔碳中心和一个仲苄基位点的异薄荷醇衍生物27,胺化反应优先选择在环己基环的叔C(sp3)-H键上进行。然而,当使用(R)-催化剂,可将T/B比提高至7.3:1。同时,氨基磺酸盐试剂的改变,有利于苄基位的胺化。此外,使用布洛芬甲酯28时,反应具有出色的化学选择性,获得90%收率和T/B > 25:1的产物28T。
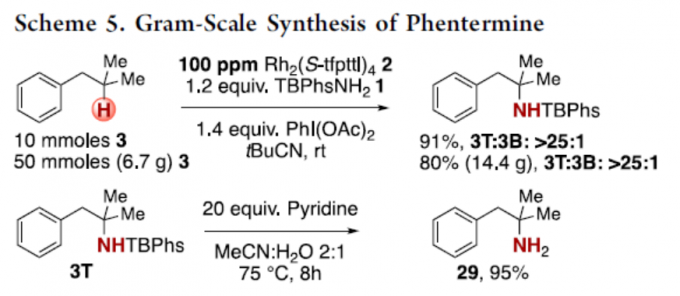
紧接着,作者对反应的实用性进行了研究(Scheme 5)。在食欲抑制剂芬特明(phentermine)的两步克级合成中,可将催化剂的负载量降至100 ppm,获得80%收率和T/B > 25:1的产物3T。同时,可在温和的条件下,于吡啶和乙腈/水的混合溶液中,可将TBPhs基团轻松除去,从而获得游离胺化合物29,收率为95%。
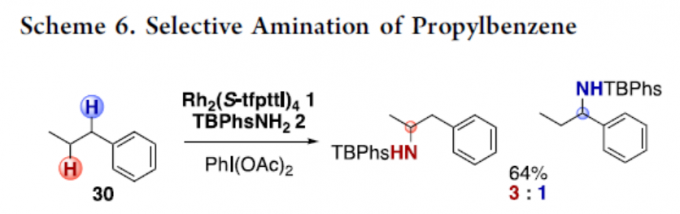
最后,作者对丙基苯的底物选择性进行了研究(Scheme 6)。反应结果表明,当以Rh2(S-tfpttl)4(1)为催化剂,TBPhsNH2(2)为氨基磺酸盐,反应优先选择二级C(sp3)-H键,以3:1选择性获得产物30T。
总结
巴黎萨克雷大学Philippe Dauban课题组报道了一种以Rh2(S-tfpttl)4为金属催化剂,TBPhsNH2为氨基磺酸盐的催化体系,成功实现了未活化三级C(sp3)-H键的分子间胺化反应,从而以优异收率合成了α,α,α-三取代酰胺衍生物。值得注意的是,对于同时含有未活化三级C-H键与苄基C-H键时,反应优先选择三级C-H键。此外,将反应放大至50 mmol时,可将催化剂的量降至0.01mol%。


















No comments yet.