本文作者:杉杉
导读
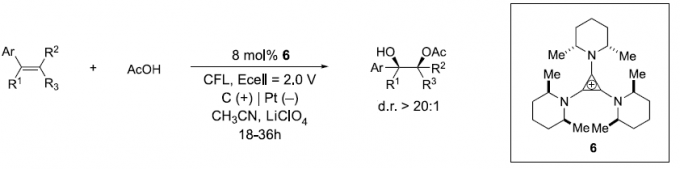
近日,Cornell大学T. H. Lambert教授课题组在JACS中发表论文,报道一种电化学光催化 (electrophotocatalytic)条件下的双官能团化反应策略。该策略能够在可见光辐射以及控制电势电解的条件下,采用三氨基环丙烯正离子 (TAC, trisaminocyclopropenium ion)作为催化剂,成功实现一系列芳基烯化合物的乙酰氧羟基化 (acetoxyhydroxylation)反应,并以优良的syn-立体选择性与非对映选择性 (d.r.高达20:1),获得相应的乙二醇单酯 (glycol monoester)产物。
Electrophotocatalytic Acetoxyhydroxylation of Aryl Olefins
H.Huang,T. Lambert, J. Am. Chem. Soc.2021, 143, 7247. doi: 10.1021/jacs.1c01967.
正文
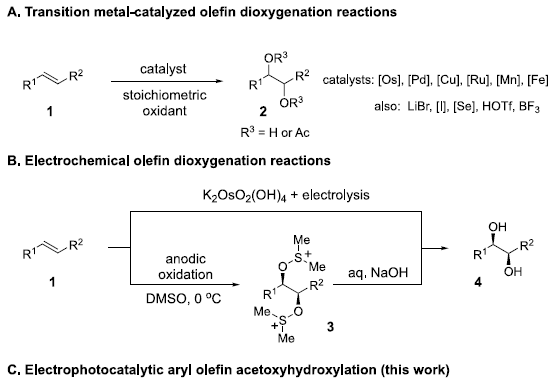
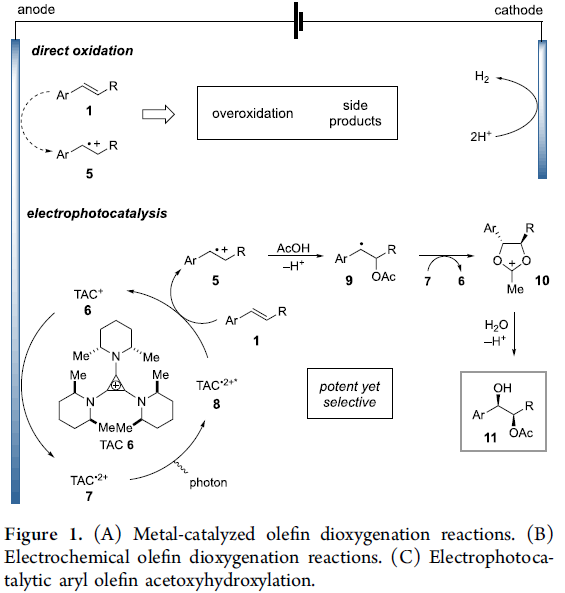
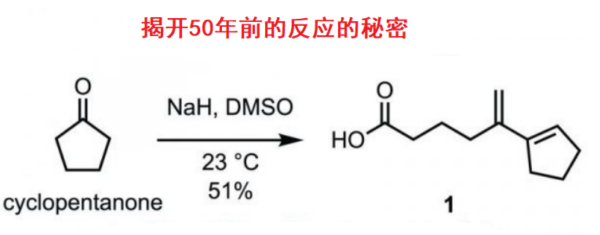
烯基化合物的双氧化反应 (dioxygenation),已经成为有机合成中最为基本的方法学策略之一。其中,采用过渡金属试剂,尤其锇试剂,促进的双氧化反应策略,应用最为广泛。然而,却存在试剂毒性较高、价格昂贵等弊端 (Figure 1A)。因此,涉及非过渡金属试剂或催化剂的双氧化策略的发展,作为有效地替代的方法,已有诸多文献报道[1]-[2]。然而,上述方法通常依赖于化学计量的氧化剂,尤其在克级规模实验中,存在操作安全性与试剂价格较为昂贵等不利因素。目前,有机电化学合成[3]-[5],能够有效地避免对于外加氧化剂 (external oxidant)的需求,因此,逐渐发展成为一种更具吸引力的合成设计策略 (Figure 1B)。Torii等[6]-[7]报道了采用锇催化的电化学策略,进而顺利完成一系列烯基化合物的双羟基化反应。理论上,能够通过烯基化合物的直接电化学单电子氧化过程,顺利实现相应烯基化合物的双氧化反应。然而,由于存在选择性控制的问题,而较难实现。同时,烯基化合物在强氧化电势的条件下,易于发生寡聚 (oligomerization)与氧化裂解等副反应。并且,双氧化产物同样能够较为容易地进行进一步的氧化。同时,Yoshida小组[8]研究发现,通过在DMSO溶剂中,进行相应的电化学氧化过程,能够有效地避免上述问题。其中,烯烃底物 1转化为双烷氧基锍 (bis-alkoxysulfonium)中间体 3,之后,通过中间体 3的水解,最终获得1,2-二醇产物 4。通过Yoshida小组发展的上述阳离子池策略 (cation pool strategy),首次实现一系列烯基化合物的直接电化学双氧化反应。然而,作者进一步研究发现,上述方法学的底物应用范围较为有限 (Figure 1B) [9]。此外,直接电化学策略的主要问题在于,由去除烯基化合物中的相关电子,需要施加足够强的阳极电势。这种足够强的阳极电势同样能够引发一系列非预期的过度氧化 (overoxidation)与寡聚等副反应过程。接下来,作者设想,能否通过三氨基环丙烯正离子 (trisaminocyclopropenium, TAC) 6 参与的电化学光催化过程,有效地解决上述问题 (Figure 1C)。首先,TAC 6能够在较为温和的电势条件下,氧化为相应的自由基双正离子 (radical dication) 7。同时,7经过光激发 (photoexcitation)之后,能够产生具有极强氧化性 (>3 V vs SCE)的中间体 8,并通过中间体 8,进一步将烯基底物 1氧化为相应的自由基正离子 5。接下来,采用亲核试剂捕获 5,形成自由基 9,并通过自由基 9的进一步氧化,形成羰基碳鎓离子 (oxocarbenium)中间体 10。最终,通过中间体 10的水解过程,获得相应的双氧化产物 11。
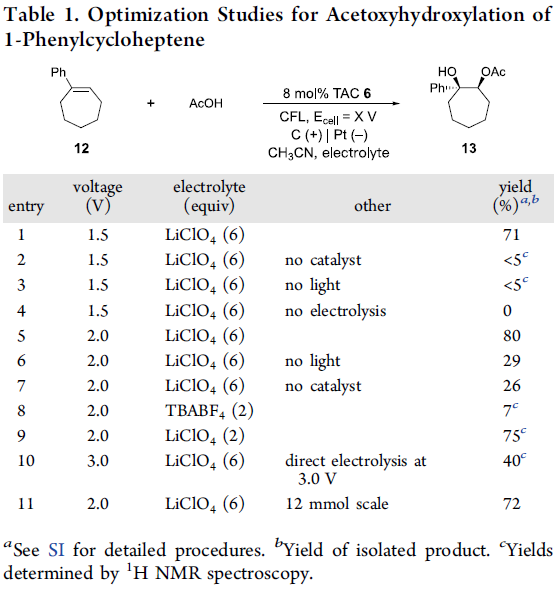
首先,作者采用12作为模型底物,进行了相关乙酰氧羟基化反应条件的优化筛选 (Table 1)。进而确定最佳的反应条件为:采用8 mol%的TAC 6作为催化剂,控制电势为2.0 V,LiClO4作为电解质,在无隔膜电解槽 (undivided cell) (碳作为阴极,Pt作为阳极)以及可见光 (compact fluorescent light (CFL) bulb)照射下进行电解,最终获得71%收率的羟基乙酸酯产物13。
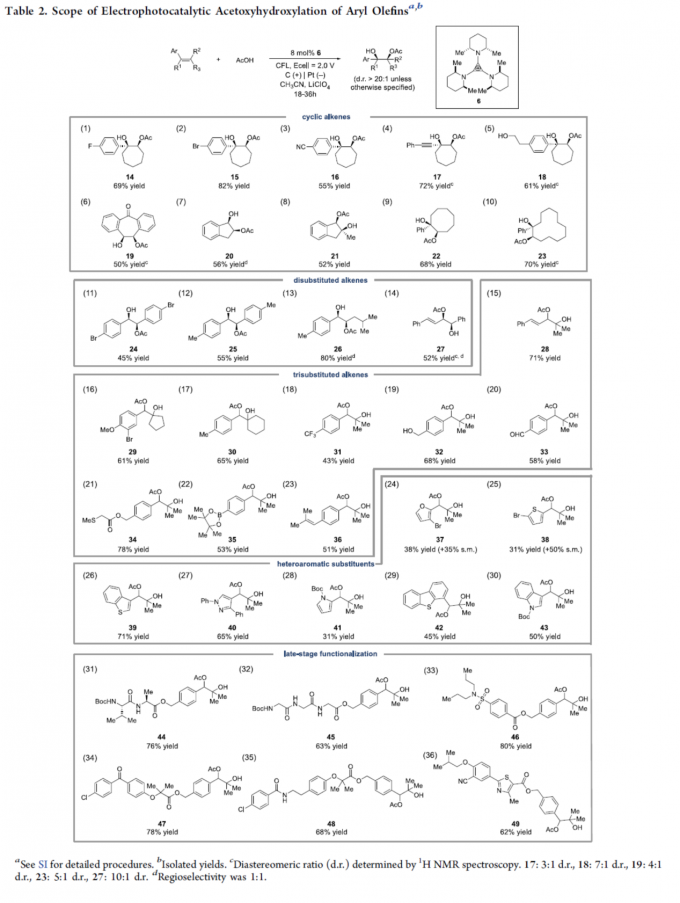
在获得上述最佳反应条件后,作者开始考察烯烃底物的应用范围 (Table 2)。研究表明,一系列不同类型的环烯均能够顺利地参与上述反应,并以优良的syn-立体选择性以及中等以上的反应收率,获得相应产物14–23。然而,在采用茚作为反应底物时,则获得区域异构体比为1:1混合物20。并且,作者发现,各类二苯乙烯衍生物同样能够较好地适用于上述反应体系,并获得产物24–25。同时,作者进一步观察到,1,3-二烯底物同样能够有效地参与相关的乙酰氧羟基化反应过程,并获得产物27–28。然而,上述反应条件对于部分非环1,2-二取代烯烃底物,则同样获得区域异构体比为1:1的混合物 (entries13与14)。同时,上述实验条件对于三取代的烯烃底物,却表现出良好的区域专一性,并获得相应的产物29–49。此外,杂环取代的烯烃底物,同样能够与上述反应体系良好地兼容,并获得产物37–43。值得注意的是,这一全新的反应策略同样能够成功应用于多种复杂分子的后期衍生化过程,例如44–49。
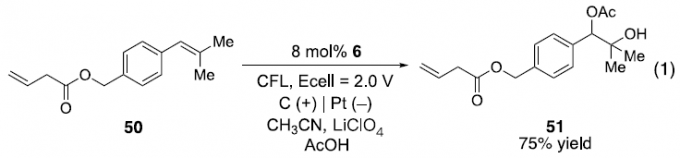
为进一步研究上述方法学中的区域选择性,作者选择取代基电子效应存在显著差异的烯基底物50,在上述标准条件下进行反应。研究表明,与通过单电子氧化引发的反应机理一致,反应过程中仅有取代苯乙烯结构单元中的C=C发生氧化,并获得75%收率的产物51。
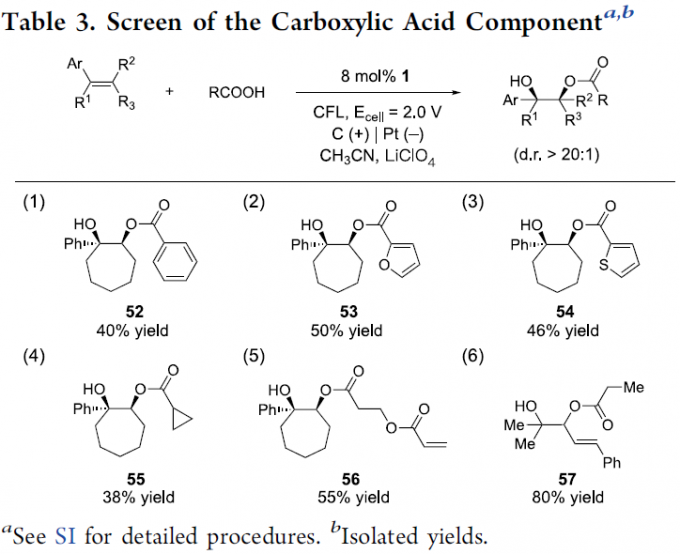
接下来,作者对羧酸的底物适用范围进行深入研究 (Table 3)。实验结果表明,除乙酸外,苯甲酸、糠酸 (furoic acid)、噻吩羧酸以及环丙基羧酸均能够有效地参与上述的酰氧羟基化过程,并获得相应产物52–55。接下来,作者发现,在采用丙烯酸作为反应底物时,则获得相应丙烯酸结构单元发生二聚的产物56。同时,作者进一步观察到,1,3-丁二烯底物与异丁酸进行上述反应时,能够以较高的反应收率获得相应的羟基酯产物57。
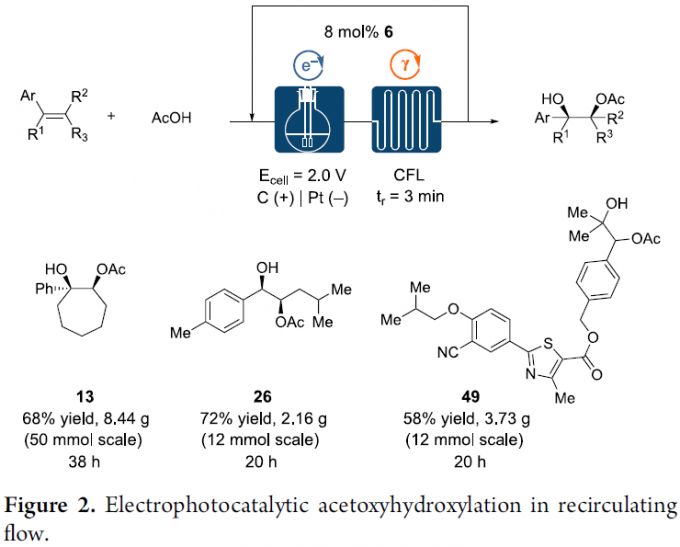
为了进一步证实上述反应策略的实用性,作者进一步进行相关的克级放大实验研究 (Figure 2)。作者通过选择连续的再循环流动工艺 (continuous recirculating flow process)[10]-[13],进而顺利完成化合物13、26以及49的克级规模合成。
总结
Cornell大学T. H. Lambert教授课题组报道了通过电化学光催化策略,采用三氨基环丙烯正离子 (TAC)作为催化剂,在可见光辐射条件下,成功实现一系列烯烃底物的乙酰氧羟基化反应。这一全新的乙酰氧羟基化反应策略具有优良的立体选择性、非对映选择性、良好的官能团兼容性以及广泛的底物适用范围等优势。同时,作者通过克级放大实验的研究,进一步证实该反应策略具有良好的合成应用价值。




















No comments yet.