本文作者:杉杉
导读
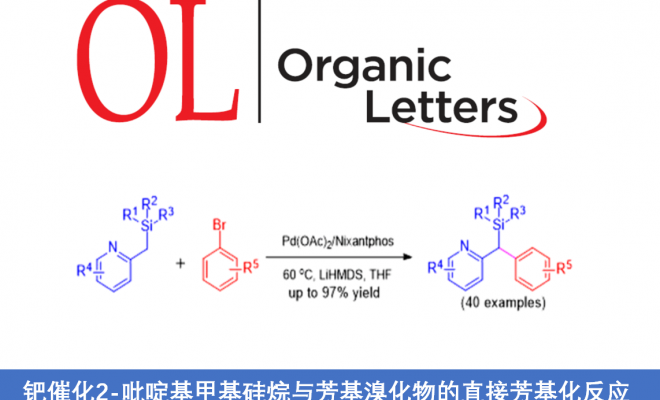
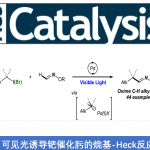
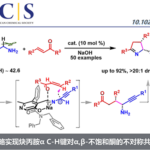
近日,南京工业大学毛建友教授课题组在Organic Letters上发表论文,报道了一种钯催化2-吡啶基甲基硅烷与芳基溴化物的直接芳基化反应,从而生成芳基(2-吡啶基)-甲基硅烷衍生物。同时,该反应具有高收率(高达97%)、良好的官能团耐受性等特点。
Palladium-Catalyzed Direct Arylation of 2‑Pyridylmethyl Silanes with Aryl Bromides
Tingzhi Lin, Pengcheng Qian, Yan-En Wang, MingjieOu, Long Jiang, Chen Zhu, Yuchuan Xu, Dan Xiong, and Jianyou Mao*
Org. Lett. ASAP DOI:10.1021/acs.orglett.1c00677
正文
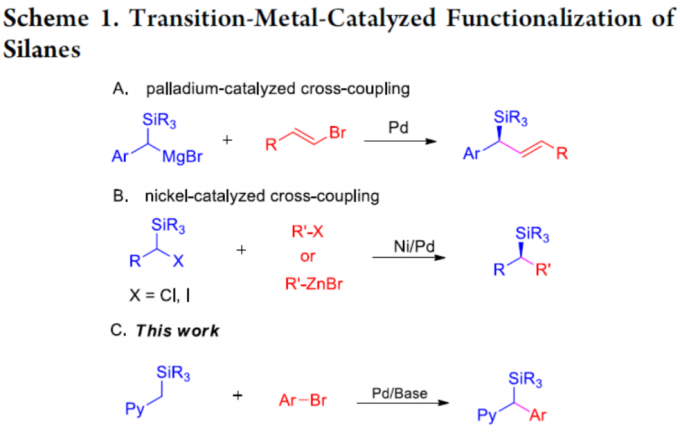
有机硅烷化合物,广泛应用于硅材料、药物等中。同时,也作为交叉偶联反应中常见底物以及过渡金属反应中的有效配体。此外,对于含有杂环的硅烷化合物已被大量研究,其中甲基硅烷的直接α-官能化反应是理想策略之一(Scheme 1),如钯催化甲硅烷基化格氏试剂与有机卤化物的交叉偶联[1]、镍催化α-甲硅烷基卤化物与乙烯基溴化物[2]或烷基锌试剂[3]之间的交叉偶联过程。然而,此类反应常需对相应的硅烷基底物进行预官能化。近年来,也报道了关于去质子交叉偶联过程实现弱酸性Csp3-H键的官能团化反应,如二芳基甲烷[4]、亚砜[5]、胺[6]以及其它[7]等。然而,对于硅烷底物的直接去质子交叉偶联尚未被研究。在此,本文将报道一种通过2-吡啶基硅烷衍生物与芳基溴化物的去质子交叉偶联反应,从而合成一系列芳基(2-吡啶基)-甲基硅烷衍生物。同时,该反应无需使用格氏试剂,可在温和的条件下进行,并且起始原料易于合成且稳定。与现有的有机硅烷合成方法相比,如末端烯烃的氢化硅烷化反应[8],过渡金属催化硅烷亲电子试剂或亲核试剂的交叉偶联反应[9],以及过渡金属催化C-H甲硅烷基化反应[10],该策略可作为合成含杂环硅烷衍生物的补充方法(Scheme 1C)。
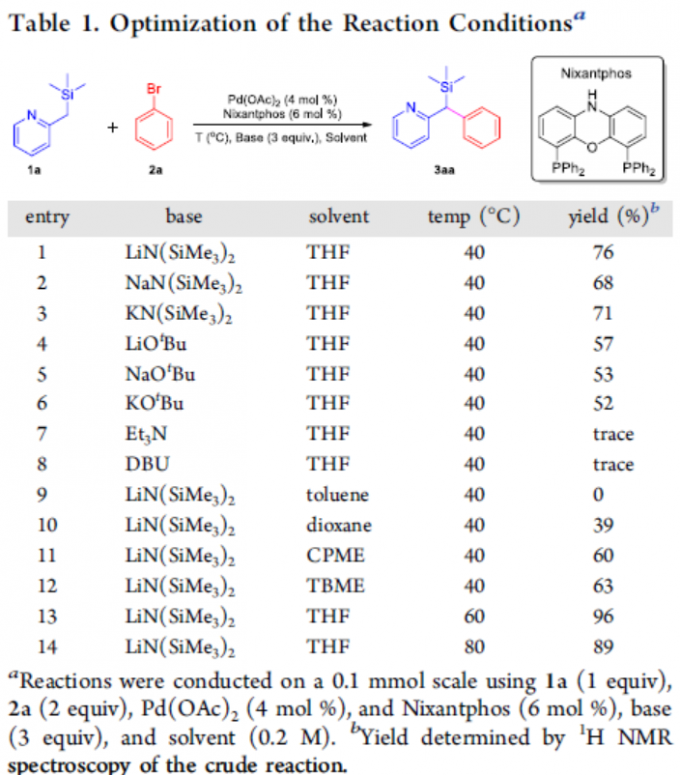
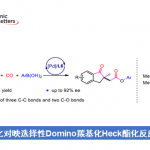
首先,作者以2-((三甲基甲硅烷基)甲基)吡啶1a和溴苯2a作为模型底物,进行了相关反应条件的筛选(Table 1)。反应的最佳条件为:以4 mol %的Pd(OAc)2为催化剂,6 mol %的Nixantphos为配体,三当量的LiN(SiMe3)2为碱,可在THF溶剂中60℃反应,获得96%收率的目标产物3aa。
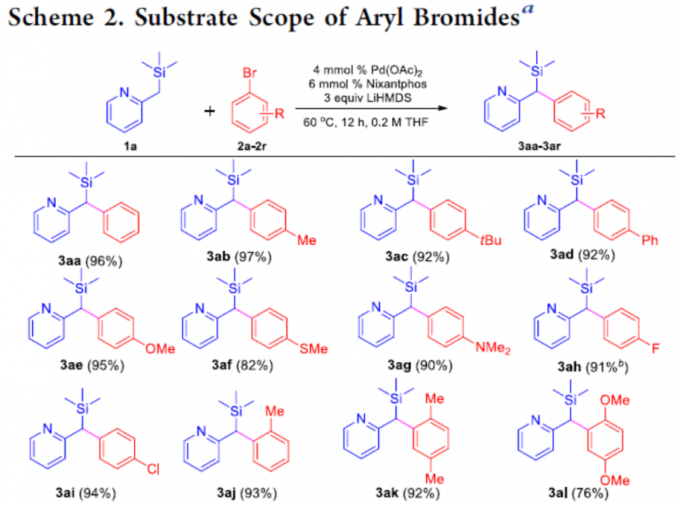
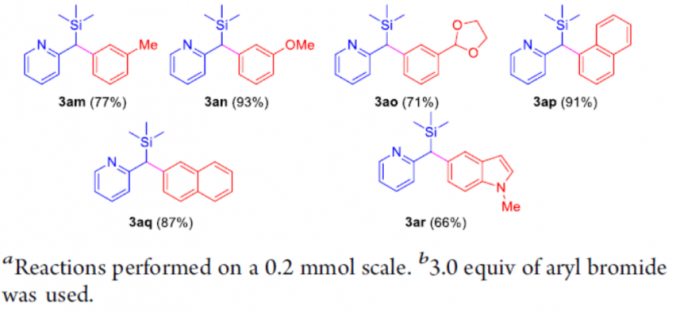
在获得上述最佳反应条件后,作者开始对芳基溴化物2进行了扩展(Scheme 2)。具有电中性基团和给体基团的芳基溴化物,如4-Me、4-tBu、4-Ph、4-OMe、4-SMe和4-NMe2,均具有良好的反应性,获得产物3ab–3ag。具有吸电子基团的底物,如4-氟、4-氯,也是合适的底物,获得优异化学选择性的相应产物3ah和3ai。同时,具有邻为取代的芳基溴化物,如2-溴甲苯、2,5-二甲基溴苯、2,5-二甲氧基溴苯,以76-93%的收率形成3aj–3al。其次,具有间位取代的底物,也以71-93%的收率提供所需的产物3am–3ao。此外,溴代萘的底物(2p和2q)以及5-溴吲哚(2r),在标准条件下也与体系相容,获得相应的产物3ap–3ar。
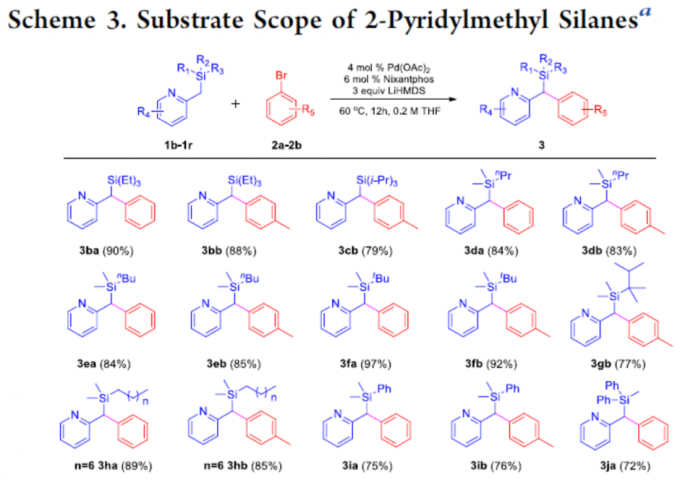
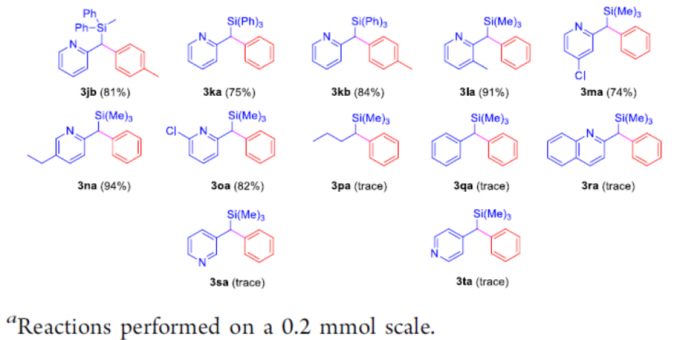
随后,作者对甲硅烷基底物1进行了相关的扩展(Scheme 3)。当使用三乙基硅烷时,以高收率生成产物3ba和3bb。对于三异丙基硅烷1c,可获得产物3cb,收率略有降低。同样,二甲基(正丙基)硅烷1d和二甲基(正丁基)硅烷1e底物,可获得以高收率的相应产物3da,3db,3ea和3eb。二甲基(叔丁基)硅烷1f也是合适的底物,获得高收率的产物3fa和3fb。值得注意的是,对于空间位阻较大的硅烷底物,如二甲基-(2,3-二甲基丁烷-2-基)硅烷1g,导致收率略有下降,以77%的收率获得所需的产物3gb。其次,若将硅烷的碳链延长,如二甲基(正辛基)硅烷1h,在标准条件下反应时,分别获得89%和85%收率的3ha和3hb。同时,各种芳基取代的硅烷也为合适底物,以72-84%收率生成相应的产物3ia、3ib、3ja、3jb、3ka和3kb。此外,当使用取代的2-吡啶底物时,以良好收率(74-94%)获得相应产物3la–3oa。然而,在标准条件下,烷基(1p)、简单苯基(1q)和其他杂环基(如1r、1s和1t))只获得痕量目标产物。
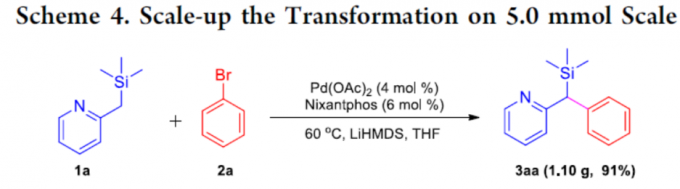
为了进一步证明该反应的实用性,作者在标准条件进行了1a与2a的克级实验,同样获得91%收率的偶联产物3aa(Scheme 4)。
同时,所获得的硅烷产物可进一步转化为具有价值的芳基(2-吡啶基)甲醇骨架(Scheme 5)。如3aa在使用PIFA作为氧化剂的条件下,可实现C-Si键到C-O键的转化,从而获得62%收率的产物4A。
总结
南京工业大学毛建友教授课题组报道了一种通过钯催化2-吡啶基甲基硅烷与芳基溴化物的交叉偶联反应,从而合成芳基(2-吡啶基)-甲基硅烷衍生物。同时,该反应具有良好的底物范围,各种给电子或吸电子的芳基溴均可顺利反应。此外,通过克级实验以及后期衍生化实验,进一步证明了反应的实用性。
参考文献
[1] (a) Hayashi, T.; Konishi, M.; Ito, H.; Kumada, M. J. Am. Chem.Soc. 1982, 104, 4962. (b) Hayashi, T.; Konishi, M.; Okamoto, Y.;Kabeta, K.; Kumada, M. J. Org. Chem.1986, 51, 3772. [2] Hofstra, J. L.; Cherney, A. H.; Ordner, C. M.; Reisman, S. E. J.Am. Chem. Soc. 2018, 140, 139. [3] (a) Yi, H.; Mao, W.; Oestreich, M. Angew. Chem. Int. Ed.2019,58, 3575. (b) Schwarzwalder, G. M.; Matier, C. D.; Fu, G. C. Angew.Chem. Int. Ed.2019, 58, 3571. [4] Zhang, J.; Bellomo, A.; Trongsiriwat, N.; Jia, T.; Carroll, P. J.;Dreher, S. D.; Tudge, M. T.; Yin, H.; Robinson, J. R.; Schelter, E. J.;Walsh, P. J. J. Am. Chem. Soc.2014, 136, 6276. [5]Jia, T.; Zhang, M.; McCollom, S. P.; Bellomo, A.; Montel, S.;Mao, J.; Dreher, S. D.; Welch, C. J.; Regalado, E. L.; Williamson, R.T.; Manor, B. C.; Tomson, N. C.;Walsh, P. J. J. Am. Chem. Soc.2017,139, 8337. [6] Li, M.; Yücel, B.; Adrio, J.; Bellomo, A.; Walsh, P. J. Chem. Sci.2014, 5, 2383. [7] (a) Hussain, N.; Frensch, G.; Zhang, J.; Walsh, P. J. Angew.Chem. Int. Ed.2014, 53, 3693. (b) Wang, Z.; Zheng, Z.; Xu, X.; Mao,J.; Walsh, P. J. Nat. Commun.2018, 9, 3365. (c) Liu, G.; Walsh, P. J.;Mao, J. Org. Lett.2019, 21, 8514. (d) Mao, J.; Wang, Z.; Xu, X.; Liu,G.; Jiang, R.; Guan, H.; Zheng, Z.; Walsh, P. J. Angew. Chem. Int. Ed.2019, 58, 11033.
[8] (a) Buslov, I.; Song, F.; Hu, X. Angew. Chem. Int. Ed.2016, 55,12295. (b) Zaranek, M.; Pawluc, P. ACS Catal.2018, 8, 9865. (c) Hu,M.-Y.; He, Q.; Fan, S.-J.; Wang, Z.-C.; Liu, L.-Y.; Mu, Y.-J.; Peng, Q.;Zhu, S.-F. Nat. Commun.2018, 9, 221. (d) Cheng, B.; Liu, W.; Lu, Z.J. Am. Chem. Soc. 2018, 140, 5014. [9] (a) Schmidtmann, E. S.; Oestreich, M. Chem. Commun.2006,3643. (b) Min, G. K.; Hernandez, D.; Skrydstrup, T. Acc. Chem. Res.2013, 46, 457. (c) Zarate, C.; Martin, R. J. Am. Chem. Soc.2014, 136,2236. (d) Chu, C. K.; Liang, Y.; Fu, G. C. J. Am. Chem. Soc.2016,138, 6404. (e) Vulovic, B.; Cinderella, A. P.; Watson, D. A. ACS Catal.2017, 7, 8113. (f) Zarate, C.; Nakajima, M.; Martin, R. J. Am. Chem.Soc.2017, 139, 1191. [10] (a) Kakiuchi, F.; Matsumoto, M.; Tsuchiya, K.; Igi, K.;Hayamizu, T.; Chatani, N.; Murai, S. J. Organomet. Chem.2003, 686,134. (b) Tsukada, N.; Hartwig, J. F. J. Am. Chem. Soc.2005, 127,5022. (c) Simmons, E. M.; Hartwig, J. F. J. Am. Chem. Soc.2010, 132,17092. (d) Ishiyama, T.; Saiki, T.; Kishida, E.; Sasaki, I.; Ito, H.;Miyaura, N. Org. Biomol. Chem.2013, 11, 8162. (e) Lee, T.; Hartwig,J. F. Angew. Chem. Int. Ed.2016, 55, 8723.



















No comments yet.