作者:石油醚
导读:
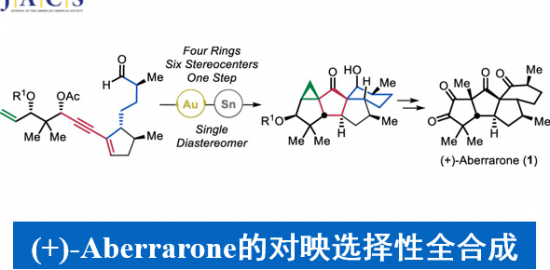
近日,香港科技大学的Hugh Nakamura教授团队在J. Am. Chem. Soc.上,以 “Atroposelective Total Synthesis of Cihunamide B” 为题,首次报道了Cihunamide B的全合成。其中关键步骤涉及1)N – Boc -L-色氨酸2和1-溴-3-氟-2-硝基苯3的SNAr反应(10 克规模);2)Larock大环化构建高度张力的环肽。
“Atroposelective Total Synthesis of Cihunamide B
Longhui Yu, Yuuya Nagata, and Hugh Nakamura*
J. Am. Chem. Soc., 2024, ASAP. doi:10.1021/jacs.3c11016”
正文
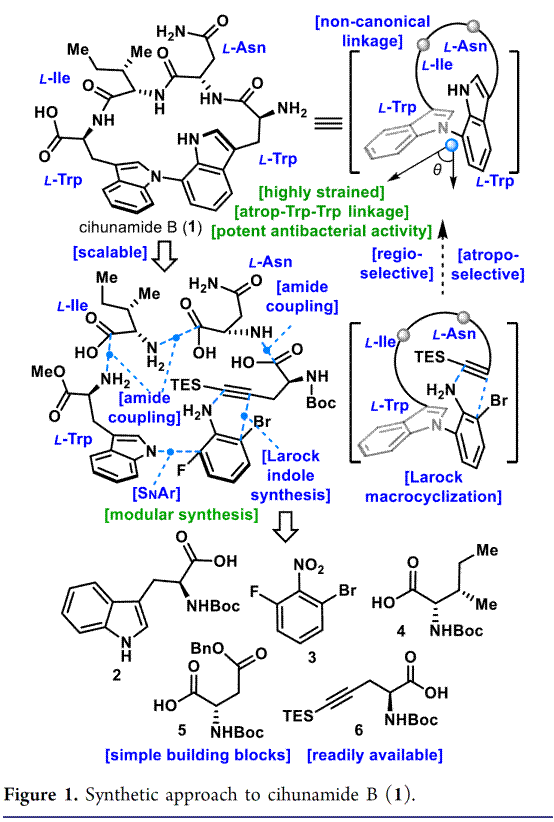
阻转异构现象广泛存在于催化剂、天然产物和药物中。因其特殊的化学结构和活性,近些年来科学家开发了多种构建阻转异构体的方法[1]。Cihunamide B (1)是由韩国科学家 Kim和Oh等人于2023年从韩国济州岛附近深海海洋沉积物中分离到的一种环肽[2],并且其对革兰氏阳性病原菌(粪肠球菌和金黄色葡萄球菌)具有抑菌活性(MIC = 8 ~ 16 μg/mL)。Cihunamide B在结构上含有阻转异构现象,即在由四个天然氨基酸单元组成的高度张力大环肽中存在阻转异构的Trp-Trp (图1)。此外,通过电子圆二色性(ECD)光谱和DFT计算确定Cihunamide的阻转异构的构型。然而,由于仅从自然界中分离到1.2 mg的cihunamide B(1),其参与生物活性研究的机制细节尚不清楚。值得注意的是,1的生物合成途径可能涉及CYP450催化的色氨酸之间C-N键的氧化偶联。
正如世卫组织在近十年中所报告的内容一样,抗生素的滥用已导致世界范围内多种耐药和超耐药细菌的传播[3],因此必须进一步开发适应耐药菌的抗生素。近年来,科学家完成了多种具有抗菌活性的环肽的全合成,如1)Sarlah和Baran独立报道了双环肽Darobactin A的全合成[4,5];2)Baran等人完成了Dynobactin A的首次全合成[6]。除此之外,环肽内的联芳基键赋予Cihunamide B超越传统环肽的稳定性和刚性,进而导致其具有特殊的空间结构。值得注意的,含有联芳基键的环肽具有广泛的生物活性。然而,尽管cihunamide B (1) 的结构和生物活性颇具吸引力,但该化合物的合成方法尚未见报道。近日香港科技大学的Hugh Nakamura教授团队首次报道了Cihunamide B的全合成,并发表于J. Am. Chem. Soc.上。
Cihunamide B(1)是由四个天然氨基酸单元组成的高度张力大环肽,并且骨架结构存在阻转异构现象的Trp-Trp。基于其特殊的骨架,作者对Cihunamide B(1)进行了相关的逆合成分析(Figure 1),即以L-色氨酸衍生物 2、1-溴-3-氟-2-硝基苯 3、L-异亮氨酸衍生物 4、L-天冬氨酸衍生物 5 和炔烃片段 6 作为砌块。其涉及的主要反应是,L-色氨酸衍生物 2和1-溴-3-氟-2-硝基苯 3之间的SNAr反应构建独特阻转-C-N键,随后与6的炔烃部分发生分子内Larock大环化以及酰胺缩合完成Cihunamide B(1)的全合成。
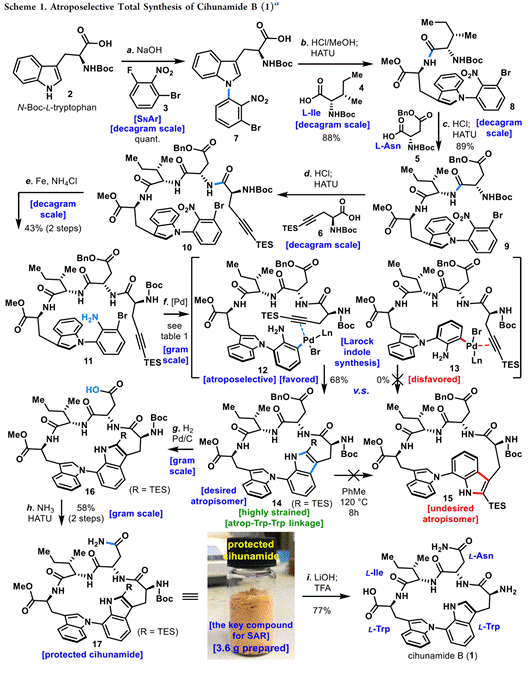
天然产物Cihunamide B(1)的全合成路径及结果,如Scheme 1所示。

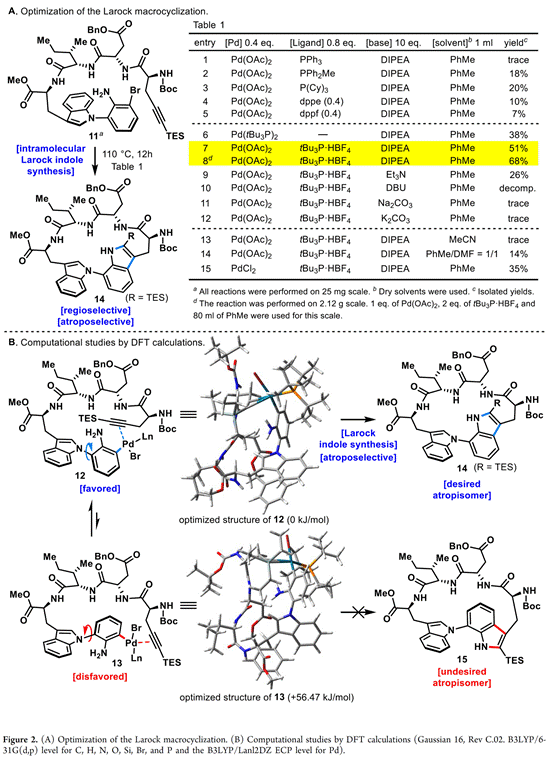
除此之外,作者对中间体11发生Larock大环化构建的色氨酸-色氨酸键进行探索,如Figure 2A所示。首先,作者以Pd(OAc)2(0.4 equiv)、甲苯为溶剂、DIPEA为碱,对配体进行了筛选。研究结果表明PPh3作为单齿配体可以获得痕量的产物14,而PPh2Me可以18%的产率获得14。值得注意11的Larock大环化过程具有完美的阻转选择性和区域选择性。比PPh3负电子配体PCy3的收率有所提高。双齿配体如dppe和dppf没有显著的效果。大体积、富电子的配位Pd(tBu3P)2可提高反应的产率,进一步研究表明Pd(OAc)2和tBu3P·HBF4对该反应至关重要,并成功以51%分离收率构建atrop-Trp-Trp键。另外一方面,对碱的研究发现,溶解度低的无机碱和小位阻的有机碱效果不佳。然而,混合溶剂PhMe/DMF = 1/1和MeCN的体系下反应效果均不佳。综上, Larock大环化最有效的条件是在DIPEA存在的情况下,在110 ℃的PhMe中使用Pd(OAc)2和tBu3P·HBF4催化反应。
接下来,作者对11发生Larock大环化过程中优异的阻转选择性进行了演技,如Figure 2B所示。即环化前体11中的芳基溴与Pd发生氧化加成。随后,在反应体系中形成中间体12,12经区域选择性迁移插入到邻近的三键上,进而避开TES基团,获得具有所需atrop-Trp-Trp键的14。另一方面,不期望的atrop-Trp-Trp键的15根本不会通过13产生。其主要原因在于反应过渡态通过13过程的能量劣势。进一步通过实验确定了14中atrop-C-N键具有热力学稳定性。
最后,通过DFT计算对Larock大环化的阻转选择性进行了研究,Figure 2B所示。计算结果表明,13的能量明显高于12,为56.47 kJ/mol,表明12具有压倒性的稳定性。假设12和13之间的平衡,计算支持从11到14的阻转选择性。虽然对结构12和13之间的能量差的定性解释并不直接,但科学家认为,由于炔和苯胺部分的手性相对排列,而不是简单的位阻影响,进而导致形成12的环具有较小的应变张力。
总结,Hugh Nakamura教授团队在J. Am. Chem. Soc.上,以 “Atroposelective Total Synthesis of Cihunamide B” 为题,首次报道了Cihunamide B的全合成。其中关键步骤涉及1)N – Boc -L-色氨酸2和1-溴-3-氟-2-硝基苯3的SNAr反应(10 克规模);2)Larock大环化构建高度张力的环肽。
参考文献:
- [1] M. C. Kozlowski, S. J. Miller, S. Perreault, Acc. Chem. Res. 2023, 56, 187. doi:10.1021/acs.accounts.2c00765.
- [2] J. S. An, H. Lee, H. Kim, S. Woo, H. Nam, J. Lee, J. Y. Lee, S.-J. Nam, S. K. Lee, K.-B. Oh, S. Kim, D.-C. Oh, Angew. Chem. Int. Ed.2023, 62, e202300998. doi:10.1002/anie.202300998.
- [3] E. Tacconelli, E. Carrara, A. Savoldi, S. Harbarth, M. Mendelson, D. L. Monnet, C. Pulcini, G. Kahlmeter, J. Kluytmans, Y. Carmeli, M. Ouellette, K. Outterson, J. Patel, M. Cavaleri, E. M. Cox, C. R. Houchens, M. L. Grayson, P. Hansen, N. Singh, U. Theuretzbacher, N. Magrini, A. O. Aboderin, S. S. Al-Abri, N. Awang Jalil, N. Benzonana, S. Bhattacharya, A. J. Brink, F. R. Burkert, O. Cars, G. Cornaglia, O. J. Dyar, A. W. Friedrich, A. C. Gales, S. Gandra, C. G. Giske, D. A. Goff, H. Goossens, T. Gottlieb, M. Guzman Blanco, W. Hryniewicz, D. Kattula, T. Jinks, S. S. Kanj, L. Kerr, M.-P. Kieny, Y. S. Kim, R. S. Kozlov, J. Labarca, R. Laxminarayan, K. Leder, L. Leibovici, G. Levy-Hara, J. Littman, S. Malhotra-Kumar, V. Manchanda, L. Moja, B. Ndoye, A. Pan, D. L. Paterson, M. Paul, H. Qiu, P. Ramon-Pardo, J. Rodríguez-Baño, M. Sanguinetti, S. Sengupta, M. Sharland, M. Si-Mehand, L. L. Silver, W. Song, M. Steinbakk, J. Thomsen, G. E. Thwaites, J. W. M. van der Meer, N. Van Kinh, S. Vega, M. V. Villegas, A. Wechsler-Fördös, H. F. L. Wertheim, E. Wesangula, N. Woodford, F. O. Yilmaz, A. Zorzet, Lancet Infect. Dis. 2018, 18, 318. doi:10.1016/S1473-3099(17)30753-3.
- [4] M. Nesic, D. B. Ryffel, J. Maturano, M. Shevlin, S. R. Pollack, D. R. Gauthier, Jr., P. Trigo-Mouriño, L.-K. Zhang, D. M. Schultz, J. M. McCabe Dunn, L.-C. Campeau, N. R. Patel, D. A. Petrone, D. Sarlah, J. Am. Chem. Soc. 2022, 144, 14026. doi:10.1021/jacs.2c05891.
- [5] Y.-C. Lin, F. Schneider, K. J. Eberle, D. Chiodi, H. Nakamura, S. H. Reisberg, J. Chen, M. Saito, P. S. Baran, J. Am. Chem. Soc. 2022, 144, 14458. doi:10.1021/jacs.2c05892.
- [6] F. Schneider, Y. Guo, Y.-C. Lin, K. J. Eberle, D. Chiodi, J. A. Greene, C. Lu, P. S. Baran, J. Am. Chem. Soc. 2024, 146, 6444. doi:10.1021/jacs.3c11560.
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载.




















No comments yet.