作者:石油醚
导读:
近日, California Institute of Technology的Brian M. Stoltz团队在J. Am. Chem. Soc.上,以 “Enantioselective Total Synthesis of (−)-Hunterine A Enabled by a Desymmetrization/Rearrangement Strategy” 为题,首次报道了天然产物(−)-Hunterine A对映选择性全合成。其中关键步骤涉及1)对称二酮的的不对称催化去对称化(catalytic asymmetric desymmetrization of a symmetrical diketone)、Beckmann重排来构建5,6-α-氨基酮(Beckmann rearrangement to construct a 5,6-α-aminoketone)、乙烯基亲核试剂和手性酮的1,2-加成(1,2-addition joins a vinyl dianion nucleophile and the enantioenriched ketone)、氮杂-Cope/ Mannich反应(aza-Cope/Mannich reaction)和 叠氮化物-烯烃的偶极环加成(azide-olefin dipolar cycloaddition) 构建五元环
“Enantioselective Total Synthesis of (−)-Hunterine A Enabled by a Desymmetrization/Rearrangement Strategy.
Elliot F. Hicks, Kengo Inoue, and Brian M. Stoltz*
J. Am. Chem. Soc., 2024, ASAP. doi: 10.1021/jacs.3c13590”
正文
单萜吲哚生物碱(Monoterpene indole alkaloids,MIAs)是一类结构多样的天然产物。由于其复杂多样的生物活性,几十年来一直受到合成化学家广泛的关注[1]。该家族分子骨通常以与各种重排萜烯单元结合的吲哚或吲哚啉片段为特征(Figure 1)。然而,已经分离含有少量含有重排的吲哚单元的MIAs,其中C2-C7键发生断裂[2] (碳编号遵循分子分离时给出的编号)。目前,科学家已经利用优雅的全合成方法完成了MIA家族成员中许多分子的全合成,包括那些含有C2-C7吲哚断裂的方法法。
天然产物(−)-Hunterine A(1)是由中国科学家张晓琦教授[3]及其同事于2019年从Hunteria Zeylanica中分离获得[3] (Figure 1),其属于一类结构独特的单帖吲哚生物碱,其中N1-C2的吲哚键发生断裂(Figure 1)。除此之外,该分子对HepG2肝癌细胞系(35 μM)具有中等的细胞毒活性。迄今为止,仅分离出一种结构相关的天然产物,并且没有合成这两种生物碱的报道。近日,California Institute of Technology的Brian M. Stoltz教授,首次报道了天然产物(−)-Hunterine A对映选择性全合成,并发表于J. Am. Chem. Soc.上。
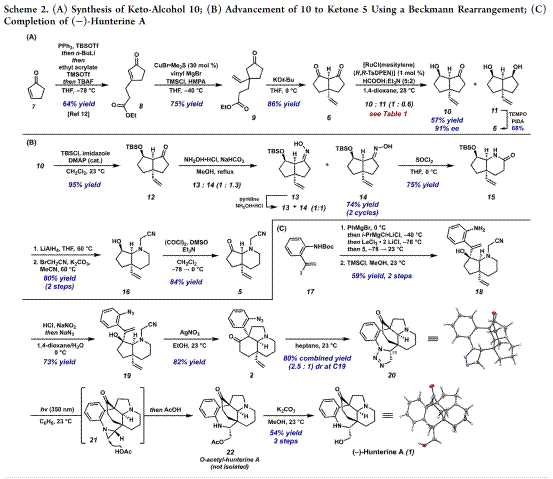
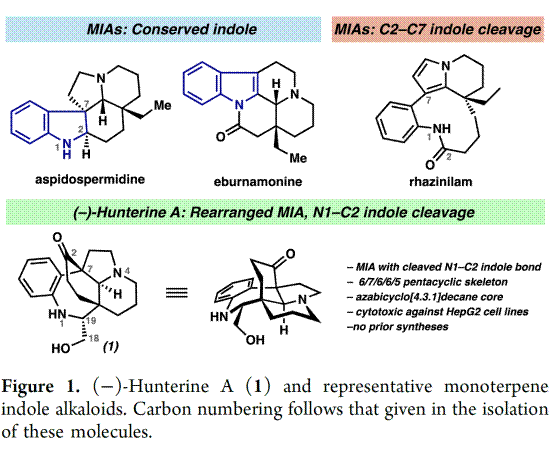 (−)-Hunterine A(1)含有桥联氮杂双环[4.3.1]癸烷核心骨架,并且还具有N1和C18醇的不和谐氧化模式(dissonant oxidation pattern)以及C19立体化学等特点。 基于其特殊的骨架,作者对(−)-Hunterine A(1)进行了相关的逆合成分析(Scheme 1A),即对称二酮6经去对称化和重排来构建砌块5,4和5通过汇聚式和非对映选择性1,2-加成反应制备砌块3。随后,3经aza-Cope/Mannich 重排反应获得中间体2。最后,2经过后期官能团修饰完成天然产物(−)-Hunterine A(1)的全合成。基于1中不含吲哚,C7全碳四元中心不可使用其他相关MIAs的合成策略,后者通常采用Fischer吲哚合成和亲核吲哚烷基化(方案1B)等策略。
(−)-Hunterine A(1)含有桥联氮杂双环[4.3.1]癸烷核心骨架,并且还具有N1和C18醇的不和谐氧化模式(dissonant oxidation pattern)以及C19立体化学等特点。 基于其特殊的骨架,作者对(−)-Hunterine A(1)进行了相关的逆合成分析(Scheme 1A),即对称二酮6经去对称化和重排来构建砌块5,4和5通过汇聚式和非对映选择性1,2-加成反应制备砌块3。随后,3经aza-Cope/Mannich 重排反应获得中间体2。最后,2经过后期官能团修饰完成天然产物(−)-Hunterine A(1)的全合成。基于1中不含吲哚,C7全碳四元中心不可使用其他相关MIAs的合成策略,后者通常采用Fischer吲哚合成和亲核吲哚烷基化(方案1B)等策略。 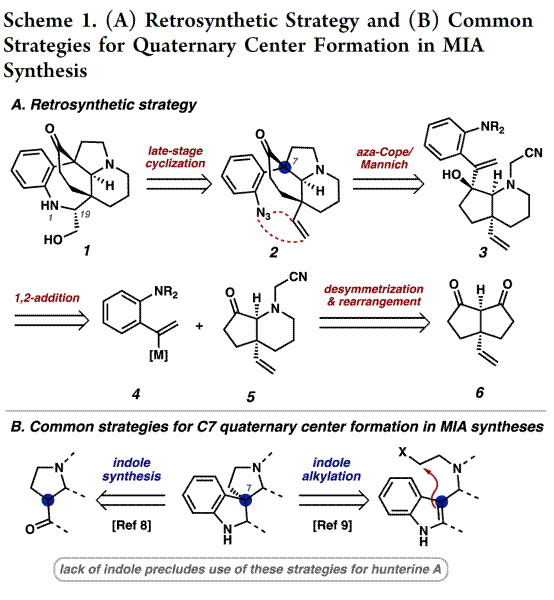
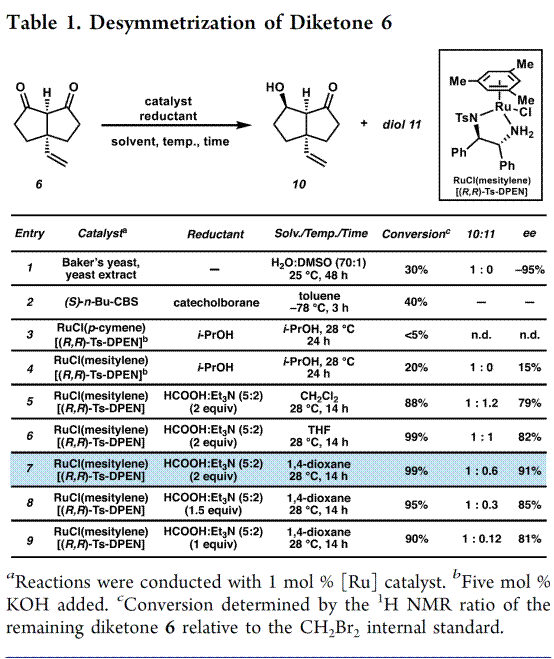
首先,作者以不对称氢化对对称二酮6的去对称化进行了筛选,如Table 1所示。即对 Noyori 的转移氢化条件进行改良[4],以 RuCl(mesitylene)(R,R-TsDPEN) 作为催化剂,在(5:2) 甲酸/三乙胺混合物实现了对称二酮6的去对称化,并且内消旋二醇11对反应有明显的手性拆分,进而提高10的对映体纯度。
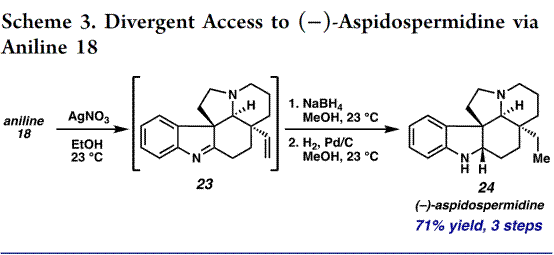
另外一方面,作者对aza-Cope/Mannich 反应进行了尝试,如图Scheme 3,即用AgNO3处理aniline 18 发生aza-Cope/Mannich 反应[5]形成吲哚亚胺 23,23用 NaBH4 处理,然后Pd/C还原双键,三步完成了(−)-aspidospermidine的合成。
天然产物(−)-Hunterine A(1)的全合成步骤,如Scheme 2所示。

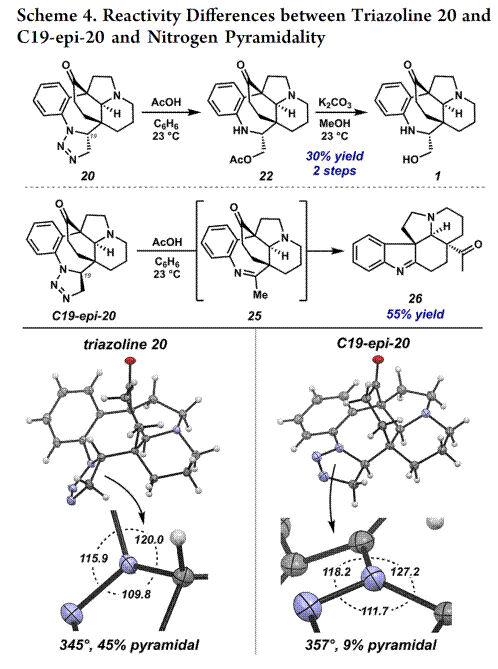
最后,作者对C19-epi-20和20中的三氮唑光解作用获得不同的反应性,如Scheme 4所示。即以苯为溶剂,用乙酸处理三唑啉 20 成功生成了 O-乙酰基-hunterine A,而用乙酸处理C19-epi-20通过中间体25以55%的收率形成亚胺26,并没有生成C19-O-乙酰基-hunterine A的差向异构体。综上,作者推测反应性差异与各个氮原子在空间的结构有关,即锥度的属性。20晶体结构中相关键角的总和表明氮原子为45%锥体[6],而在C19-epi-20中,氮原子仅为9%锥体。
总结,Brian M. Stoltz团队在J. Am. Chem. Soc.上,以 “Enantioselective Total Synthesis of (−)-Hunterine A Enabled by a Desymmetrization/Rearrangement Strategy” 为题,首次报道了天然产物(−)-Hunterine A对映选择性全合成。其中关键步骤涉及1)对称二酮的的不对称催化去对称化(catalytic asymmetric desymmetrization of a symmetrical diketone)、Beckmann重排来构建5,6-α-氨基酮(Beckmann rearrangement to construct a 5,6-α-aminoketone)、乙烯基亲核试剂和手性酮的1,2-加成(1,2-addition joins a vinyl dianion nucleophile and the enantioenriched ketone)、氮杂-Cope/ Mannich反应(aza-Cope/Mannich reaction)和 叠氮化物-烯烃的偶极环加成(azide-olefin dipolar cycloaddition) 构建五元环
参考文献:
- [1] S. E. O’Connor, J. J. Maresh, Nat. Prod. Rep. 2006, 23, 532. doi:10.1039/B512615K.
- [2] J.-J. Yao, R. Ding, X. Chen, H. Zhai, J. Am. Chem. Soc. 2022, 144, 14396. doi:10.1021/jacs.2c06518.
- [3] J. Zhang, Z.-W. Liu, Y.-L. Ao, L.-J. Hu, C.-J. Wei, Q.-H. Zhang, M.-F. Yuan, Y. Wang, Q.-W. Zhang, W.-C. Ye, X.-Q. Zhang, The Journal of Organic Chemistry 2019, 84, 14892. doi:10.1021/acs.joc.9b01835.
- [4] A. Fujii, S. Hashiguchi, N. Uematsu, T. Ikariya, R. Noyori, J. Am. Chem. Soc. 1996, 118, 2521. doi:10.1021/ja954126l.
- [5] T. B. Dunn, J. M. Ellis, C. C. Kofink, J. R. Manning, L. E. Overman, Org. Lett. 2009, 11, 5658. doi:10.1021/ol902373m.
- [6] K. L. Brown, L. Damm, J. D. Dunitz, A. Eschenmoser, R. Hobi, C. Kratky, Helv. Chim. Acta 1978, 61, 3108. doi:10.1002/hlca.19780610839.
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载.





















No comments yet.