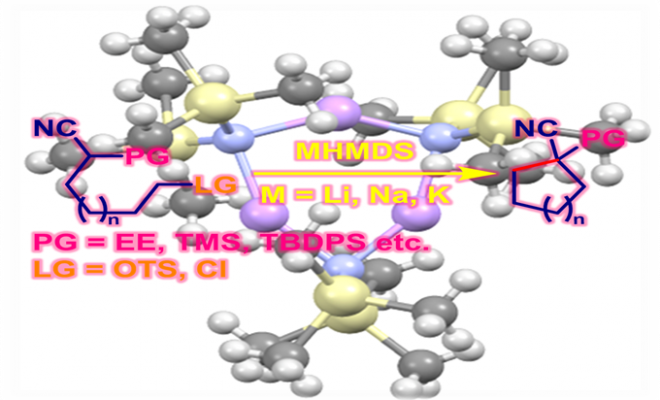
概要
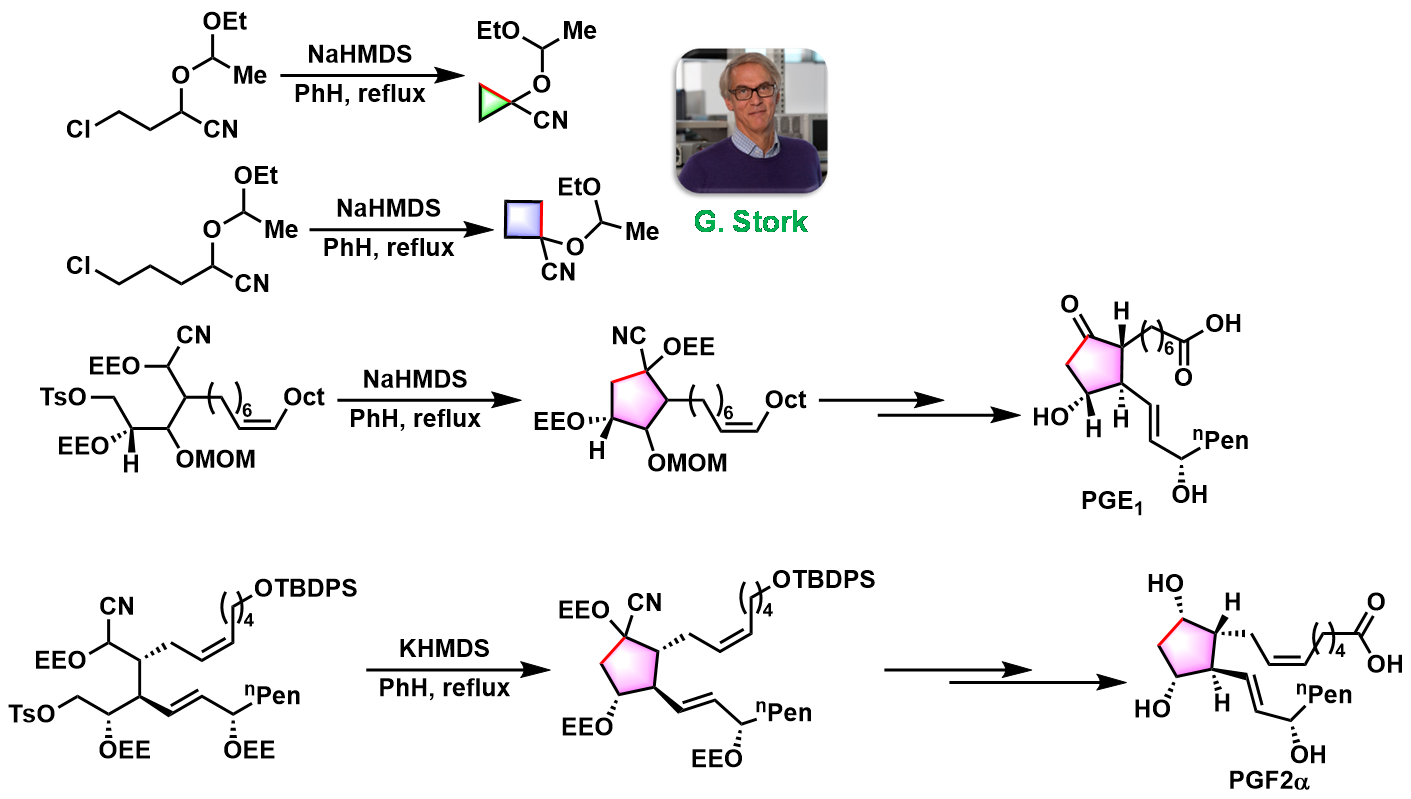
1975年美国Columbia大学化学实验室 (Chemistry Laboratories, Columbia University)的Stork研究组首次在强碱性条件(如LHMDS, NaHMDS, KHMDS)下,通过羟基保护(如TMS, TBDPS, EE等)氰醇的分子内烷基化过程进行的成环反应,成功完成3-5员环的构建,并成功应用于PGE1及PGF2α的全合成[1]-[3]。
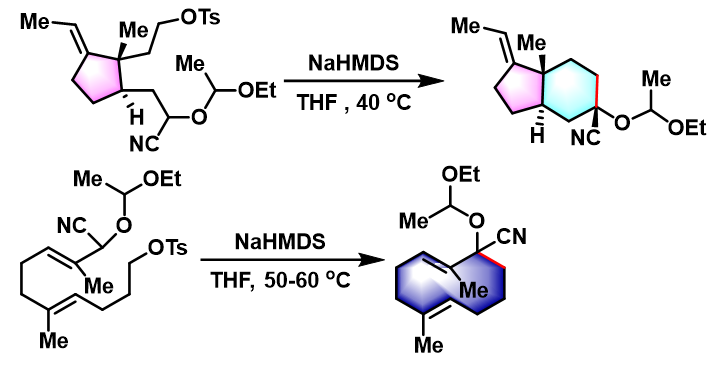
1978年,日本东京工业大学化学工程系 (東京工業大学化学工学部, Department of Chemical Engineering, Tokyo Institute of Technology)的高桥孝志 (高橋 孝志 , Takahashi Takashi)研究组进一步将上述环化条件成功应用于中环与大环化合物的合成[4]-[8]。
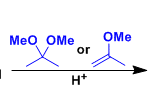
文献中将通过羟基保护 (如TMS, EE)氰醇的分子内烷基化过程而进行的环化反应称为Stork-Takahashi氰醇环化 (Stork-Takahashi cyanohydrin cyclization)。该反应条件温和,整个过程无需高度稀释的条件,同时具有优良的产率。目前,该反应已经广泛应用于各类天然产物全合成中环系构建时的关键步骤[9]-[12]。
基本文献
- [1] G. Stork, J. C. Depezay, J. d’Angelo, Tetrahedron Lett. 1975, 16, 389. doi: 10.1016/S0040-4039(00)71874-0.
- [2] G. Stork, T. Takahashi, J. Am. Chem. Soc. 1977, 99, 1275. doi: 10.1021/ja00446a055.
- [3] G. Stork, T. Takahashi, I. Kawamoto, T. Suzuki, J. Am. Chem. Soc. 1978, 100, 8272. doi: 10.1021/ja00494a045.
- [4] T. Takahashi, T. Nagashima, J. Tsuji, Tetrahedron Lett. 1981, 22, 1359. doi: 10.1016/S0040-4039(01)90319-3.
- [5] T. Takahashi, H. Yamada, J. Tsuji, J. Am. Chem. Soc. 1981, 103, 5259. doi: 10.1021/ja00407a062.
- [6] T. Takahashi, H. Nemoto, J. Tsuji, Tetrahedron Lett. 1983, 24, 3485. doi: 10.1016/S0040-4039(00)86019-0.
- [7] T. Takahashi, K. Kitamura, J. Tsuji, Tetrahedron Lett. 1983, 24, 4695. doi: 10.1016/S0040-4039(00)86230-9.
- [8] T. Takahashi, H. Nemoto, J. Tsuji, Tetrahedron Lett. 1983, 24, 2005. doi: 10.1016/S0040-4039(00)81828-6.
- [9] T. Takahashi, Y. Kanda, H. Nemoto, K. Kitamura, J. Tsuji, Y. Fukazawa, J. Org. Chem. 1986, 51, 3393. doi: 10.1021/jo00367a036.
- [10] H. Takayanagi, Y. Kitano, Y. Morinaka, Tetrahedron Lett. 1990, 31, 3317. doi: 10.1016/S0040-4039(00)89053-X.
- [11] A. S. Kende, K. Liu, I. Kaldor, G. Dorey, K. Koch, J. Am. Chem. Soc. 1995, 117, 8258. doi: 10.1021/ja00136a025.
- [12] A. S. Kende, K. Liu, I. Kaldor, G. Dorey, K. Koch, J. Am. Chem. Soc. 1995, 117, 8258. doi: 10.1021/ja00136a025.
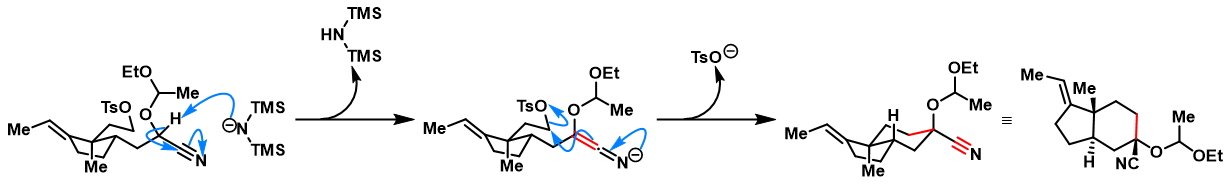
反应机理
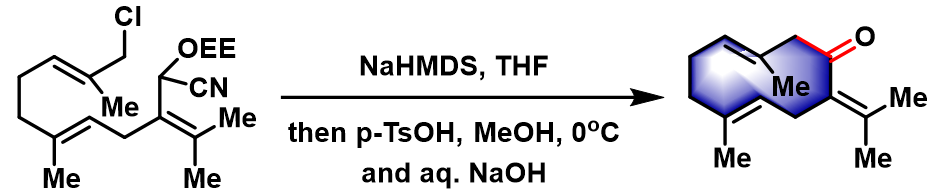
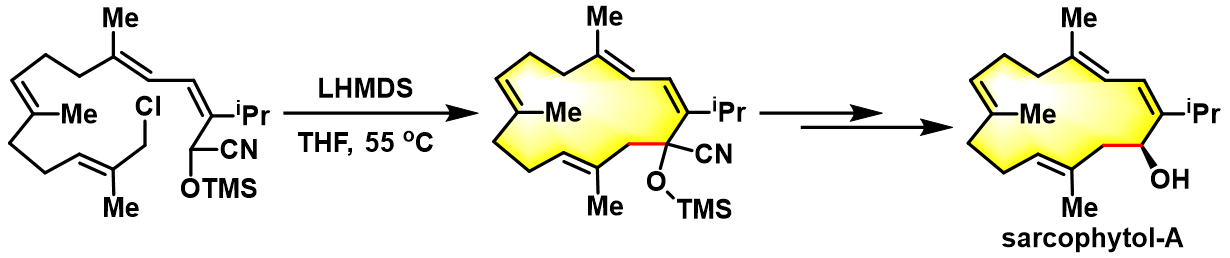
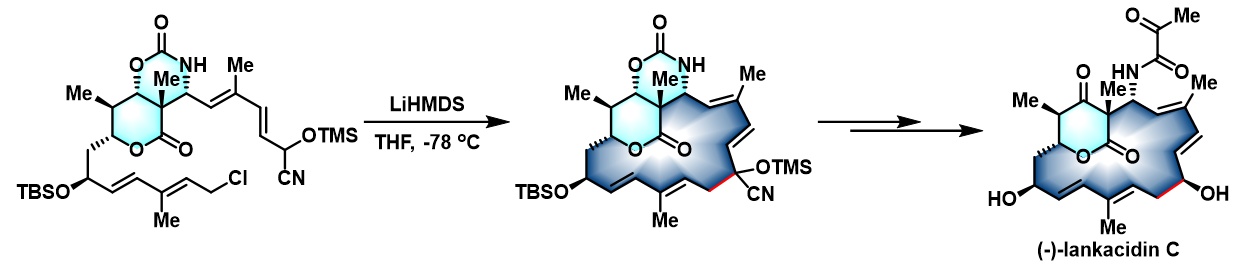
反应实例
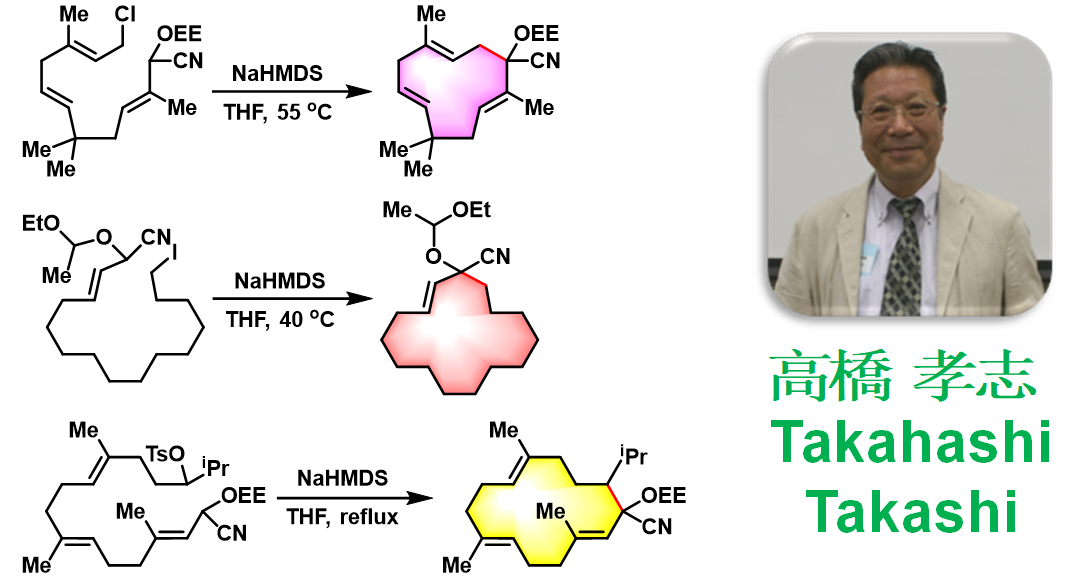
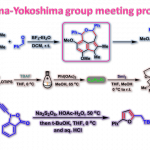
germacrone的合成[1]
sarcophytol-A的全合成[2]
(-)-lankacidin C的全合成[3]
实验步骤
80 oC,氮气气氛下,将LHMDS (1M THF溶液,5.5 eq.)滴加至氰醇 (1 eq.)的苯溶液(底物浓度为0.3 M)中,超过1h后,滴加结束。滴加结束后,维持80 oC,将上述反应混合物继续搅拌30 min,随后冷却至室温。再向上述混合物中加入用冰水冷却的饱和氯化铵溶液进行淬灭。淬灭完成后,加入乙醚进行萃取。将合并的有机相加入无水硫酸钠进行干燥,减压除去溶剂后,获得相应环化产物。
实验安全须知
小编郑重提示:氰醇具有较强的毒性,环化完成后的其他后续反应过程中可能会产生剧毒的无机氰化物或氰化氢气体。反应最好在通风效果极为优良的通风橱内小心操作。使用过的玻璃器皿最好采用饱和次氯酸钠溶液进行无害化处理。
参考文献
- [1] T. Takahashi, K. Kitamura, H. Nemoto, J. Tsuji, Tetrahedron Lett. 1983, 24, 3489. doi: 10.1016/S0040-4039(00)86020-7.
- [2] H. Takayanagi, Y. Kitano, Y. Morinaka, Tetrahedron Lett. 1990, 31, 3317. doi: 10.1016/S0040-4039(00)89053-X.
- [3] A. S. Kende, K. Liu, I. Kaldor, G. Dorey, K. Koch, J. Am. Chem. Soc. 1995, 117, 8258. doi: 10.1021/ja00136a025.
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!


















No comments yet.