本文作者:杉杉
导读
近日, ICIQ的P. Melchiorre研究团队在Angew. Chem. Int. Ed.中发表论文,报道首例通过PC (photoredox catalyst)以及Lewis碱催化的不对称自由基共轭加成反应方法学,进而成功完成一系列对映富集的手性吡咯烷酮分子的构建。
Lewis Base-Catalysed Enantioselective Radical Conjugate Addition for the Synthesis of Enantioenriched Pyrrolidinones
C. Hartley, F. Schiel, E. Ermini, P. Melchiorre, Angew. Chem. Int. Ed. 2022, ASAP. doi: 10.1002/anie.202204735.
正文
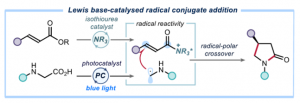
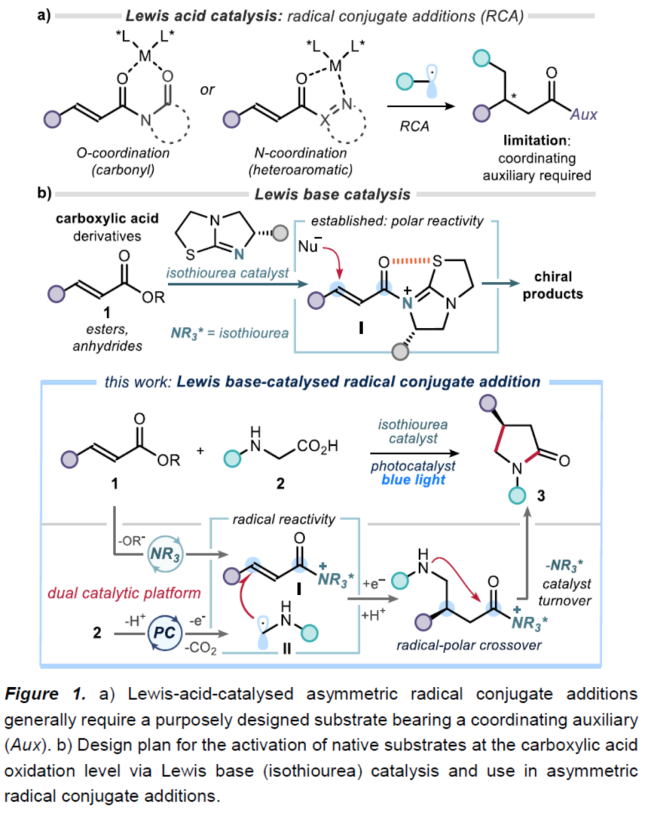
自由基共轭加成 (RCA, radical conjugate addition)反应方法学是构建碳-碳键的有效策略之一,然而,对于对映选择性RCA反应方法学的相关研究,至今仍面临诸多挑战 (Figure 1a) [1]-[4]。这里,受到选择亚胺离子催化的简单烯醛[5]以及烯酮[6]参与的RCA反应方法学以及通过异硫脲催化剂活化羧酸衍生物分子[7]相关研究报道的启发,ICIQ的P. Melchiorre研究团队成功开发出首例通过PC (photoredox catalyst)以及Lewis碱催化的对映选择性自由基共轭加成反应方法学 (Figure 1b)。
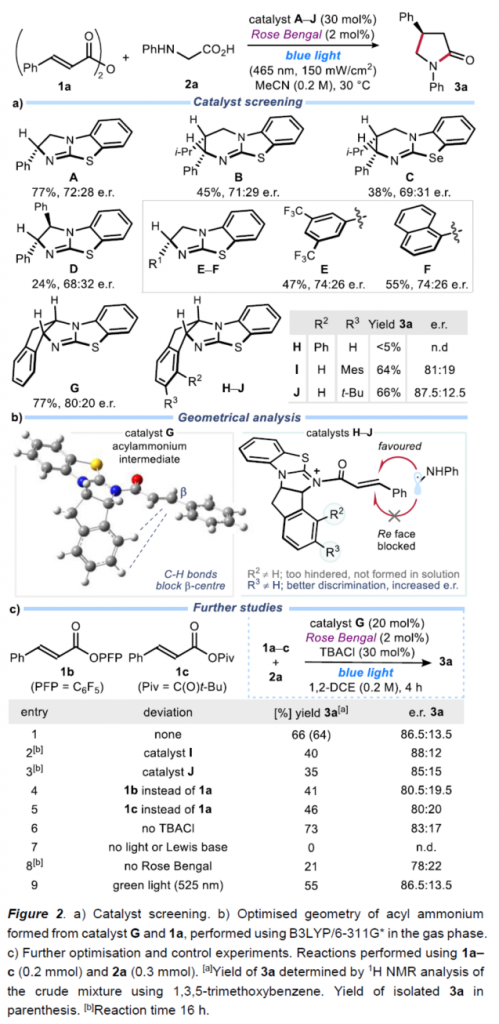
首先,作者采用肉桂酸酐1a与N-苯基甘氨酸2a作为模型底物,进行相关反应条件的优化筛选 (Figure 2)。进而确定最佳的反应条件为:采用catalyst J作为异硫脲催化剂,Rose Bengal作为PC,乙腈作为反应溶剂,蓝光辐射,反应温度为30oC,最终获得66%收率的手性产物3a (87.5:12.5 e.r.) (Figure 2a)。同时,作者发现,采用catalyst G作为异硫脲催化剂,Rose Bengal作为PC,TBACI作为添加剂,1,2-DCE作为反应溶剂,蓝光辐射,反应温度为30oC,同样能够获得66%收率的手性产物3a (86.5:13.5 e.r.)(Figure 2c)。
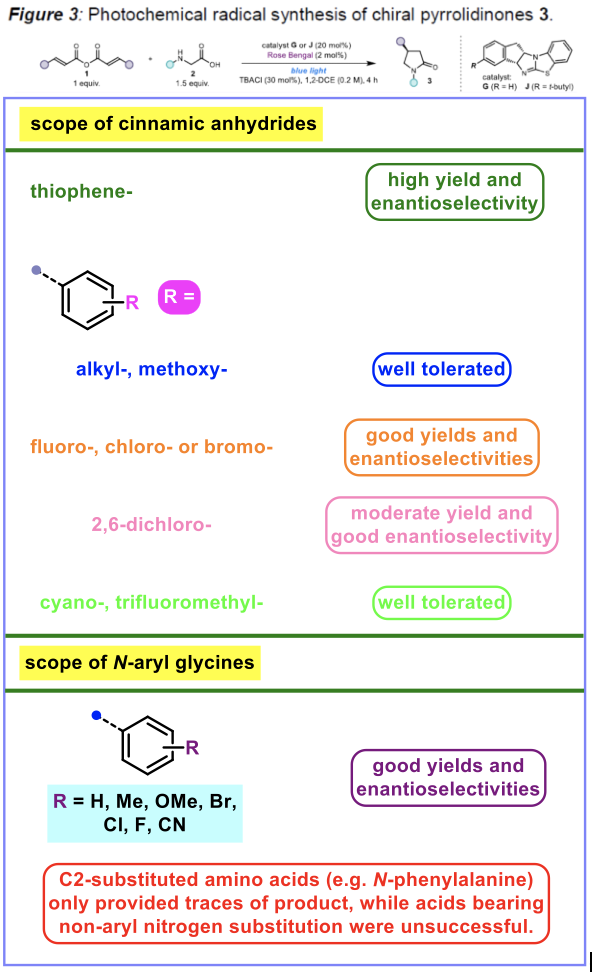
在上述的最佳反应条件下,作者对一系列肉桂酸酐与N-芳基甘氨酸 (Figure 3)以及其它烷基取代的α,β-不饱和酯底物的应用范围进行深入研究 (Figure 4)。
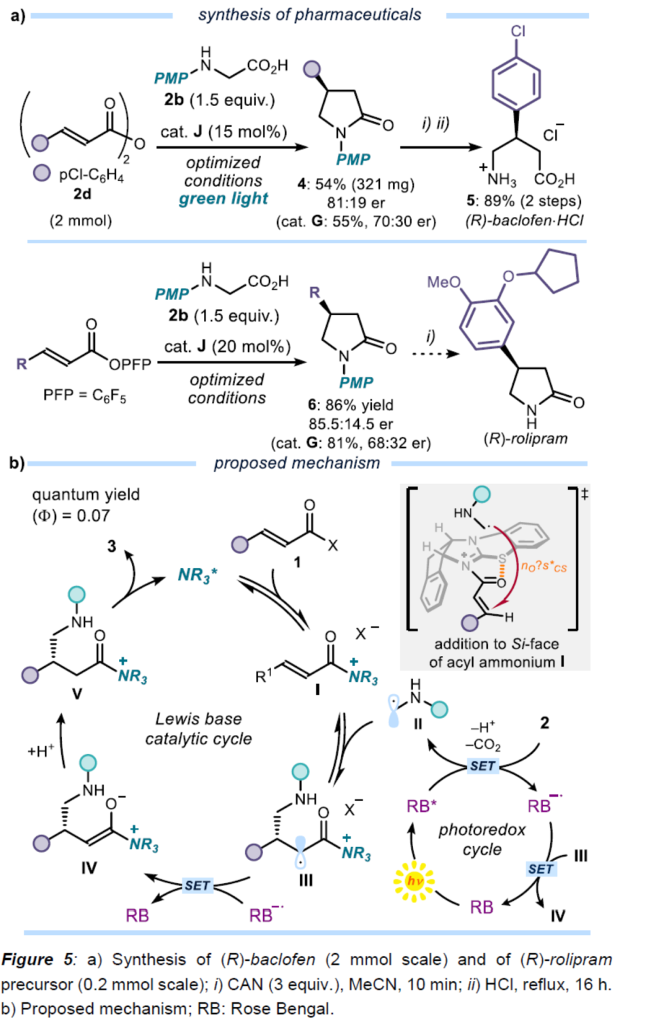
之后,该小组通过如下的一系列研究进一步表明,这一全新的不对称自由基共轭加成策略具有潜在的合成应用价值 (Figure 5a)。同时,基于前期相关的文献报道[8]-[9],作者提出如下合理的反应机理 (Figure 5b)。
总结
ICIQ的P. Melchiorre课题组报道报道首例通过PC (photoredox catalyst)以及Lewis碱催化的不对称自由基共轭加成反应方法学,进而成功完成一系列对映富集的手性吡咯烷酮分子的构建。这一全新的对映选择性RCA策略具有广泛的底物应用范围、优良的对映选择性控制以及良好的合成应用价值等优势。
参考文献
- [1] H. Wu, R, Radinov, N. A. Porter, J. Am. Chem. Soc. 1995, 117, 11029. doi: 10.1021/ja00149a035.
- [2] (a) M. P. Sibi, J. Ji, J. Wu, S. Gürtler, N. A. Porter, J. Am. Chem. Soc. 1996, 118, 9200. doi: 10.1021/ja9623929.
- (b) M. P. Sibi, J. Ji. J. Org. Chem. 1997, 62, 3800. doi: 10.1021/jo970558y.
- (c) M. P. Sibi. J. Ji, J. B. Sausker, C. P. Jasperse, J. Am. Chem. Soc. 1999, 121, 7517. doi: 10.1021/ja991205e.
- [3] M. Shaw, J. Twilton, D. W. C. MacMillan, J. Org. Chem. 2016, 81, 6898. doi: 10.1021/acs.joc.6b01449.
- [4] (a) J. Ma, J. Lin, L. Zhao, K. Harms, M. Marsch, X. Xie, E. Meggers, Angew. Chem. Int. Ed. 2018, 57, 11193. doi:10.1002/anie.201804040.
- (b) C. Wang, K. Harms, E. Meggers, Angew. Chem. Int. Ed. 2016, 55, 13495. doi: 10.1002/anie.201607305.
- [5] (a) E. Le Saux, D. Ma, P, Bonilla, C. M. Holden, D. Lustosa, P. Melchiorre, Angew. Chem. Int. Ed. 2021, 60, 5357. doi: 10.1002/anie.202014876.
- (b) M. Silvi, C. Verrier, Y. P. Rey, L. Buzzetti, P. Melchiorre, Nat. Chem. 2017, 9, 868. doi: 10.1038/nchem.2748.
- [6] (a) J. J. Murphy, D. Bastida, S. Paria, M. Fagnoni, P. Melchiorre, Nature 2016, 532, 218. doi: 10.1038/nature17438.
- (b) A. Bahamonde, J. J. Murphy, M. Savarese, É. Brémond, A. Cavalli, P. Melchiorre, J. Am. Chem. Soc. 2017, 139, 4559. doi: 10.1021/jacs.7b01446.
- [7] (a) J. Bitai, M. T. Westwood, A. D. Smith, Org. Biomol. Chem. 2021, 19, 2366. doi: 10.1039/D0OB02208J.
- (b) S. Vellalath, D. Romo, Angew. Chem. Int. Ed. 2016, 55, 13934. doi: 10.1002/anie.201602217.
- [8] (a) M. E. Abbasov, B. M. Hudson, D. J. Tantillo, D. Romo, J. Am. Chem. Soc. 2014, 136, 4492. doi:10.1021/ja501005g.
- (b) M. E. Abbasov, B. M. Hudson, D. J. Tantillo, D. Romo, Chem. Sci. 2017, 8, 1511. doi: 10.1039/C6SC04273B.
- [9] L. Buzzetti, G. E. M. Crisenza, P. Melchiorre, Angew. Chem. Int. Ed. 2019, 58, 3730. doi: 10.1002/anie.201809984.
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载






















No comments yet.