作者:石油醚
导读:
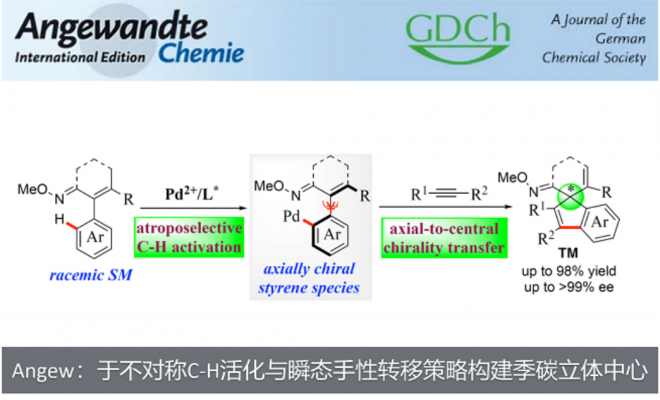
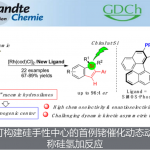
近日,杭州师范大学的徐利文教授课题组基于不对称C-H官能化反应和瞬态轴向中心手性转移策略实现了含有全碳季碳立体中心茚类化合物的合成。该方法具有操作简单、条件温和、产率高、立体选择性好等特点。这是首例将轴手性苯乙烯结构金属中间体应用到催化手性转移过程的报道,为各种螺环和非螺环茚类化合物的合成奠定了基础,同时拓宽了季碳立体中心的构筑方法。硕士研究生韩路路为文章的第一作者,崔玉明副研究员和徐利文教授为共同通讯作者。该研究成果得到了国家自然科学基金委、浙江省自然科学基金和杭州师范大学的经费支持。
“Palladium-Catalyzed Transient Chirality Transfer and Atroposelective C-H Functionalization to Access Quaternary Stereocenters.
Lu-Lu Han, Yu-Ming Cui, Qing Yang, Li-Lei Fang*, Li-Wen Xu*
Angew. Chem. Int. Ed. 2022, e202211922. doi : 10.1002/anie.202211922”
正文:
全碳季碳立体中心广泛存在于天然产物、药物和生物活性分子中。然而,在不对称催化合成领域,手性全碳季碳立体中心的高效构筑一直是化学家公认的研究热点同时也是极具挑战性的课题。过去几年,杭州师范大学徐利文团队基于去对称化策略开发出卓有成效的四取代碳及硅立体中心的合成方法(Angew. Chem., Int. Ed. 2019, 58, 897; Angew. Chem., Int. Ed. 2019, 58, 6747; Angew. Chem. Int. Ed. 2020, 59, 790; Acc. Chem. Res. 2021, 54, 452)。在诸多构建季碳立体中心的合成方法中,钯催化的不对称Heck偶联反应因具有产率高、对映选择性好等优点而倍受关注。美中不足的是,此类反应通常以预先官能化的卤代烃为原料,导致整个合成路线的原子、步骤经济性较差(图1a)。近年来,C-H键活化反应及串联反应已被广泛研究,为复杂功能分子的合成提供了更加简洁高效的策略。最近,徐利文课题组巧妙结合不对称C-H官能化反应和瞬态轴向中心手性转移(transient axial-to-central chirality transfer)策略成功实现了全碳季碳立体中心的构筑。
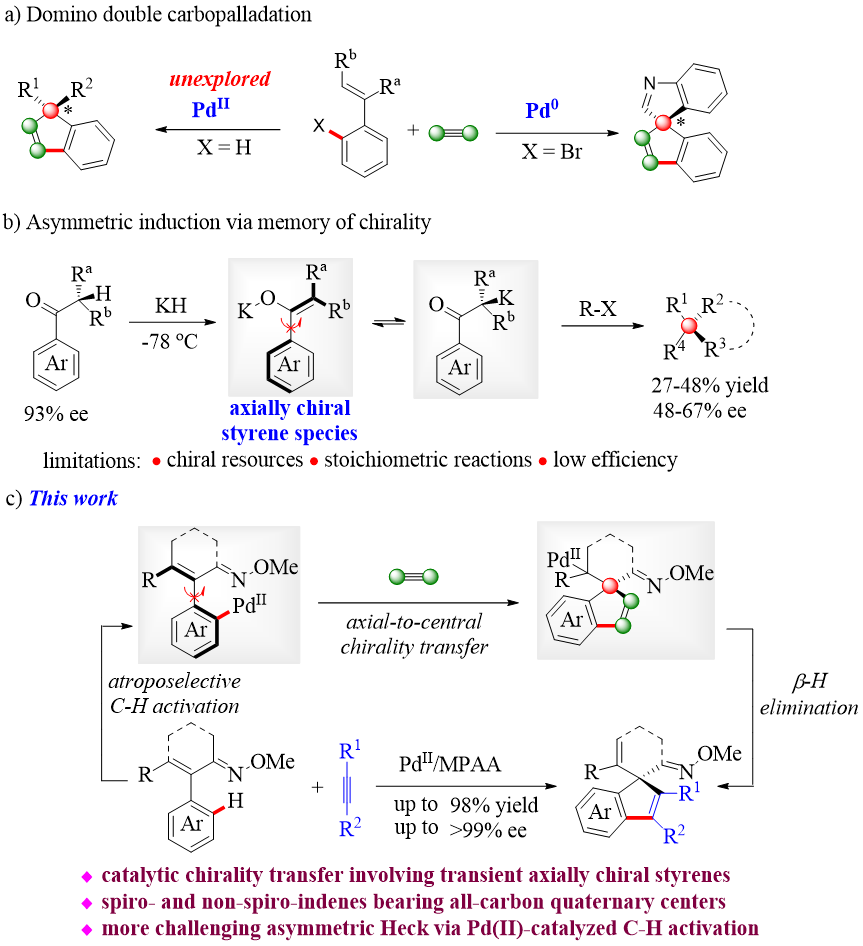
图1. 季碳立体中心的合成策略
早在1991年,Fuji等利用轴手性苯乙烯中间体的手性记忆功能实现了羰基α-位季碳立体中心的构建(图1b)。但该反应存在诸如以手性化合物为原料、需要使用计量试剂、手性转移效率低等问题有待解决。作者在前期研究工作中通过钯催化不对称C-H键烯基化反应合成了系列轴手性苯乙烯类化合物(Chem. Commun.2018, 54, 10706; Chem. Eur. J., 2021, 27, 4336)。受以上研究工作启发,作者设想,如果能够抑制β-H消除反应,原位产生的轴手性苯乙烯结构的钯物种有可能对不饱和键进行分子间/分子内的连续转移插入反应,有望在关环的同时伴随轴手性向中心手性转移过程,从而实现全碳季碳立体中心的构建(图1c)。
为了验证上述想法的可行性,作者以肟醚1a为模型底物,用二苯乙炔替代之前使用的端烯烃进行反应,在其它条件不变的情况下便能够以30%的产率和96%的对映选择性得到目标手性螺环化合物3aa,该化合物结构也经X-射线衍射分析得到证实。经过系列反应参数的筛选和优化,最终能够以高达89%的产率和97%的对映选择性得到目标产物。在此基础上作者考察了底物肟醚的适用范围(图2)。研究发现,定向基、环己烯环、芳环连有不同取代基的底物均能顺利进行反应。肟基氮原子上的取代基对偶联反应的结果有较大影响,OMe的表现优于OBn。值得注意的是,环戊烯酮衍生的肟醚底物可以发生反应但只能得到消旋产物,由此可见,C-H活化步骤能够形成相对稳定的轴手性钯物种是取得高对映选择性的先决条件。
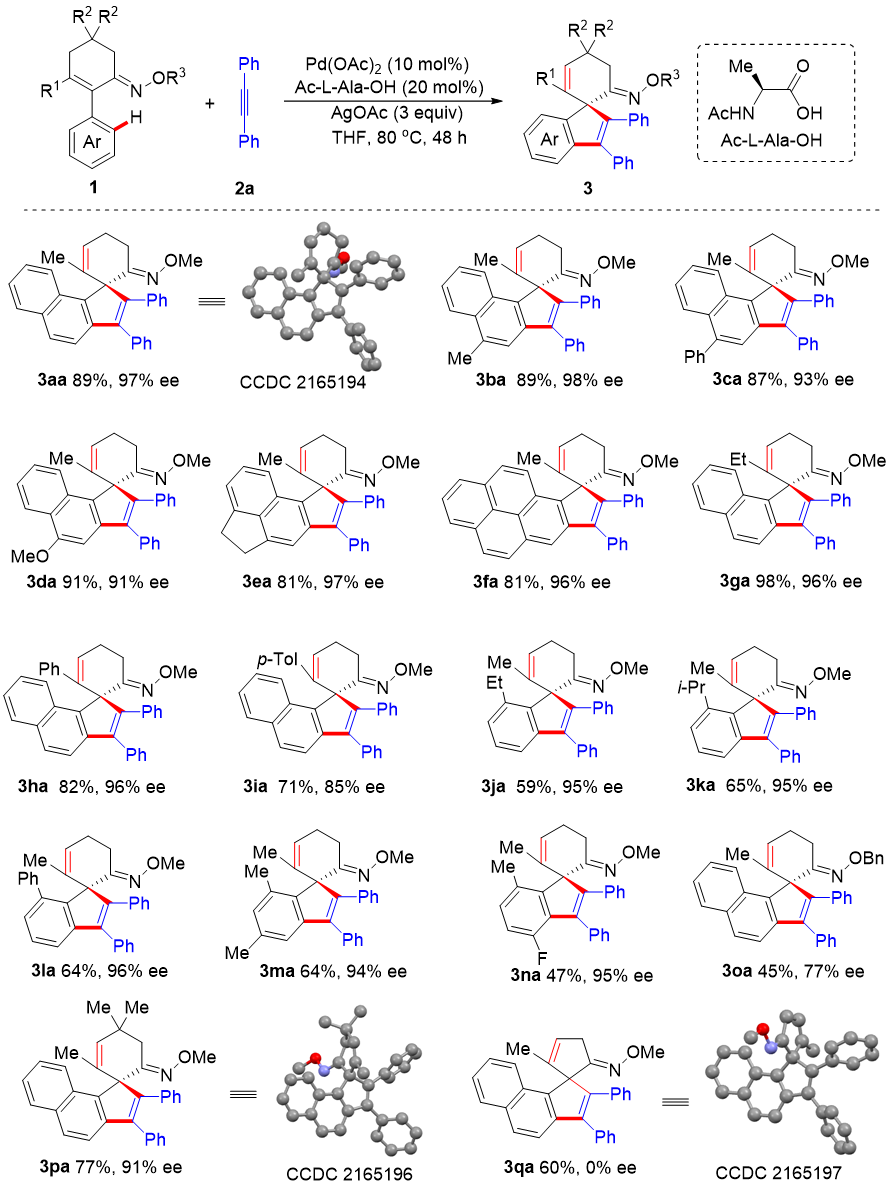
图2. 环状肟醚底物范围
随后作者考察了各种内炔,在同样条件下,大多数对称结构的二芳基乙炔和非对称的苯丙炔均能发生螺环化反应(图3)。
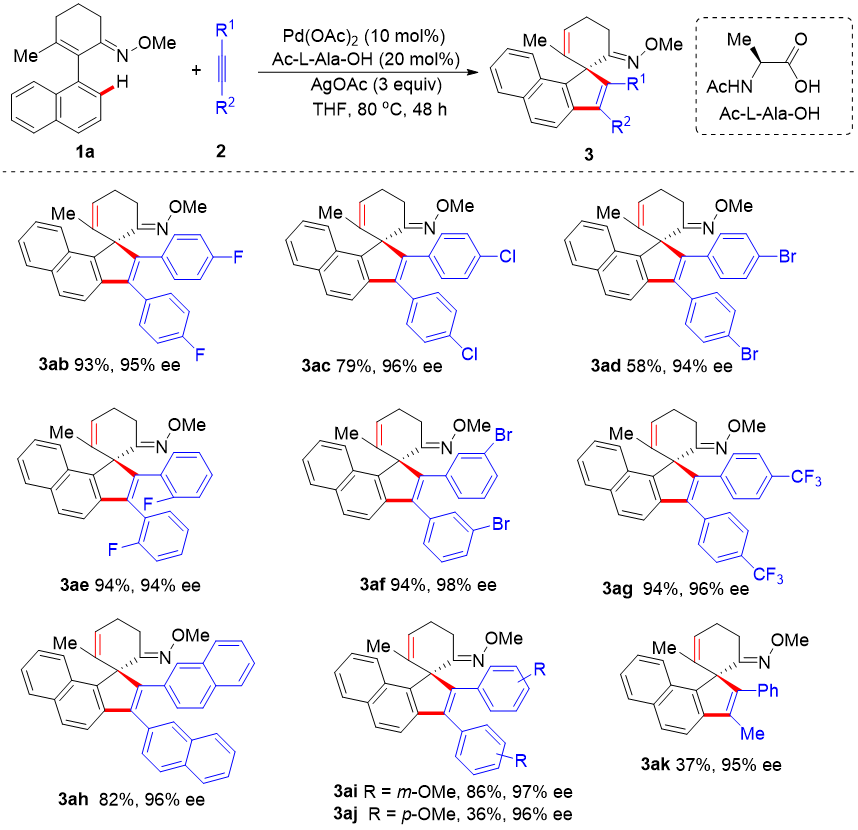
图3. 炔烃范围
受上述不对称螺环化反应结果鼓舞,随后作者又转向更具挑战性的开链结构肟醚底物的环化反应研究,以期合成非螺环结构的手性茚类化合物,反应情况如图4所示。作者对化合物3ra的单晶进行结构分析,确定其为(R)-构型,与螺环产物构型相反。
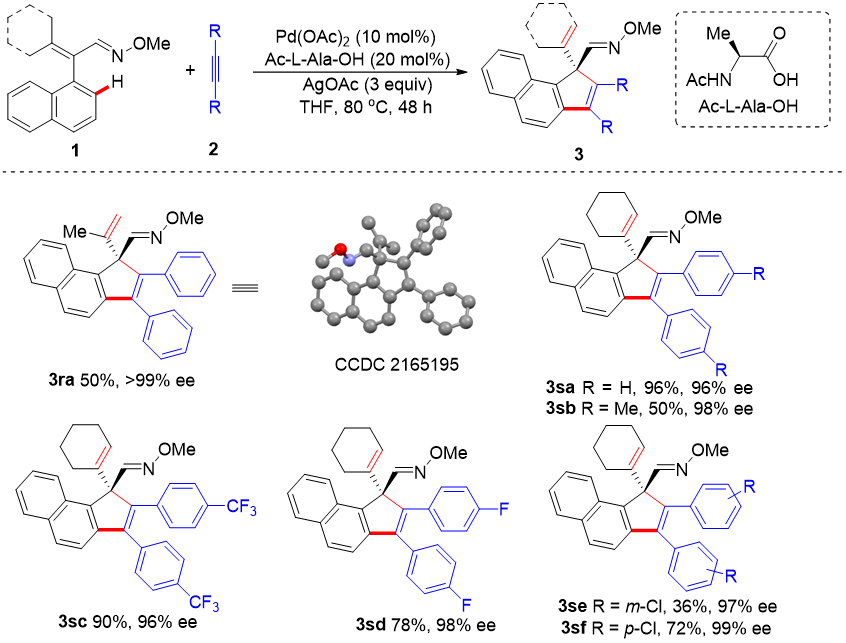
图4. 开链肟醚底物的范围
另外,作者通过实验证实了该反应可进行放大合成,且肟醚定向基可容易脱去,手性能够得到保持。最后作者结合已有研究工作提出了该串联环化反应可能的机理(图5)。以消旋化合物1为原料,经动态动力学拆分形成轴手性苯乙烯结构钯络合物A。炔烃配位并转移插入生成7元环钯物种B,随后发生分子内的转移插入并伴随手性转移生成含有碳立体中心的中间体C。C发生β-H消除形成目标产物。

图5. 可能的反应机理
综上所述,徐利文课题组基于不对称C-H官能化反应和瞬态轴向中心手性转移策略实现了含有全碳季碳立体中心茚类化合物的合成。该方法具有操作简单、条件温和、产率高、立体选择性好等特点。这是首例将轴手性苯乙烯结构金属中间体应用到催化手性转移过程的报道,为各种螺环和非螺环茚类化合物的合成奠定了基础,同时拓宽了季碳立体中心的构筑方法。
(徐利文教授供稿)
相关链接
徐利文教授简介:https://yjg.hznu.edu.cn/c/2021-07-21/813942.shtml
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载


















No comments yet.